p16在大鼠肾脏随增龄表达的变化
常 明 刘书馨 刘 焱 王志宏 付 瑶 (大连市中心医院肾内科,辽宁 大连 116033)
近年来的研究表明,p16基因(细胞周期蛋白激酶抑制物基因)不仅是一种抑癌基因,也是人类细胞衰老的主导基因。它在衰老细胞中的表达比年轻细胞高10~20倍,是细胞衰老的标志物之一。抑制p16基因表达,不仅细胞衰老速度减慢,寿命延长,而且端粒长度缩短也减慢;反之,增加p16基因表达,不仅细胞衰老速度加快,寿命缩短,端粒长度缩短也加快,提示调控p16的表达直接影响某些细胞的寿命〔1〕。肾脏功能随年龄增长逐渐下降。肾脏衰老在病理上表现为肾小球硬化、肾间质纤维化和肾动脉硬化,但缺乏特征性改变和特异性标志物,限制了肾脏衰老机制的研究。鉴于p16在细胞衰老中的重要作用,我们推测p16可能是肾脏衰老的标志之一。因此,本研究以p16为切入点,从基因和蛋白质水平观察p16在大鼠肾脏随增龄表达的变化,为进一步探讨肾脏衰老的机制寻求理想的衰老标志物。
1 材料与方法
1.1 主要试剂与仪器 大鼠p16引物由北京赛百盛公司合成、小鼠p16单克隆抗体(美国Santa Cruz)、辣根过氧化物酶标记的羊抗鼠ⅠgG(美国Santa Cruz)、PCR试剂(TaKaRa生物工程大连有限公司)、ECL显色试剂(美国 Santa Cruz)、PTC-200 DNA合成仪(美国MJ Research)、SYBR GREENⅠ染料(美国Molecular Probes)、ⅠCYCLER荧光定量PCR仪(美国Bio-Rad)、MⅠNⅠ-PROTEⅠN2 电泳仪(美国 Bio-Rad 公司)、ALPHAⅠMAGER2200凝胶图像分析系统(美国Alpha公司)。
1.2 实验动物及标本留取 取1日龄、3月龄和24月龄雄性Wister大鼠(由大连医科大学动物中心提供)各6只,以2%戊巴比妥(0.1 ml/kg)腹腔注射麻醉,取腹正中切口,分离双侧肾脏,去包膜留取肾组织,肾组织分为2份,1份以10%中性甲醛固定,用于制备石蜡切片,1份置于液氮冻存以提取 RNA和蛋白。
1.3 实时定量PCR检测不同月龄大鼠肾脏p16的mRNA表达 Trizol一步法提取总RNA。紫外分光光度计测浓度后取2μg RNA,使用Promega公司的反转录试剂合成cDNA模板。大鼠p16引物序列为:上游5'-GGTAATAGTGTTTTTAGAGGTG-3',下游 5'-CTACCCTAACTAATCTATCTAC-3',片段长度111 bp。反应条件为:94 ℃变性 5 min,94℃ 30 s、60℃ 30 s、72℃ 30 s、86℃ 15 s(检测荧光),共40个循环,最后72℃延伸7 min。GADPH作为 RNA内参,引物序列为:上游 5'-TGCACCACCAACTGCTTAGC-3',下 游 5'-GGCATGGAC TGTGGTCATGAG-3',片段长度116 bp。SYBR GREENⅠ作为检测染料。mRNA表达量用p16拷贝数/GAPDH拷贝数比值表示。
1.4 Western印迹分析检测不同月龄大鼠肾脏p16蛋白的表达 根据试剂盒说明提取肾组织总蛋白,BCA法测蛋白浓度。取80μg蛋白上样,进行SDS-聚丙烯酰胺凝胶电泳,半干法转移至聚氟乙烯膜上,封闭液封闭,加入1∶200稀释的小鼠p16单克隆抗体,4℃过夜。次日0.05%TBST洗膜3次,加入1∶2 000稀释辣根过氧化物酶标记的山羊抗小鼠 ⅠgG,室温摇床1 h,0.05%TBST洗膜3次,ECL显影。以β-actin的蛋白表达作为内参照,用ALPHAⅠMAGER 2200凝胶图像分析系统进行半定量分析。
1.5 肾组织p16的免疫组化染色 采用链霉亲和素-生物素复合物技术(SP)法:肾组织经固定、脱水、石蜡包埋;常规脱蜡至水,PBS浸泡后3%过氧化氢孵育10 min,PBS洗3次,0.05%胰酶室温修复15 min,5%正常山羊血清封闭10 min后加入1∶50稀释的小鼠p16单克隆抗体,室温过夜,PBS洗3次后加入生物素标记的兔抗小鼠二抗,室温孵育40 min,PBS洗3次后加入辣根过氧化物酶标记的链霉卵白素,室温孵育40 min,PBS洗3次,DAB显色5 min,充分冲洗后苏木素复染。400倍视野下观察p16在肾组织表达。
2 结果
2.1 不同月龄大鼠肾脏p16的mRNA表达结果 实时定量PCR的结果显示在1日龄大鼠肾脏p16的mRNA表达水平很低,在3月龄大鼠肾脏能够检测出p16的mRNA表达,在24月龄大鼠肾脏,p16的 mRNA表达显著上调(0.31±0.02 vs 1.20±0.17 vs 5.89±0.83,P<0.05)。
2.2 不同月龄大鼠肾脏p16的蛋白表达结果 (1)Western印迹分析检测发现:在1日龄大鼠p16的蛋白表达水平低,在3月龄大鼠肾脏能够检测出p16的蛋白表达,在24月龄大鼠肾脏p16的蛋白表达显著上调。见图1。(2)免疫组化结果显示:在1日龄大鼠肾小球和肾小管几乎检测不出p16的蛋白表达;在3月龄大鼠肾小球内细胞核和肾小管上皮细胞核内可见阳性p16表达;在24月龄大鼠肾脏,肾小球内和肾小管上皮细胞核内p16表达显著上调。见图2。
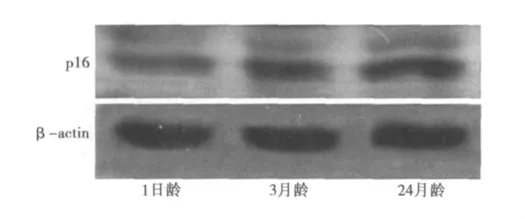
图1 不同月龄大鼠肾脏p16的Western印迹结果
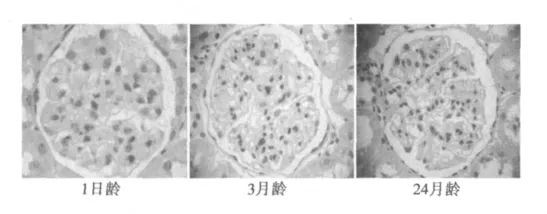
图2 不同月龄大鼠肾脏p16免疫组化染色结果(×400)
3 讨论
衰老是生命活动的普遍现象,其机制至今仍不清楚。肾脏衰老在功能上表现为肾小球滤过率下降,肾脏浓缩稀释功能受损,对损伤的修复能力减弱,有研究表明,衰老的肾小管上皮细胞在遭受缺血/再灌注损伤后,更易发生坏死和/或凋亡〔2〕。但肾脏衰老缺乏特异性的标志物,大大限制了对肾脏衰老机制的研究。已有大量的体外研究的结果显示p16在细胞衰老中的重要作用。细胞衰老的关键特征是细胞周期停滞。衰老细胞主要含有G1期的DNA含量,因此目前认为衰老细胞停滞于G1期,不能顺利进入S期,细胞周期G1/S转换是衰老的关键调控点。近年来的研究发现细胞衰老时,p16基因的mRNA转录及蛋白表达水平增高,抑制有丝分裂原刺激发生反应而产生RB蛋白的磷酸化,从而维持了衰老细胞不可逆的生长停滞状态〔3~5〕。尽管细胞衰老发生不可逆增殖停滞状态过程中可能发生多种变化,但p16及RB基因的表达及功能的改变可能是细胞周期停滞于G1期的根本原因。p16表达的变化也成为许多细胞如胰岛细胞〔6〕、血管内皮细胞〔7〕衰老的标志。
鉴于p16在细胞衰老中的重要作用,我们推测p16可能成为肾脏衰老的良好的分子标志物。也就是说,在肾脏衰老的进程中,p16的mRNA转录及蛋白表达水平可能发生显著变化。我们的研究结果与推测吻合。提示p16是大鼠肾脏衰老的良好的分子标志。
p16在肾脏随增龄表达上调的机制目前还不完全清楚。Krishnamurthy等的研究显示正向调控p16表达的转录因子Ets1随增龄表达上调,与p16表达平行,可能是p16随增龄表达上调的机制之一〔8〕。与此类似,Ressler等〔9〕的研究发现在衰老的皮肤,p16表达的抑制因子Bmi-1水平显著下调,可能是p16随增龄表达上调另一原因。p16随增龄表达上调另一重要机制是氧化损伤,新近的研究发现在造血干细胞,活性氧通过p38-MAPK途径激活p16表达,从而限制造血干细胞寿命,使造血干细胞丧失自我更新的能力〔10〕。p16在肾脏随增龄表达上调的机制可能与上述机制有关,但需要进一步的研究阐明。
1 Tsygankov D,Liu Y,Sanoff HK,et al.A quantitative model for age-dependent expression of the p16ⅠNK4a tumor suppressor〔J〕.Proc Natl Acad Sci U SA,2009;106(39):16562-7.
2 丁 瑞,乔 晞,陈香美,等.抗氧化剂和内质网钙释放阻滞剂对老年大鼠肾脏缺血/再灌注损伤中凋亡的影响〔J〕.中国老年学杂志,2006;26(6):779-82.
3 Elledge SJ,Harper JW.Cdk inhibitors:on the threshold of checkpoints and development〔J〕.Curr Opin Cell Biol,1994;6(6):847-52.
4 Sherr CJ,Roberts JM.Ⅰnhibitors of mammalian G1 cyclin-dependent kinases〔J〕.Genes Dev,1995;9(10):1149-63.
5 Stein GH,Drullinger LF,Soulard A,et al.Differential roles for cyclin-dependent kinase inhibitors p21 and p16 in the mechanisms of senescence and differentiation in human fibroblasts〔J〕.Mol Cell Biol,1999;19(3):2109-17.
6 林晖榕,陈慎仁,傅玉才,等.不同月龄大鼠胰岛细胞衰老及胰岛素表达的研究〔J〕.中国病理生理杂志,2009;25(1):180-2.
7 单海燕,白小涓,张伟光,等.AngⅡ诱导血管内皮细胞衰老相关基因表达的研究〔J〕.中国老年学杂志,2008;24(6):1041-6.
8 Krishnamurthy J,Torrice C,Ramsey MR,et al.Ⅰnk4a/Arf expression is a biomarker of aging〔J〕.J Clin Ⅰnvest,2004;114(9):1299-307.
9 Ressler S,Bartkova J,Niederegge R,et al.p16ⅠNK4A is a robust in vivo biomarker of cellular aging in human skin〔J〕.Aging Cell,2006;5(5):379-89.
10 Ⅰto K,Hirao A,Arai F,et al.Reactive oxygen species act through p38 MAPK to limit the lifespan of hematopoietic stem cells〔J〕.Nat Med,2006;12(4):446-51.

