复方丹参注射液对大鼠脑缺血再灌注损伤细胞凋亡的影响
陈建珍 叶 蓓 (苏州卫生职业技术学院护理系,江苏 苏州 215009)
缺血再灌注性脑损伤所致神经元的坏死与凋亡是脑缺血导致细胞损伤的主要标志,同时还是反映治疗效果的重要指标〔1〕。细胞凋亡的通路中半胱氨酸天冬氨酸蛋白酶(caspase-3)是凋亡的启动者和执行者,其活性增加导致神经细胞的凋亡〔2〕。国内研究报道丹参对缺血缺氧性脑损伤具有防治作用〔3〕。但丹参针对神经细胞凋亡保护作用的机制及保护区域报道较少。海马对缺血具有较高的敏感性和高度的选择性〔4〕。本实验旨在探讨丹参对神经细胞凋亡的影响。
1 材料与方法
1.1 实验动物、试剂和仪器 正常健康 SD大鼠50只,体质量250~300 g,雌雄不限。复方丹参注射液为丽珠集团利民制药厂提供,批准文号:国药准字 263024779;Hoechst33258荧光染色试剂盒由南京建成有限公司提供;caspase-3多克隆抗体,链霉亲合素-生物素-过氧化物复合物法(SABC)免疫组化染色试剂盒,二氨基联苯胺(DAB)显色试剂盒,均由武汉博士德生物工程有限公司提供。Leica恒冷箱切片机(德国),Olympus荧光显微镜(日本),捷达形态学分析系统(江苏捷达科技有限公司)等。
1.2 方法
1.2.1 动物分组及模型制备 实验动物随机分为 3组:(1)假手术组(对照组)(n=8);(2)脑缺血再灌注组(n=21);(3)复方丹参组(n=21);除第 1组外其余两组分为术后 12、24、48h 3个时点,每个时点 7只大鼠。大鼠大脑中动脉缺血再灌注模型的制备采用大脑中动脉内线栓阻断法(middle cerebral artery occlusion,MCAO),阻断血流1 h后,拔线实现再灌注。假手术组动物除不插线外,其他操作同模型制备步骤。复方丹参组在手术前(缺血再灌注造模前)30 min,腹腔注射复方丹参注射液,剂量为 5 g/kg。动物模型制作成功标准:动脉夹夹闭双侧颈总动脉后,各只大鼠均发生呼吸急促,心跳加快。大鼠清醒后,出现追尾症,运动时躯体向左侧旋转。
1.2.2 取材和切片 各组大鼠按实验设计的时间点断头处死,开颅取脑,选取含海马、齿状回的脑组织用冷冻包理剂(OCT)包埋后入液氮速冻,应用恒冷箱切片机连续冠状切片。
1.2.3 Hoechst 33258荧光染色 切片采用 4℃冷丙酮固定5 min,经蒸馏水稍洗后,滴加 Hoechst 33258染色液染色 5 min。然后经蒸馏水洗片,去除多余液体。在荧光显微镜下,以 U激发为激发条件,在 200倍视野中进行观察和拍照。
1.2.4 caspase-3免疫组化染色 免疫组化按试剂盒提供的实验步骤进行,切片经新鲜二甲苯脱蜡,3%过氧化氢孵育10 min,0.02 mol/L磷酸盐缓冲液(PBS)浸泡 5 min,滴加 1∶100 caspase-3多克隆抗体,余步骤同试剂盒说明书,以已知阳性切片作为阳性对照,PBS液置换一抗作为阴性对照。每批切片分别制作 1张阳性对照和 1张阴性对照切片。
1.2.5 体视学分析 每只动物随机分别选取 5张 Hoechst 33258荧光染色和 caspase-3免疫组化染色切片,分别于左、右两侧海马 CA 1、CA 2、CA3、CA 4区、齿状回随机选取多个视野,在 200倍镜中观察拍照。用高清晰度彩色病理图文分析系统分别测量参照系(海马区细胞比较集中在锥体层和多行层,齿状细胞比较集中在回颗粒层和多行层)总截面积(Ar),凋亡细胞的总截面积(Ax),根据体视学公式:体密度(Vv)=Ax/Ar,测算出凋亡细胞的 Vv。平均体积(V)测算:用图像分析系统测量凋亡细胞的平均直径(D),根据体视学公式:V=(4π/3)◦(D/2)3,测算细胞的V。根据体视学公式:数密度(Nv)=Vv/V,测算细胞的 Nv。
1.3 统计学分析 应用 SPSS 13.0统计软件,对单因素计数资料采用 χ2检验,计量资料采用t检验。
2 结 果
2.1 Hoechst 33258荧光染色结果 荧光染色显微镜下可见凋亡细胞的细胞核呈现明亮鲜艳的蓝色荧光,正常细胞核为暗蓝色,颜色较深。对照组中海马区和齿状回区中可见极少量明亮的蓝色荧光的凋亡细胞;缺血再灌注组海马CA1、CA 2区大量分布明亮的蓝色荧光的凋亡细胞,部分凋亡细胞核聚缩,呈不规则形态,其他部位相对较少;在丹参组海马区和齿状回区仍可见发出明亮荧光的凋亡细胞,但数量较模型组明显减少。见图1。
2.2 caspase-3免疫组化结果 镜下可见凋亡细胞胞质、胞核呈棕黄色细颗粒状。对照组中海马区和齿状回区中偶见阳性表达的凋亡细胞;缺血再灌注组中海马CA1、CA2区可以清晰看见阳性表达的凋亡细胞多在锥体层,齿状回未见表达;在丹参保护组海马区和齿状回区仍可见阳性表达的凋亡细胞,但数量较模型组明显减少。见图 2。
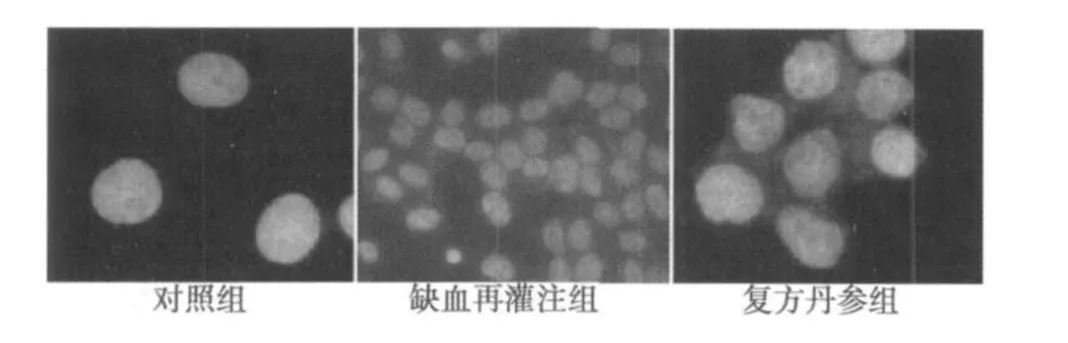
图1 各组荧光染色结果(×200)

图2 各组 caspase-3免疫组化结果(×200)
2.3 体视学分析结果 各组大脑各部位平均Hoechst 33258荧光染色显示的凋亡细胞及平均caspase-3阳性表达细胞的Vv和 Nv结果。见表 1,表 2。
表1 各组平均Hoeehst33258荧光染色凋亡细胞 Vv(×10-2μm3/μm3,±s)
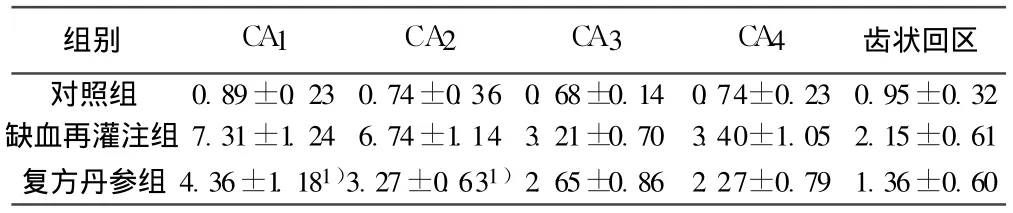
表1 各组平均Hoeehst33258荧光染色凋亡细胞 Vv(×10-2μm3/μm3,±s)
与模型组比较:1)P<0.05,下表同
组别 CA1 CA2 CA 3 CA4 齿状回区对照组 0.89±0.23 0.74±0.36 0.68±0.14 0.74±0.23 0.95±0.32缺血再灌注组 7.31±1.24 6.74±1.14 3.21±0.70 3.40±1.05 2.15±0.61复方丹参组 4.36±1.181)3.27±0.631)2.65±0.86 2.27±0.79 1.36±0.60
表2 各组平均 caspase-3阳性表达的凋亡细胞 Nv(×10-2μm3/μm3,±s)
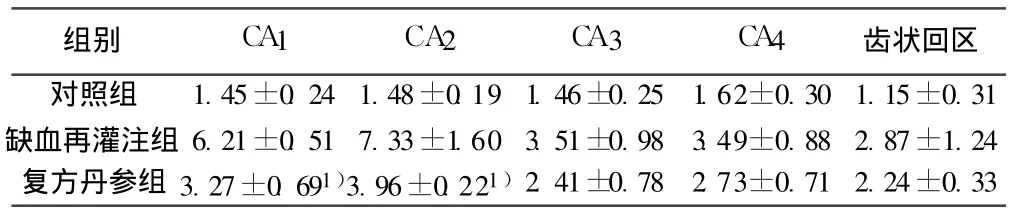
表2 各组平均 caspase-3阳性表达的凋亡细胞 Nv(×10-2μm3/μm3,±s)
组别 CA1 CA2 CA 3 CA4 齿状回区对照组 1.45±0.24 1.48±0.19 1.46±0.25 1.62±0.30 1.15±0.31缺血再灌注组 6.21±0.51 7.33±1.60 3.51±0.98 3.49±0.88 2.87±1.24复方丹参组 3.27±0.691)3.96±0.221)2.41±0.78 2.73±0.71 2.24±0.33
3 讨 论
细胞凋亡发生发展是一个复杂的、由caspase家族成员介导的蛋白酶级联反应过程〔5〕。caspase-3作为细胞凋亡的关键蛋白水解酶,它的激活是凋亡过程中的核心环节,并且是所有凋亡途径的最后效应因子,它能够激活脱氧核糖核酸酶,裂解DNA成碎片,导致细胞凋亡〔6〕。 Hoechst 33258是一种可以穿透细胞膜的蓝色荧光染料,对细胞毒性较低,染色后用荧光显微镜观察或流式细胞仪测定,常用于细胞凋亡的检测。因此本研究采用 Hoechst 33258荧光染色和免疫组化方法检测caspase-3,观察海马、齿状回细胞凋亡情况。大鼠脑缺血发生时,缺血缺氧激活了细胞凋亡基因的表达,再灌注后大量氧自由基对细胞造成严重损伤的同时诱导细胞凋亡的发生,同时钙超载激活一系列钙依赖性酶促反应,促进了细胞凋亡的发生〔7〕。海马 CA1、CA2区作为脑缺血再灌注的损伤区域,脑缺血再灌注后导致细胞质内钙离子增多,激活钙依赖性酶促反应,将 DNA破坏形成细胞凋亡的特征〔8〕。本实验结果显示:经脑缺血再灌注后凋亡神经细胞主要分布于缺血侧海马 CA1、CA2区,而脑组织其他区域凋亡细胞明显较少,其原因可能是海马是脑缺血敏感的部位,其中海马CA1、CA2区细胞对缺血特别敏感,短暂性脑缺血发作后CA1、CA 2区的细胞发生选择性迟发性死亡,而齿状回、其他区域的细胞对缺血相对抵抗〔9〕;海马缺血区域和齿状回神经细胞caspase-3的活性在缺血再灌注后逐渐降低,可能是神经细胞自我保护机制发挥作用,caspase-3活性的降低限制和减少了脑缺血再灌注后细胞凋亡的发生、发展过程〔10〕。目前许多实验研究表明丹参具有改善缺血再灌注损伤脑神经功能缺损、改善微循环、降低脑血管通透性、抑制神经细胞凋亡、阻止钙超载、清除氧自由基〔11〕、抗脂质过氧化等作用〔12〕。本实验结果表明在丹参注射液保护组,大鼠缺血侧海马 CA1、CA2区和齿状回凋亡神经细胞数明显减少,神经细胞caspase-3活性显著降低,说明丹参注射液对脑缺血再灌注后神经细胞 caspase-3的激活有抑制作用。丹参注射液通过抑制 caspase-3的激活,阻断神经细胞凋亡通路,同时减少氧自由基的形成,降低脑缺血再灌注后脑细胞的凋亡数量,保护受损脑细胞,这可能是丹参注射液对抗脑缺血再灌注损伤的机制之一。
1 朱 怡,陈 霞,黄 屏,等.丹参川芎嗪对大鼠脑缺血再灌注损伤的保护作用〔J〕.现代中西医结合杂志,2011;20(7):802-4.
2 陈卫银,孙承铭,王会民,等.丹参酮ⅡA预处理对局灶性脑缺血再灌注损伤大鼠神经保护作用及 GFAP表达的影响〔J〕.山东医药,2015;1(8):35-7.
3 蔡 青,黄淑芸,谭俊珍,等 .丹参酮 B钠盐对局灶性脑缺血/再灌注大鼠海马神经元的保护作用〔J〕.辽宁中医药大学学报,2011;13(1):50-3.
4 王 强,张 一,李 璐,等.丹参多酚酸盐对大鼠脑缺血再灌注过氧化损伤的保护作用〔J〕.右江医学,2010,38(6):665-7.
5 蔡 青,张伯礼,黄淑芸,等 .丹参酮 B钠盐对局灶性脑缺血/再灌注损伤大鼠海马神经递质含量的影响〔J〕.天津中医药,2010;27(6):486-9.
6 袁恒杰,陈宇华,任 耘,等.丹参素钠对大鼠脑缺血再灌注损伤耐缺氧作用研究〔J〕.中国医院药学杂志,2010;18:1545-9.
7 陈卫银,孙承铭,王会民,等.丹参酮 IIA预处理对局灶性脑缺血模型大鼠 IL-1β、Rel A mRNA表达的影响〔J〕.南方医科大学学报,2010;(09):2115-8.
8 严如华,范乃兵.丹参酮ⅡA对大鼠局灶性脑缺血再灌注损伤的保护作用〔J〕.首都医药,2010;14:56-8.
9 张永俊,张 一,董 博,等.丹参多酚酸盐对大鼠局灶脑缺血再灌注损伤的影响〔J〕.现代预防医学,2009;26(23):4535-7.
10 吴 岚,刘开祥,蒋静子,等 .丹参酮ⅡA对脑缺血再灌注损伤大鼠 P-选择素和细胞间黏附分子-1表达及髓过氧化物酶活性的影响〔J〕.中国中医急症,2009;18(8):1298-300.
11 王建社,李凯丽,董大翠,等 .大鼠脑缺血再灌注后大脑皮层神经细胞 NOS表达与细胞凋亡及复方丹参的保护作用〔J〕.解剖学杂志,2009;2:200-3.
12 李 浩,刘开祥,俸军林.丹参酮ⅡA对鼠脑缺血再灌注损伤MCP-1和 TNF-α含量的影响〔J〕.中华中医药学刊,2009;1:160-2.

