改变血红素加氧酶-1水平对糖尿病大鼠氧化应激状态及肾功能的影响
邢邯英 野战鹰 张冬会 付玲娣 裴华颖 (河北省人民医院老年医学重点实验室,河北 石家庄 050051)
氧化应激在糖尿病肾病(DN)的发生和发展中起重要作用,高血糖诱导的活性氧产生增多是糖尿病(DM)血管并发症包括 DN在内发生的主要因素。血红素加氧酶-1(HO-1)被证实是重要的生理性氧自由基清除剂,体外实验表明,在严重缺氧情况下,其抗脂质过氧化的能力优于维生素 E,被认为是最佳的抗自由基物质。可见 HO-1是细胞的一种内源性保护蛋白,那么激活的HO-1通路是否可以起到对抗 DM肾脏氧化损伤的作用呢?本实验复制了 DM大鼠模型,观察 HO-1的诱导剂正铁血红素(Hemin)和其抑制剂锌原卟啉(ZnPP)对 DN大鼠肾功能和氧化应激状态的影响,探讨HO-1与 DN的关系。
1 材料与方法
1.1 材料 链脲佐菌素、Hemin、ZnPP均购自美国 Sigma公司;逆转录酶为Promega公司产品;血清总抗氧化能力(TAOC)和丙二醛(MDA)检测试剂盒购自南京建成生物试剂公司。PCR扩增体系为北京赛百盛基因技术有限公司产品。
1.2 方法
1.2.1 DM大鼠模型的制备和分组 将雄性 SD大鼠随机分成 4组:①生理溶剂对照组;②DM组:大鼠按 50 mg/kg一次性腹腔注射链脲佐菌素以诱导 DM,于模型成功后 5 w,10 w和15 w处死动物;③Hemin组:确认 DM大鼠模型成功后每日腹腔注射 Hemin 30μmol/kg,连续 5 w;④ZnPP组:确认模型成功后腹腔注射 ZnPP 10μmol/kg,连续 5 w。
1.2.2 血清 TAOC和 MDA含量测定 全血 4℃离心3 000 r/min,10 min。取血清分装待测。按试剂盒说明操作。
1.2.3 尿白蛋白排泄率(UEA)检测 留取 24 h尿液-20℃冰箱保存待测 UEA。
1.2.4 RT-PCR技术检测肾脏 HO-1、TNF mRNA表达 取各组大鼠肾组织,Trizol一步法提取总 RNA,在逆转录酶催化下合成 cDNA。HO-1的上、下游引物分别为:5′-CTG GAA GAG GAG ATA GAG CGAA-3′,3′-TCTTAG CCT CTT CTG TCA CCCT-5′,扩增产物全长 433 bp;TNF-α的上、下游引物分别为:上游 5′-CGA GTGACA AGCCCG TAGCC-3′;下游为 :5′-GGA TGA ACA CGC CAG TCG CC-3′,扩增产物全长 255bp。以 β-actin作为内参。扩增产物进行 1.5%琼脂糖电泳,UVP凝胶显像仪扫描并进行图像分析。用目的基因的吸光度与β-actin吸光度的比值代表目的基因的相对表达含量。
2 结 果
2.1 血清 TAOC与 MDA含量的变化 与对照组血清 TAOC相比,5、10、15 w DM大鼠血清 TAOC均下降,并且有时间依赖性(P均 <0.01);MDA含量则逐步上升,10、15 w DM大鼠MDA含量较对照组明显增高(P<0.01);Hemin组血清TAOC虽仍低于对照组水平(P<0.05),但是与 DM组大鼠相比明显增高(P<0.05);而给予 ZnPP后 DM大鼠 MDA含量进一步增加,TAOC继续降低,与 DM组相比均有显著差异(P<0.05)。见表 1。
表1 各组大鼠 TAOC及 MDA含量的变化(±s)

表1 各组大鼠 TAOC及 MDA含量的变化(±s)
与对照组比较:1)P<0.05,2)P<0.01;与 5 w DM组比较:3)P<0.05
组别 TAOC(U/ml) MDA(nmol/L)对照组 8.84±0.81 4.56±0.28 DM组 5 w组 6.24±0.872) 5.63±0.52 10 w组 5.32±0.912) 6.82±0.472)15 w组 4.02±0.912) 8.13±0.892)Hemin组 7.22±0.121)3) 5.53±0.52 ZnPP组 4.33±0.442)3) 7.51±0.492)3)
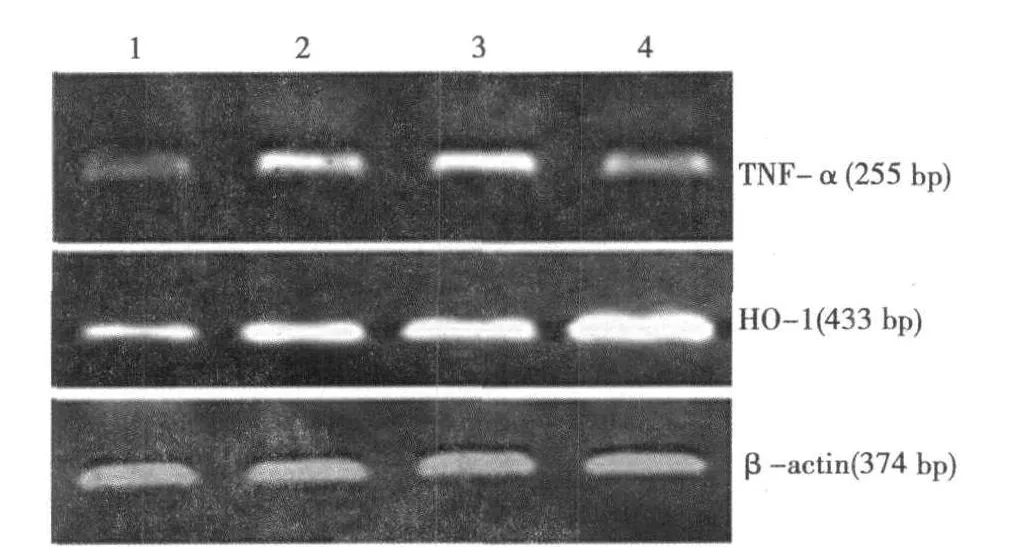
图1 各组 TNF-α及 HO-1m RNA的 RT-PCR扩增结果
2.2 UEA比较 与对照组相比,5、10、15 w DM大鼠 UEA均上升(P均 <0.01),并随病程延长而加重;Hemin组与 DM 5 w组相比已有下降趋势,但尚无统计学差异(P>0.05);ZnPP组大鼠 UEA明显增高,与对照组及DM 5 w组相比,均有显著差异(P<0.01)。
2.3 HO-1与 TNF-αmRNA在各组肾脏组织的表达 见图 1。对照组 HO-1/β-actin的 IOD比值为(46.52±11.56)%,病程5 w的DM大鼠 HO-1表达明显上调,IOD比值达到(67.10±12.18)%,两者相比有显著差异(P<0.01);Hemin组 HO-1表达量为(102.17±9.04)%较对照组和 DM组均升高(P<0.01)。ZnPP组 HO-1表达量为(62.96±15.11)%与 DM组无差异。与对照组 TNF-αIOD值(21.13±5.69)%相比较,DM组 TNF-α/β-actin的 IOD比值明显增高(49.42±4.17)%,Zn-PP组(55.71±12.83)%与 DM 5 w组 TNF-α表达无统计学差异,但是应用 Hemin后 DM大鼠肾脏组织 TNF-α表达减少〔(32.89±7.45)%,P<0.01〕。
3 讨 论
本实验成功复制了DM大鼠模型,在病程早期大鼠就表现了典型的“三多一少”症状,即多饮、多尿、多食和体重减少;5 w DM大鼠 UEA明显高于对照组,形成肾脏损伤,并随病程时间的延长,UEA升高程度增加,表明DN损伤加重。
HO-1可被多种氧化应激因素所诱生(如内毒素、高氧、低氧、紫外线、重金属和血红素等)〔1~3〕,是目前所知最易受诱导的酶之一,所以有研究者认为 HO-1可能是机体的一种自身保护性蛋白,是组织细胞对抗氧化应激的重要组成部分。近来有关 HO-1与 DM及其并发症的研究备受重视,并已取得一些成果。Hayashi等〔4〕已证实 DM大鼠肾小球上皮细胞、系膜细胞和毛细血管内腔 HO-1mRNA和蛋白表达增高,应用维生素 E或丙丁酚进行治疗的 DM大鼠的 HO-1表达和正常无异,活性氧的含量变化与 HO-1的变化一致,提示HO-1对抗DM肾病的氧化损伤。我们正是基于以上的研究成果,将 HO-1与 DN的研究继续深入。
本实验在 DM大鼠病程的中晚期观察到血清 MDA含量明显增加,这是体内氧化应激反应造成脂质过氧化的证据,同时在病程早期即发现了血清TAOC下降,说明机体抗氧化系统功能也已受损,以上结果强烈提示抗氧化治疗的必要性,且应用Hemin后可增加 DM大鼠的 TAOC,降低 MDA水平;UEA有下降趋势,虽没有统计学意义,但 UEA是判断 DN的敏感指标,UEA的变化说明肾脏损伤有缓解。因观察时间有限,有可能随着时间的延长会有统计学结果的显示。而在连续给予HO-1抑制剂 ZnPP后 TAOC下降,MDA含量和 UEA在 DM早期就增高,同样提示抑制HO-1可以损害机体的抗氧化系统,加重肾脏病变和功能紊乱。TNF-α是一重要的前炎性因子,本实验中观察到应用 Hemin可以降低TNF-α的表达水平,但这种作用是继发于 HO-1对氧化应激的削弱还是对 TNF-α的直接作用仍有待进一步的研究。我们推测Hemin预处理可以使HO-1表达显著增强,延缓DN的进程。结合Hemin对肾脏功能的保护,抗氧化途径应是 HO-1对抗DN功能障碍的机制之一。
本部分实验仅观察到改变HO-1水平对DM大鼠机体氧化应激状态及肾功能的影响,但缺乏直接的证据证实这种保护作用是由 HO-1分解血红素后何种代谢产物介导的或是各种产物的综合作用,深入研究各产物对 DM病变发生、发展的作用将是今后研究的方向。
1 徐金金,王 龙.异丙酚对大鼠心肌细胞氧化损伤时血红素加氧酶-1表达的影响〔J〕.华中科技大学学报,2009;38(6):760-3.
2 Carraway,MS,Ghio AJ,Carter JD,et al.Expression of heme oxygenase-1 in the lung in chronic hypoxia〔J〕.Am J Physiol Lung Cell Mol Physiol,2000;278(4):L806-12.
3 Lee,PJ,Alam J,Wiegand GW,et al.Overexpression of heme oxygenase-1 expression in human pulmonary epithelial cells results in cell growth arrest and increased resistance to hyperoxia〔J〕.Proc Natl Acad Sci USA,1996;93(19):10393-8.
4 Hayashi K,Haneda M,Koya D,et al.Enhancement of glomerular heme oxygenase-1 expression in diabetic rats〔J〕.Diabetes Res Clin Pract,2001;52(2):85-96.

