大豆寡糖体外发酵特性研究
周笑犁,印遇龙,3,阮 征,*
大豆寡糖体外发酵特性研究
周笑犁1,2,印遇龙1,2,3,阮 征1,2,*
(1. 南昌大学 食品科学与技术国家重点实验室,江西 南昌 330047;2. 南昌大学生命科学与食品工程学院, 江西 南昌330031;3. 中国科学院亚热带农业生态研究所, 湖南 长沙 410125)
采用体外发酵技术评价大豆寡糖对猪肠道食糜体外发酵特性和发酵产物的影响,探讨其作为功能食品或饲料添加剂的作用机制。选用正常的环江香猪,处死后无菌取空肠、回肠、盲肠和结肠食糜作为接种物,分别以5种质量浓度的大豆寡糖(50、100、200、500、800mg/L)和葡萄糖为底物进行体外发酵。记录产气量,48h后检测发酵液pH值、NH3-N、乙酸、丙酸和丁酸的含量。结果表明:接种回肠食糜的大豆寡糖组最大理论产气量和产气速率显著高于培养液对照组(P<0.05),显著低于葡萄糖组(P<0.05)。接种结肠和盲肠食糜的寡糖组和葡萄糖组的体外发酵延滞产气时间显著低于对照组,200mg/L大豆寡糖的发酵动力学参数最优;200mg/L寡糖组发酵液pH值和NH3-N含量显著低于培养液对照组(P<0.05);接种各肠段食糜的寡糖组和葡萄糖组发酵产丙酸和丁酸等短链脂肪酸含量均显著高于对照组(P<0.05),200mg/L大豆寡糖接种结肠食糜产丁酸含量最高。食品中添加大豆寡糖有利于被肠道微生物利用产生SCFA。
大豆寡糖;发酵特性;短链脂肪酸
抗生素的使用为提高动物生产水平、改善人类膳食结构做出了重大贡献,但是抗生素长期使用带来肉奶制品安全与生态环境等问题。为了研究和开发抗生素的替代品,人们发现一些寡糖能选择性地刺激肠道有益菌的生长繁殖而不能被大部分有害菌利用。近年来,国内外研究表明寡糖具有类似抗生素的作用,可取代抗生素而添加于动物饲料中。大豆寡糖(s o y b e a n oligosaccharides,SBOS)是大豆中或其他豆科作物种子中所含有的可溶性糖类的总称,它是α-半乳糖苷类,主要由水苏糖、棉子糖和蔗糖组成。一种低甜度、低热量的甜味剂,能替代蔗糖应用在功能性食品或低能量食品中。具有改善肠道菌群平衡,防治便秘;抑制肠道有害物质的产生;降低血清胆固醇和血脂的浓度;增强机体免疫能力,抑制肿瘤细胞生长;促进肠道内营养物质的生成与吸收和保护肝脏的作用等[1-5]。大豆寡糖在大肠中发酵或部分发酵,产生短链脂肪酸(short chain fat acids,SCFA),包括甲酸、乙酸、丙酸、丁酸、乳酸和一些相应的支链脂肪酸,其中乙酸、丙酸及丁酸占80%以上[6-7]。SCFA对肠道健康具有重要意义,表现为:可以促进结肠细胞的代谢、生长、分化;为肠黏膜上皮细胞及肌肉、肾、心、脑提供能量,影响肝脂质与碳水化合物的调控等;可降低大肠中的p H值,抑制致病菌的生长、繁殖,减少结肠癌发病率[8]。本实验利用体外发酵模型研究不同含量的大豆寡糖对生长仔猪各肠段微生物发酵功能的影响,以期筛选出适宜的添加量,并为大豆寡糖在食品或动物添加剂中进一步应用提供参考。
1 材料与方法
1.1 添加剂
大豆寡糖( SBOS,含量大于85%)购自南通四海植物精华有限公司。
1.2 培养液配制
参考Barry等[9]的方法,微量培养液(g/L):NaHCO3(9.240)、Na2HPO3·12H2O(7.125)、NaC1(0.470)、KC1 (0.450)、Na2SO4(0.100)、CaC12(0.055)、MgC12(0.047)、尿素(0.400),加蒸馏水定容至1000mL,混匀。 痕量缓冲液(mg/L):FeSO4·7H2O 3680、MnSO4·7H2O 1900、ZnSO4·7H2O 440、CoC12·6H2O 120、CuSO4·5H2O 98、Mo7(NH4)6O2·4H2O 17.4,加蒸馏水定容至1000mL,混匀。使用前在1L微量培养液中加入10mL痕量缓液,混匀备用。
1.3 体外发酵实验
1.3.1 体外实验设计
采用体外法进行,第一批为寡糖梯度:大豆寡糖添加水平设6个,分别为0(对照组)、50、100、200、500、800mg/L和200mg/L葡萄糖组,每个处理4个重复,接种物为回肠食糜。确定最适寡糖质量浓度后,接种物再选用不同肠段食糜,分别为空肠、回肠、结肠和盲肠,每个处理3个重复。
1.3.2 批次培养操作
选用2只体质量为25kg 左右的香猪,放血处死后,采集各肠段内容物,立即放入事先充有CO2的无菌保温瓶内,混匀。稀释食糜前,37℃水浴条件下向培养液中连续冲入CO230min,将pH值调整至6.9~7.0。将采集的肠道食糜与培养液混匀(1:10,m/V),分装在用于发酵实验的100mL注射器内,并在每10mL混合液中加入待测样品或200mg葡萄糖。样品处理不得超过30min,最后将注射器放到摇床上37℃,水浴振荡培养48h[10-12]。
1.4 测定指标与方法
1.4.1 发酵动力学参数
记录接种后0.5、1、2、4、6、8、10、12、14、16、18、20、22、24、30、36h和48h时的产气量。根据产气量统计达到最大产气速率的时间(h)、最大产气速率(mL/h)和最大产气量(mL/g,以干基计)。采用Schofield等[13]提出的方程描述产气动力学特性。
GP = A exp {-exp [1 + b e / A ( Lag -t)]}
式中:GP表示t时刻累积产气量/mL;A表示最大理论产气量/mL;b表示产气速率/(mL/h),Lag表示体外发酵产气延滞时间/h;t表示发酵时间点,e为自然对数函数的底数,约为2.71828。
通过Nlreg软件确定A、b、Lag 3个发酵参数,其中A和b值越大、Lag越小,表示该发酵底物具有良好的发酵特性,是一种理想的碳源。
1.4.2 发酵终产物测定
发酵结束时,将发酵液1000r/min离心10min得上清液,立即置于冰上用Delta 320型pH计(Mettler公司)测定发酵上清液的pH值。用UV-160A紫外分光光度计(日本岛津)在550nm波长处测定上清液中NH3-N的含量[14-15]。将发酵液按体积比4:1在上清液中加入25%偏磷酸溶液,用HP 5890 Series Ⅱ型气相色谱仪测定乙酸、丙酸和丁酸的含量[11]。
1.5 数据统计与分析
2 结果与分析
2.1 发酵动力学参数

表1 接种回肠食糜不同质量浓度大豆寡糖的发酵动力学参数(n=4)Table 1 Fermentation kinetic parameters in the ileum group supplemented with SBOS at various concentrations (n=4)
由表1可见,不同质量浓度大豆寡糖的最大理论产气量均显著低于葡萄糖组(P<0.05),显著高于培养液对照组; 50mg/L大豆寡糖最大理论产气量最小,其他组间差异不显著。各质量浓度大豆寡糖的产气速率均显著低于葡萄糖组(P<0.05),显著高于培养液对照组,其中以质量浓度为200mg/L时最高;不同质量浓度的发酵延滞时间与培养液组相比也有显著差异(P<0.05),质量浓度为100mg/L时较长。通过不同质量浓度大豆寡糖发酵动力学参数,200mg/L时最大理论产气量和产气速率较大,而发酵延滞时间较小,该质量浓度的大豆寡糖具有良好的发酵特性,是一种理想的碳源。
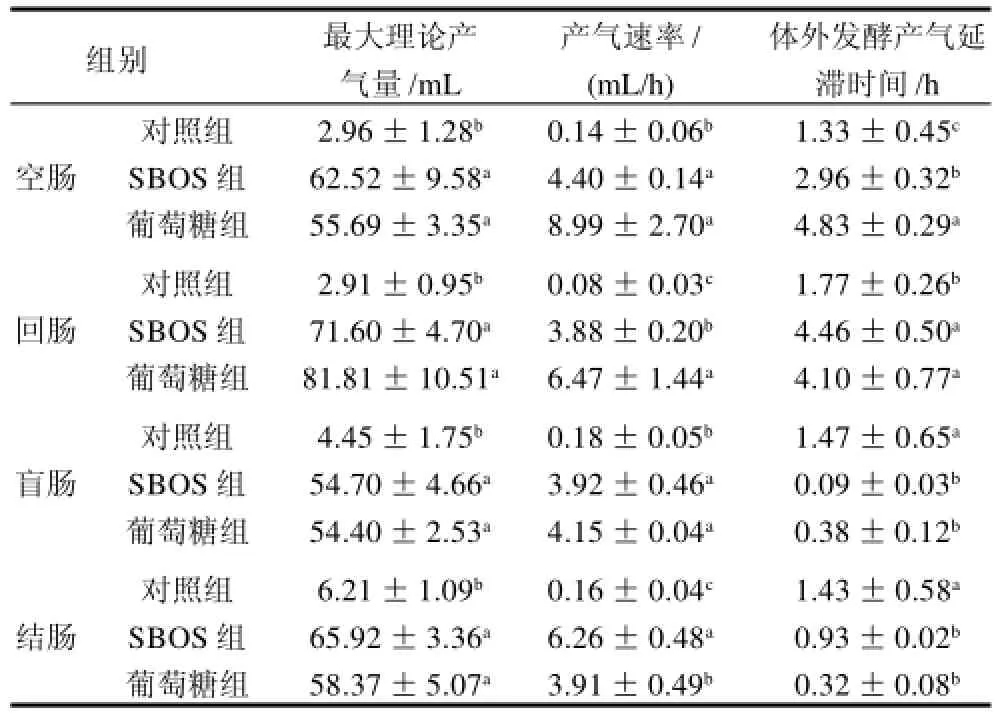
表2 大豆寡糖对不同肠段的发酵动力学参数(n=3)Table 2 Fermentation kinetic parameters in various parts of intestinal supplemented with SBOS (n=3)
由表2可见,不同肠段大豆寡糖的最大理论产气量与葡萄糖组无显著差异,显著高于培养液对照组(P<0.05)。各肠段寡糖组的产气速率显著高于培养液组;在空肠和盲肠中大豆寡糖的产气速率与葡萄糖组无显著差异,回肠中大豆寡糖组的产气速率显著低于葡萄糖组,结肠中寡糖组产气速率的显著高于葡萄糖组(P<0.05)。空肠、回肠中大豆寡糖组和葡萄糖组的发酵延滞时间显著高于培养液对照组,而在盲肠和结肠则显著低于培养液对照组,对微生物来讲表示理想碳源。大豆寡糖组在空肠的发酵延滞时间显著低于葡萄糖组,在其他各肠段两组无显著差异。
2.2 发酵液的pH值和NH3-N含量

表3 接种回肠食糜不同质量浓度大豆寡糖发酵液的pH值和NH3-N含量(n=4)Table 3 pH and NH3-N content in fermentation broth of ileum group supplemented with SBOS at various concentrations (n=4)
由表3可见,不同质量浓度大豆寡糖发酵后,其发酵液的pH值和NH3-N含量存在一定的差异,与培养液对照组的pH值相比,寡糖组和葡萄糖组的显著降低(P<0.05),寡糖组随着质量浓度的增加,pH值呈逐渐下降趋势,200mg/L SBOS的pH值显著低于50mg/L和100mg/L SBOS的pH值,显著高于500mg/L、800mg/L SBOS和葡萄糖组的pH值。随着SBOS质量浓度的增加,其N H3-N含量先呈下降趋势然后升高,200mg/L SBOS的NH3-N含量相对其他质量浓度的大豆寡糖较低,葡萄糖组的pH值与NH3-N含量均最低。揭示大豆寡糖有最适摄入量,过高的质量浓度产生较高的NH3-N。

表4 大豆寡糖对不同肠段发酵液的pH值和NH3-N含量(n=3)Table 4 pH and NH3-N content in fermentation broth of various parts of intestinal supplemented with SBOS (n=3)
由表4可见,大豆寡糖在不同肠段发酵后,其发酵液的pH值和NH3-N含量存在一定的差异,各肠段寡糖组和葡萄糖组的pH值显著低于培养液对照组(P<0.05),不同肠段的SBOS组和葡萄糖组pH值没有显著差异;各肠段寡糖组和葡萄糖组的NH3-N含量显著低于培养液对照组(P<0.05),空肠、回肠的葡萄糖组NH3-N含量显著低于SBOS组(P<0.05),结肠和盲肠的SBOS组和葡萄糖组NH3-N含量差异不显著。
2.3 发酵液中SCFA含量

表5 不同质量浓度大豆寡糖对回肠发酵液短链脂肪酸含量及比例(n=4)Table 5 Content and proportion of short-chain fatty acids infermentation broth of ileum group supplemented with SBOS at various concentrations (n=4)
由表5可见,SBOS组和葡萄糖组乙酸、丙酸和丁酸含量均高于培养液对照组,乙酸含量随着SBOS质量浓度的增加呈先减少再增加的趋势,当200mg/LSBOS达到最小时和葡萄糖组的乙酸含量没有显著差异;丙酸、丁酸随着SBOS质量浓度的增加呈先增加再减少的趋势,当SBOS在200mg/L时,乙酸含量最低,丁酸含量最高。各处理中乙酸和丙酸所占比例均较高,丁酸含量则较低。

表6 大豆寡糖对不同肠段发酵液短链脂肪酸含量及比例(n=3)Table 6 Content and proportion of short-chain fat acids in fermentation broth from different parts of intestinal supplemented with SBOS (n=3)
由表6可见,大豆寡糖与在不同肠段食糜混合发酵后,其发酵液的SCFA含量存在一定的差异。回肠中各组乙酸含量差异不显著外,其余各肠段SBOS组和葡萄糖组SCFA含量都显著高于培养液对照组(P<0.05)。不同肠段SBOS组和葡萄糖组乙酸含量没有显著差异。空肠组和回肠肠段SBOS组丁酸含量与葡萄糖组有显著差异,而在盲肠和结肠差异不显著;在结肠SBOS组产生的丁酸量最高。
3 讨 论
本实验结果表明:在体外条件下,适宜质量浓度的SBOS降低了培养液中pH值和NH3-N含量,增加了培养液中的SCFA,尤其是增加了丙酸和丁酸的含量。
由于动物实验费时、费力且成本较高,用食糜为接种物进行体外发酵是预测发酵底物营养价值的一种简捷、经济的方法[16]。一般认为,发酵过程中产气量的多少、各种气体的比例及产气速率与底物的化学结构和微生物种类存在一定的关系[17]。当以猪各肠段食糜为接种物进行发酵时各质量浓度寡糖组的最大理论产气量均显著高于培养液对照组,却显著低于葡萄糖组,说明猪肠道微生物可以利用SBOS进行发酵,但产酸和产气的多少因底物及其浓度不同而异。各处理前24h产气量占总产气量的90%左右,随着寡糖含量的提高,产气量和发酵动力学参数先逐步提高再减少,在200mg/L时达到最大;而对照组24h后才发酵,由此可见,寡糖组和葡萄糖组产气量主要来自于碳水化合物,200mg/L大豆寡糖发酵参数最优,说明该质量浓度寡糖是一种良好的碳源。
功能性寡糖能选择性地刺激肠道有益菌的生长繁殖,特别是被盲肠和结肠微生物代谢利用,而不能被大部分有害菌利用,经发酵或部分发酵后产生SCFA,包括甲酸、乙酸、丙酸、丁酸、乳酸、延胡索酸和一些相应的支链脂肪酸,以乙酸、丙酸及丁酸为主[7,18-19]。
SCFA中乙酸是胆固醇合成的最主要的底物,在机体内,大部分乙酸经门静脉进入肝脏的代谢[20];乙酸可以被许多组织摄取和利用,是机体从小肠不能消化吸收的碳水化合物中得到能量的主要途径[8]。丙酸经结肠吸收以后由肝脏代谢作为能源,并可以抑制肝胆固醇和脂肪的合成,提高高密度脂蛋白胆固醇和甘油三脂[21]。丁酸被认为是结肠细胞所需的最重要的能量来源,有助于结肠细胞的分化及增殖等[21-23]。不同的代谢底物和质量浓度决定了微生物区系的细菌种类和肠道SCFA的数量与种类[24]。从不同质量浓度的SBOS对回肠食糜体外发酵实验可知,较高质量浓度的寡糖可能不能被肠道微生物充分降解利用或者改变了肠道微生物区系,导致SCFA含量下降。在接种物为猪各肠段食糜、底物为大豆寡糖的实验中,结果表明了在发酵液中乙酸的含量较大,但添加SBOS后,在肠道中分解主要产生的是丙酸和丁酸,因此可以有效阻断肝脏胆固醇和脂肪合成,降低血清脂质水平。而且结肠比回肠产生的SCFA要多,这可能与结肠微生物数量多,导致结肠比回肠的发酵更彻底。丁酸含量在寡糖质量浓度200mg/L时最高,并在结肠中含量也最高,说明不同接种物和底物对体外发酵的影响是相当明显的。一般认为SCFA产量提高和NH3-N含量降低对动物健康有利,同时发酵产生的酸性物质可降低肠道pH值。本研究结果表明,SBOS发酵后SCFA产量增加,pH值和NH3-N含量降低,这与发酵特性一致。综上所述,碳源不同的发酵底物影响SCFA类型和数量,且由于不同的SCFA有各自特定的生理作用,可能会导致不同的代谢结果。200mg/L大豆寡糖有很好的发酵效果,其发酵参数、SCFA产量、降低pH值和NH3-N含量均显著优于其他各寡糖质量浓度。
[1]刁小琴, 关海宁. 大豆低聚糖的开发与应用前景[J]. 中国食物与营养, 2008(11): 16-18.
[2]CHEN Hua, LIU Lijun, ZHU Jianjun, et al. Effect of soybean oligosaccharides on blood lipid, glucose levels and antioxidant enzymes activity in high fat rats[J]. Food Chemistry, 2010, 119(4): 1633-1636.
[3]杨继远, 袁仲. 大豆低聚糖保健功能及其在食品工业中的应用[J]. 食品工业科技, 2008, 29(10): 291-293.
[4]DENG Junming, MAI Kangsen, AI Qinghui, et al. Effects of soybean oligosaccharides on lipid metabolism of Japanese flounder (Paralichthys olivaceus Temminck et Schlegel) fed animal or plant protein sourcebased diets[J]. Frontiers of Agriculture in China, 2007, 1(3): 315-323.
[5]程云辉, 贾振宝. 大豆低聚糖的研究进展[J]. 食品与机械, 2004(6): 57-60.
[6]林杨, 赵新淮. 抗性淀粉体外产酸发酵研究[J]. 食品与发酵工业, 2008, 34(11): 44-47.
[7]KIHARA M, SAKATA T. Production of short-chain fatty acids and gas from various oligosaccharides by gut microbes of carp (Cyprinus carpio L.) in micro-scale batch culture[J]. Comparative Biochemistry and Physiology part A, 2002,132: 333-340.
[8]詹彦, 支兴刚. 短链脂肪酸的再认识[J]. 实用临床医学, 2007, 8(1): 134-138.
[9]BARRY J L, HOEBLER C, MACFARLANE G T, et al. Estimation of the fermentability of dietary fibre in vitro: a European interlaboratory study[J]. British J Nutri, 2007, 74(3): 303-322.
[10]MALGORZATA W, MAFIA S, URSZULA K, et a1. in vitro Fermentation of new modified starch preparations-changes of mierostructure and bacterial end-products[J]. Enzyme and Microbial Tech, 2005, 40: 93-99.
[11]汤少勋, 黄瑞林, 谭支良, 等. 不同品种燕麦秸秆体外发酵产气特性的研究[J]. 广西农业生物科学, 2006, 25 (4): 330-335.
[12]李万坤, 郭福存, 赵兴绪, 等. 多糖和寡糖的体外发酵特性及其对鸡盲肠微生物菌群的影响[J]. 动物营养学报, 2007, 19(3): 277-282.
[13]SCHOFIEL D P, PITT R E, PELL A N. Kinetics of fiber digestion from in vitro gas production[J]. J Anim Sci, 1994, 72: 2980-2991.
[14]BRODERICK G A, KANG J H. Automated simultaneous determination of ammonia and total amino acids in ruminal fluid and in vitro media[J]. J Dairy Sci, 1980, 63(1): 64-75.
[15]俞晓辉, 王潇, 姚文, 等. 饲喂发酵豆粕仔猪粪样对仔猪日粮体外发酵的影响[J]. 畜牧与兽医, 2008, 40(2): 8-11.
[16]MAURICIO R M, MOULD F L, DHANOA M S, et al. A semi-automated in vitro gas production technique for ruminant feedstuff evaluation [J]. Anim Feed Sci & Technol, 1999, 79(4): 321-330.
[17]JENSEN B B, JORGENSEN H. Effect of dietary fiber on microbial activity and microbial gas production in various regions of the gastrointestinal tract of pigs[J]. Applied & Environmental Microbio, 1994, 60(6): 1897-1904.
[18]WISKER E, KNUDSEN K E B, DANIEL M, et a1. Energy values of non-starch polysaccharides: comparative studies in humans and rats[J]. J Nutri, 1996, 127: 108-116.
[19]CUMMINGS J H, ROMBEAN J L, SAKATA T. Physiological and clinical aspects of short chain fatty acids[J]. Cambridge: Cam bridge University Press, 1995, 38: 156-157.
[20]LUPTON J R, KURTZ P P. Relationship of colonic luminal shortchain fatty acids and pH to in vivo cell proliferation in rats[J]. J Nutri, 1993, 123: 1522-1530.
[21]BOILA R J, SALOMON M D, MILLIGAN L P, et a1. The effect of dietary propionic acid on cholesterol synthesis in swine[J]. Nutr Reports Inter, 1981, 23: 1113-1121.
[22]PRASAD K N. Butyric acid: a small fatty acid with diverse biological functions[J]. Life Sci, 1980, 27: 1351-1358.
[23]DAVID J M, JUDITH A M. Rat cecal inocula produce different patterns of short-chain fatty acids than fecal inocula in in vitro fermentations[J]. J Nutr, 1995, 125: 2463-2470.
[24]LAN Y, WILLIAMS B A, VERSTEGEN M W A, et al. Soy oligosaccharides in vitro fermentation characteristics and its effect on caecal microorganisms of young broiler chickens[J]. Animal Feed Science and Technology, 2007, 133: 286-297.
Fermentation Characteristics of Soybean Oligosaccharides in vitro
ZHOU Xiao-li1,2,YIN Yu-long1,2,3,RUAN Zheng1,2,*
(1. State Key Laboratory of Food Science and Technology, Nanchang University, Nanchang 330047, China;2. College of Life Science and Food Engineering, Nanchang University, Nanchang 330031,China;3. Institute of Subtropical Agriculture, Chinese Academy of Sciences, Changsha 410125, China)
in vitro fermentation technology was used to evaluate the effects of soybean oligosaccharides (SBOS) on fermentation kinetic parameters and fermentation products, which also used to explore its action mechanisms as food or feed additives. Sterile jejunum, ileum, cecum or colon chyme as the inoculum were collected from Huanjiang normal pigs to conduct in vitro fermentation using SBOS at the concentrations of 50, 100, 200, 500 mg/L and 800 mg/L, and glucose as the substrates. The gas production, pH, and the contents of NH3-N, acetic acid, propanoic acid and butyric acid in the fermentation broth were determined after 48 h fermentation in an anaerobic system. Results indicated that the maximum amount and rate of gas production in the fermentation broth of ileum group supplemented with SBOS were higher than those of the control group (P<0.05), while an obvious lag in gas-producing time was observed in fermentation broth of colon or cecal group supplemented with SBOS and glucose. Compared with the control group, the lower gas-producing amount and rate was observed in fermentation broth of colon or cecum group supplemented with SBOS and glucose (P<0.05). The fermentation kinetic parameters at the condition of 200 mg/L SBOS were the best. The pH and NH3-N content in fermentation broth of colon or cecum group supplemented with 200 mg/L SBOS were lower (P<0.05) when compared with the control group, but higher (P<0.05) when compared with the ileum group supplemented with glucose. The proportion of short chain fatty acids (SCFA) in the groups supplemented with SBOS and glucose was higher than that of the control group (P<0.05). The content of acetic acid was decreased due to the addition of SBOS, while the contents of propionate acid and butyrate acid exhibited a gradual increase. The maximum content of butyrate acid was observed in the fermentation broth of colon group supplemented with 200 mg/L SBOS. Therefore, SBOS is beneficial to gut health as functional food or feed additives to modulate SCFA production patterns in intestinal microflora. Its optimal level is 200 mg/L.
soybean oligosaccharides;fermentation characteristics;short chain fatty acids (SCFA)
TS218;R151.3
A
1002-6630(2011)03-0098-05
2010-05-05
南昌大学“赣江学者奖励计划”项目;中国博士后科学基金资助项目(20080440166;200902537)
周笑犁(1985—),女,硕士研究生,研究方向为碳水化合物营养调控。E-mail:lizi008009@126.com
*通信作者:阮征(1978—),男,副教授,博士,研究方向为碳水化合物及其营养调控。E-mail:ezruan@yahoo.com

