饲喂氧化鱼油对新生仔猪肠道黏膜免疫应答的影响及大豆异黄酮的干预作用
黄 琳 蒋宗勇 林映才 周桂莲 郑春田 陈 芳
氧化应激(oxidative stress)是人类和动物范围内极为广泛的综合病症的主要原因之一,这些综合病症包括肠炎、肠蠕动紊乱、各种急性炎症等。氧化应激过程中产生的大量活性氧和活性氮可通过细胞脂质过氧化、损伤 DNA分子、调节细胞凋亡相关基因等途径诱导细胞凋亡,引起组织损伤[1]。试验证明,氧化鱼油将会引起体内产生氧化应激[2-7],同时氧化应激可导致机体免疫功能下降[8],然而肠道氧化应激与免疫应答之间的相互关系尚未完全阐明。现有研究表明氧化应激产物活性氧簇(ROS)是炎症和免疫活化的重要信号分子[9],ROS可对肠道黏膜免疫系统造成损害。在氧化应激诱导的细胞损伤的通路中,NF-κB-iNOSNO通路是一条关键通路[10],搞清楚这条通路在肠道中是否存在,又是如何调控肠道中的细胞因子,这些问题正是本研究的目的所在。大豆异黄酮(soybean isoflavone,SI)是一类从大豆中提取的、具有多酚羟基结构的生物活性物质,具有抗氧化作用[11]。本研究在人工饲养条件下,通过添加外源性氧化鱼油以及 SI,研究氧化应激对新生仔猪生长性能、小肠黏膜中相关酶活性的影响,旨在探讨氧化应激对新生仔猪生长、小肠黏膜发育以及肠道免疫机制以及 SI对其的保护作用。
1 材料与方法
1.1 试验动物
本试验选用 4日龄体重为(1.9±0.1)kg的同性别杜 ×长 ×大三元杂交新生仔猪 96头(从母猪胎次一致、产期相同的 20窝中选取),按窝别和体重随机分成 4个组,每组 6个重复,每个重复4头。
1.2 试验材料
SI为广东省农业科学院畜牧研究所研制,含量为 98.5%。鱼油为精炼饲用鱼油,购于广州永兴浓缩饲料有限公司,购进时放入冷库中保存。
1.3 试验处理及氧化应激模型的建立
试验采用 2(新鲜和氧化鱼油)×2(未添加和添加 50 mg/kg SI)双因子随机区组设计。试验设计见表 1。
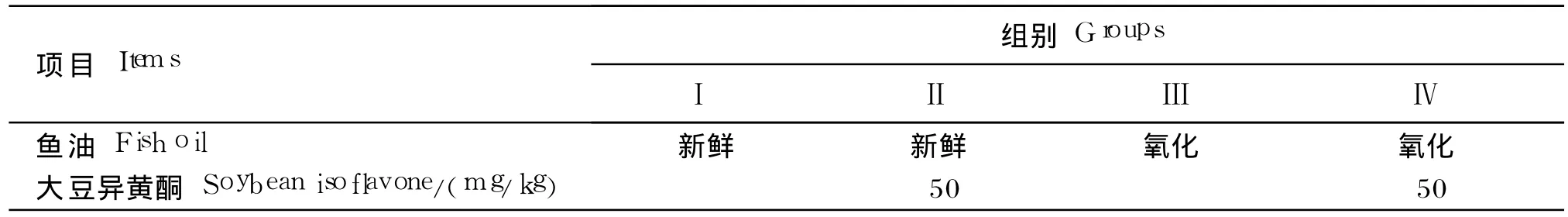
表1 试验设计Table 1 Experimental design
1.4 试验饲粮
试验基础饲粮根据 NRC(1998)中 3~5 kg仔猪的饲养标准配制,基础饲粮组成及营养水平见表 1,试验组中的氧化鱼油为人工自制。对照组(Ⅰ组 )、Ⅱ组、Ⅲ组添加 Fe2+、Cu2+与 Ⅳ组的Fe2+、Cu2+达到平衡。氧化鱼油的制作方法参考John等[2]并做一定的修改,按比例添加 30 mg/kg Fe2+(以 FeSO4◦7H2O形式添加)、15 mg/kg Cu2+(以 CuSO4◦ 5H2O形式添加)、600 mg/kg H2O2和 0.3%的水,充分混合后,(60±1)℃条件下搅拌氧化,同时不间断的通入一定流量的空气,分不同的时间段采样,测定鱼油中的过氧化物价(POV),即油脂氧化形成的过氧化产物氧化碘化钾成为游离碘的量。制取一定过氧化程度的氧化鱼油。氧化鱼油制好后放入 -20℃冷库中冻存待用。
1.5 饲养管理
仔猪 4日龄断奶时称个体重,分组。每个代谢笼中饲养 4头仔猪,通过用保温灯和保温垫控制各饲养笼温度在(30±1)℃。将饲粮干料与温开水以 1∶4兑成液态乳样,饲喂当天配制成新鲜液态饲料,装进特制料槽进行饲喂。每天按仔猪体重的 30%饲喂。每次饲喂后换上装有温开水的料槽供仔猪自由饮水,换下的料槽用温水清洗,饲喂时间为 07:30、10:00、12:30、15:00、15:30、22:00喂至仔猪 24日龄,试验期为 21 d。
1.6 样品采集和指标测定
试验仔猪于 14日龄时称重 1次,然后于 24日龄时晚上空腹 16 h后,于次日早上个体称重,计算各阶段及全期平均日增重;记录耗料量,计算各阶段及全期料重比。取每个重复中的 2头仔猪共 48头进行屠宰取样。
取十二指肠、空肠和回肠中上段约 10 cm,在4℃条件下用磷酸缓冲液(PBS)洗净肠道内容物,用滤纸轻轻吸干,用玻片小心刮取黏膜分装于 Eppendorf管内,-80℃保存备用。肠道黏膜总超氧化物歧化酶(T-SOD)、过氧化氢酶(CAT)、肌酸激酶(CK)活性、总抗氧化能力(T-AOC)、丙二醛(MDA)含量采用南京建成生物公司分析试剂盒用紫外可见分光光度计(BioMate 5,Thermo Scientific,USA)测定。肿瘤坏死因子 -α(TNF-α)、白细胞介素 -2(IL-2)、白细胞介素 -6(IL-6)、白细胞介素 -8(IL-8)、白细胞介素 -10(IL-10)、核因子 -κB(NF-κB)含量,诱导性一氧化氮合成酶(iNOS)、应激激活蛋白激酶(JNK)、激活蛋白 -1(AP-1)活性采用 ELISA测定,相应试剂盒购自美国 R&D公司。
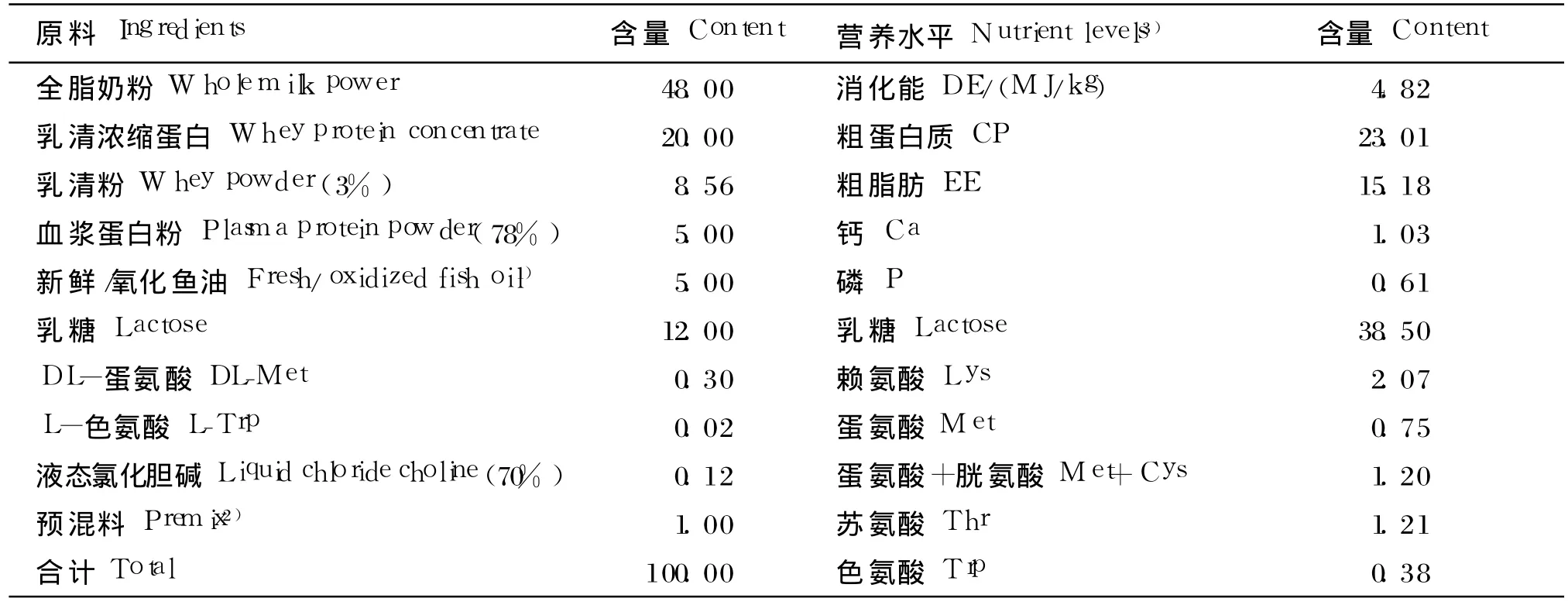
表2 基础饲粮组成及营养水平(风干基础)Table 2 Composition and nutrient levels of the basal diet(air-dry basis) %
1.7 数据统计分析
试验数据采用 SAS软件(v6.12,SAS Institute,USA)的 GLM程序进行方差分析并用 Duncan氏法进行多重比较。统计模型包括:氧化鱼油效应、SI效应以及二者的互作效应。统计显著性水平为 P<0.05,极显著性水平为 P<0.01。各组试验数据均以平均值 ±标准误表示。
2 结 果
2.1 新鲜鱼油和氧化鱼油饲粮中添加 SI对新生仔猪生产性能的影响
由表 3可知,鱼油氧化处理对试验 1~21 d仔猪平均日增重和 1~21 d料重比均产生显著影响(P<0.05),SI处理对试验 1~21 d仔猪料重比有影响的趋势(P=0.058)。
2.2 新鲜鱼油和氧化鱼油饲粮中添加 SI对新生仔猪肠道黏膜抗氧化能力的影响
由表 4可知,Ⅱ组和Ⅲ组肠道黏膜 T-AOC显著低于Ⅰ组和Ⅳ组(P<0.05)。鱼油氧化处理对CK活性略有提高(P=0.054)。SI处理显著提高SOD活性(P<0.05)。氧化鱼油和 SI对 T-AOC产生极显著互作效应(P<0.01)。
2.3 新鲜鱼油和氧化鱼油饲粮中添加 SI对新生仔猪空肠黏膜 MDA含量的影响
由表 5可知,新生仔猪饲粮鱼油氧化处理极显著提高了空肠黏膜 MDA含量(P<0.01)。Ⅲ组仔猪肠道黏膜 MDA含量比Ⅰ组和Ⅱ组分别提高了 90.89%(P<0.05)和 73.28%(P<0.05)。
2.4 新鲜鱼油和氧化鱼油饲粮中添加 SI对新生仔猪肠道黏膜免疫因子的影响
由表 6可以得出,Ⅳ组肠道黏膜 IL-10含量极显著低于Ⅲ组(P<0.01);Ⅲ组和Ⅳ组肠道黏膜IL-10含量极显著低于Ⅰ组和Ⅱ组(P<0.01)。鱼油氧化处理极显著提高新生仔猪肠道黏膜 IL-2含量(P<0.01),极显著降低 IL-10含量 (P<0.01),显著降低肠道 IL-8含量(P<0.05)。SI处理极显著提高了肠道黏膜 IL-10的含量(P<0.01)。氧化鱼油和 SI对 IL-10含量产生极显著互作效应(P<0.01)。
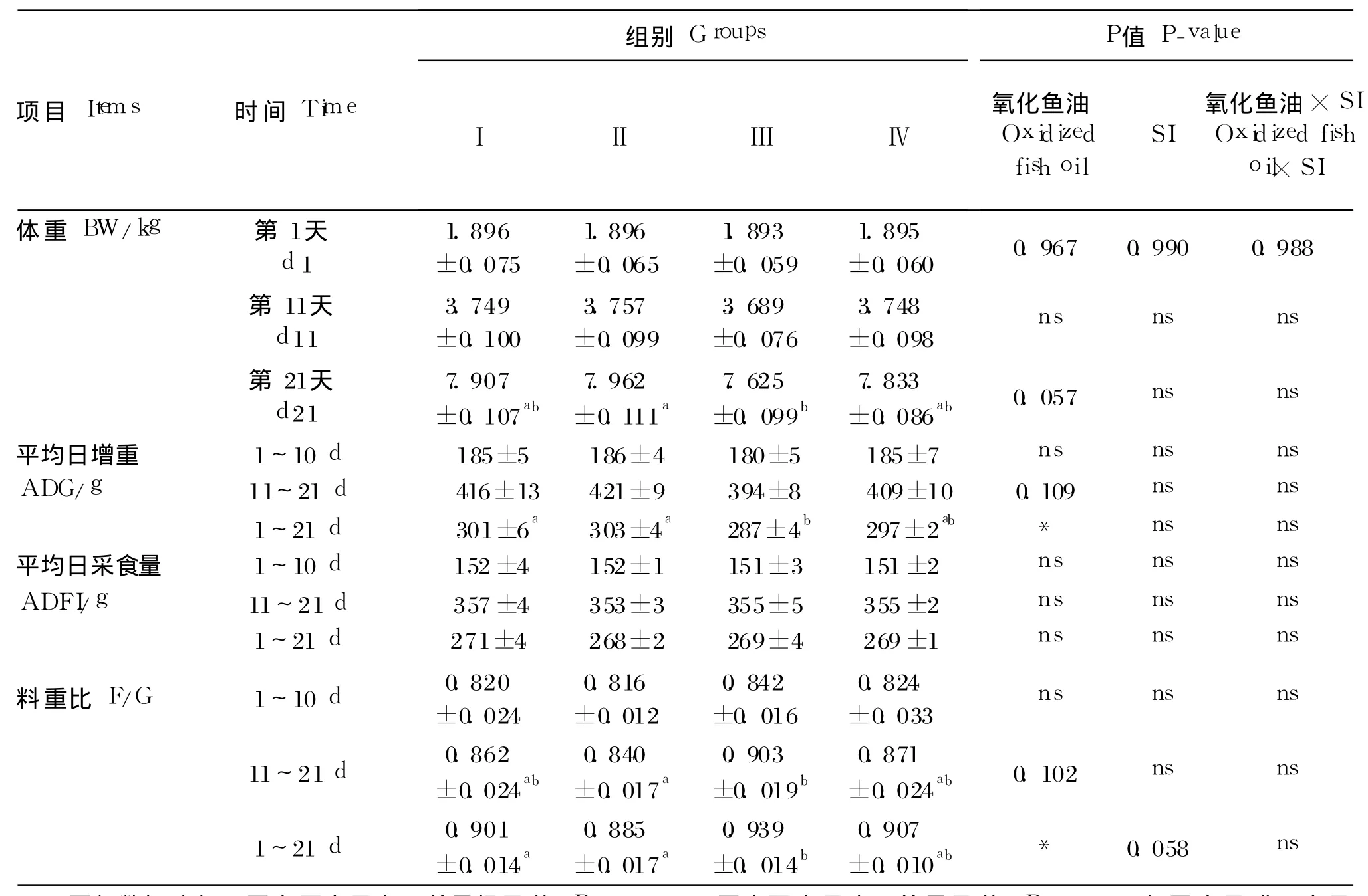
表3 新鲜鱼油和氧化鱼油饲粮中添加 SI对新生仔猪生产性能的影响Table 3 Effects of SI supplementation on the performance of neonatal piglets fed fresh and oxidized fish oil diets
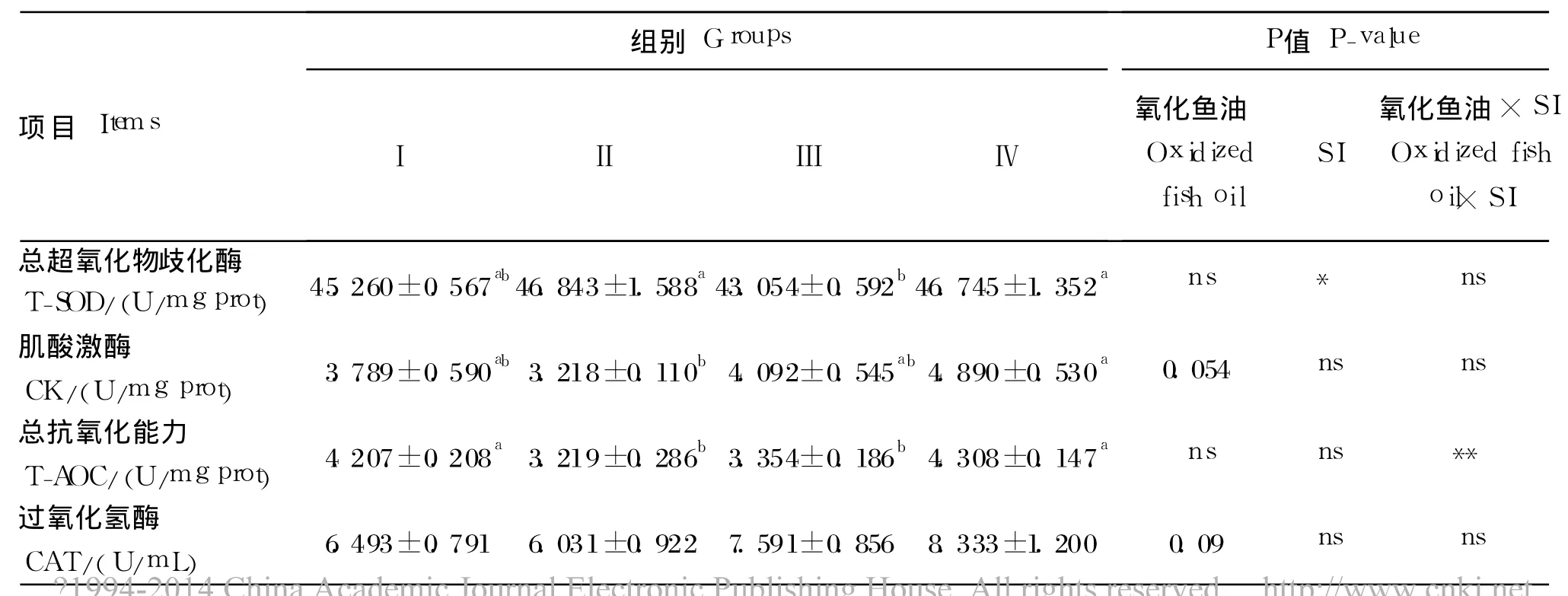
表4 新鲜鱼油和氧化鱼油饲粮中添加 SI对新生仔猪空肠黏膜抗氧化能力的影响Table 4 Effects of SI supplementation on the ability of antioxidation in jejunum mucosa of neonatal piglets fed fresh and oxidized fish oil diets

表5 新鲜鱼油和氧化鱼油饲粮中添加 SI对新生仔猪空肠黏膜 MDA含量的影响Table 5 Effects of SI supplementation on the content of MDA in jejunum mucosa of neonatal piglets fed oxidized and fresh fish oil diets

表6 新鲜鱼油和氧化鱼油饲粮中添加SI对新生仔猪空肠黏膜细胞免疫因子的影响Table 6 Effects of SI supplementation on the cell-mediated immunologic factors of jejunum mucosa in neonatal piglets fed fresh and oxidized fish oil diets
2.5 新鲜鱼油和氧化鱼油饲粮中添加 SI对新生仔猪肠道黏膜免疫和氧化相关因子的影响
由表 7可以得出,Ⅲ组对新生仔猪肠道黏膜NF-κB含量的影响极显著高于Ⅰ组(P<0.01),显著高于Ⅳ组(P<0.05)。鱼油氧化处理显著提高了肠道黏膜 iNOS活性(P<0.05),对 NF-κB含量略有升高(P=0.08)。氧化鱼油和 SI对肠道黏膜NF-κB含量产生显著互作效应(P<0.01),对 AP-1含量略有互作效应(P=0.098)。
3 讨 论
研究表明给试验动物饲喂氧化鱼油可使动物机体 ROS大量产生,MDA含量增加,体内 T-SOD降低,诱导氧化应激[2-7]。本试验给新生仔猪饲粮中添加氧化鱼油,建立新生仔猪肠道氧化应激模型,从试验结果中得出,饲粮中添加氧化鱼油对新生仔猪肠道 T-SOD、CK活性、T-AOC以及 MDA含量有显著变化,这说明本试验添加氧化鱼油组成功建立了新生仔猪肠道氧化应激模型。SI可抑制自由基的产生和清除自由基,可诱导增强内源抗氧化酶活性,如超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-Px)、CAT等,可增加金属硫蛋白 (MT)的合成。SI的抗氧化作用已引起了国内外学者的广泛关注[12-17]。本试验结果表明,给人工饲养的 4日龄断奶仔猪代乳料中添加氧化鱼油后,饲喂 SI表现出不同的生长速度,在氧化应激情况下,饲粮添加 SI仔猪料重比和无应激下饲喂基础饲粮仔猪的料重比相比较,饲粮添加 SI有补偿仔猪饲喂氧化鱼油后引起的生长不良反应。

表7 新鲜鱼油和氧化鱼油饲粮中添加SI对新生仔猪肠道氧化相关因子和黏膜免疫的影响Table 7 Effects of SI supplementation on the Co-oxidation and immune-related factors of jejunum mucosa in neonatal piglets fed oxidized and fresh fish oil diets
IL-10具有抗炎和抑制多种细胞因子合成的作用,主要抑制 Th1细胞的激活和细胞因子的产生,其生物学功能主要是抑制和终止炎症反应,并且IL-10具有很强的抑制巨噬细胞活性的作用[18],有研究表明长期的高脂膳食可导致机体形成亚临床状态的炎症状态,这种低度的炎性状态与代谢综合症有密切的关系[19]。Deng等[8]的研究表明,对断奶仔猪用注射敌草快诱导氧化应激模型后,仔猪血液中白细胞介素 -1(IL-1)和干扰素 -γ(IFN-γ)增加,说明机体免疫功能发生改变。在本实验中,饲喂氧化鱼油组仔猪肠道黏膜中 IL-2水平显著增高,IL-8和 IL-10下降,证明了氧化鱼油诱导的肠道氧化应激导致了炎症反应,使动物的免疫机制发生改变。
NF-κB是由 NF-κB/Rel蛋白家族的 2个亚基组成的二聚体蛋白质,几乎存在于所有细胞中在正常情况下,细胞内的核转录因子 κB结合成复合物,当细胞受到自由基作用,在氧化应激状态下,NF-κB从复合体中解离并向核内移动,与位于核内的基因序列上特异性调控区结合,从而激活受调控的基因表达[20]。因此,测定 NF-κB在细胞中的变化,可反映出细胞在自由基作用的程度。本研究中,与炎症反应相关的 2个基因表达水平升高,其中 NF-κB表达水平显著上调,说明氧化鱼油诱导的肠道氧化应激可使机体生成过多的 ROS,ROS可通过激活氧化还原状态敏感的转录因子 NF-κB来促进前炎性细胞因子的表达,加剧炎症反应。本试验研究结果表明,SI可下调 NF-κB的表达水平,说明 SI能通过清除过多的自由基来恢复机体氧化还原状态。从本试验的研究中还可以得出肠道氧化应激诱导细胞损伤通路是通过 NF-κB-iNOS-NO进行的。
4 结 论
给新生仔猪饲喂氧化鱼油饲粮造成了仔猪肠道氧化应激,诱发了肠道炎症反应,添加 SI能在一定程度上改善饲喂氧化鱼油诱导的氧化应激状态,从而缓解炎症的发生,增强机体的抗氧化能力。
[1] 陈群,乐国伟,施用晖,等.氧自由基对动物消化道损伤及干预研究进展[J].中国畜牧兽医,2006,33(11):106-108.
[2] JOHN S A,WENDELL H G,JAMES F M,et al.Toxicity of air-oxidized soybean oil[J].The Journal of Nutrition,1959,70(2):199-210.
[3] LIU J F,LEE Y W.Vitamin C supplementation restores the impaired vitamin E status of guinea pigs fed oxidized frying oil[J].The Journal of Nutrition,1998,128(1):116-122.
[4] KLAUSE,GABRIELE I.Plasma thyroxine and cholesterol concentrations of miniature pigs are influenced by thermally oxidized dietary lipids[J].The Journal of Nutrition,2000,130:116-121.
[5] VÁZQUEZAÑÓNM,JENKINS T.Effects of feeding oxidized fat with or without dietary antioxidants on nutrient digestibility,microbial nitrogen,and fatty acid metabolism[J].Journal of Dairy Science.2007,90(9):4361-4867.
[6] 袁施彬,陈代文.不同氧化应激模式下仔猪血细胞参数变化的比较研究[J].动物营养学报,2008,20(6):617-623.
[7] 李丽娟,陈代文,余冰,等.氧化应激对断奶仔猪肌体氧化还原状态的影响[J].动物营养学报,2007,19(3):199-203.
[8] DENG Q L,XU J,YUA B,et al.Effect of dietary tea polyphenols on growth performance and cell-mediated immuneresponse of post-weaning piglets under oxidative stress[J].Archives of Animal Nutrition,2010,64(1):12-21.
[9] SIEKMEIER R,STEFFEN C,MÄERZ W.Role of oxidants and antioxidants in atherosclerosis:results of in vitro and in vivo investigations[J].Journal of Cardiovascular Pharmacology and Therapeutics,2007,12(4):265-282.
[10] ZHOU L Z H,JOHNSON A P,RANDO T A.NFkappaB and AP-1 mediate transcriptional responses to oxidative stress in skeletal muscle cells[J].Free Radical Biology and Medicine,2001,31(11):1405-1416.
[11] HANWELL H EC,KAY C D,LAMPE J W,et al.Acute fish oil and soy isoflavone supplementation increase postprandial serum(n-3)polyunsaturated fatty acids and isoflavones but do not affect triacylglycerols or biomarkers of oxidative stress in overweight and obese hypertriglyceridemic men[J].Journal of Nutrition,2009,139(6):1128-1134.
[12] YOUSEF M I,KAMEL K I,ESMAIL A M,et al.Antioxidant activities and lipid lowering effects of isoflavone in male rabbits[J].Food and Chemistry Toxicity,2004,42(9):1497-1503.
[13] FOTI P,ERBA D,RISO P,et al.Comparison between daidzein and genistein antioxidant activity in primary and cancer lymphocytes[J].Archives of Biochemistry Biophysics,2005,433(2):421-427.
[14] LEE C H,YANG L,XU JZ,et al.Relative antioxidant activity of soybean isoflavones and their glycosides[J].Food Chemistry,2005,90(4):735-741.
[15] 陈芳.大豆异黄酮对断奶仔猪抗氧化作用研究[D].硕士学位论文.广州:华南农业大学,2005.
[16] JIANG Z Y,JIANG S Q,LIN Y C,et al.Effects of soybean isoflavoneon growth performance,meat quality,and antioxidation in male broilers[J].Poultry Science,2007,86:1356-1362.
[17] 蒋宗勇,周桂莲,林映才,等.大豆异黄酮抵抗体外培养猪脂肪细胞氧化损伤的作用[J].中国畜牧杂志,2010,46(9):29-32.
[18] PEARSON T,MENSAH G,ALEXANDER R,et al.Markers of inflammation and cardiovascular disease application to clinical and public health practice:a statement for healthcare professionals from the centers for disease control and prevention and the American heart association[J].Circulation,2003,107(3):499-511.
[19] WELLEN K E,HOTAMISLIGIL G S.Inflammation,stress,and diabetes[J].Journal of Clinical Investigation,2005,115(5):1111-1119.
[20] DONATO A J,ESKURZA I,SILVERA E,et al.Direct evidence of endothelial oxidative stresswith aging in humans:relation to impaired endothelium dependent dilation and upregulation of nuclear factor kappa B[J].Circulation Reserch,2007,100(11):1659-1666.

