采用酸碱提取法对鲢肌肉蛋白分离特性的影响
傅润泽,刘俊荣,王帅,汪涛,辛草
(大连海洋大学食品科学与工程学院,辽宁大连116023)
采用酸碱提取法对鲢肌肉蛋白分离特性的影响
傅润泽,刘俊荣,王帅,汪涛,辛草
(大连海洋大学食品科学与工程学院,辽宁大连116023)
对酸处理和碱处理过程中鲢肌肉蛋白质的分离特性,包括蛋白质溶解度、回收率和匀浆黏度等进行了比较研究。结果表明:当pH为1.5~12.5时,普通肉溶解蛋白(Solution ordinary muscle protein,SMP-1)与血合肉溶解蛋白(Solution dark muscle protein,SMP-2)溶解度的变化规律无明显差别,酸处理的最大溶解度均在pH为2.5下,碱处理的最大溶解度均在pH为11.5~12.5下,两者等电点均在pH为5.5下;普通肉匀浆(Ordinary muscle homogenate,OMH)和血合肉匀浆(Dark muscle homogenate,DMH)的黏度均随溶解度的增加而增加,但OMH黏度要高于DMH;采用酸碱处理法的蛋白质回收率都非常高,IMP-1最高能达到90.5%,IMP-2也能达到89.5%。
鲢;血合肉;普通肉;分离蛋白;等电点
随着中国渔业生产的发展,经济鱼类逐年减少,但低值鱼产量却逐年增多。这些低值鱼类由于价格低,加工和回收手段落后,造成大量营养成分流失,资源浪费严重且污染了环境[1]。目前低值鱼蛋白主要加工利用途径有鱼糜、鱼粉、液体鱼蛋白和浓缩鱼蛋白等[2],其中鱼粉与鱼糜制品是经典的低值鱼蛋白的有效利用途径,但二者都有一定的局限性。鱼粉的局限性在于其功能性差,只能用作饲料,饲用鱼蛋白需再经生物链转换后方可供人类利用;鱼糜技术的局限性在于对原料蛋白质性质的苛刻要求制约了很大一部分变性鱼蛋白的利用。另外液体鱼蛋白目前也主要用于饲料行业。功能性浓缩鱼蛋白是近年来低值鱼研究的重点方向之一,人们不断探索新的浓缩鱼蛋白加工利用方法,开发出具有功能性的鱼蛋白制品[3-5]。
采用酸碱处理(pH-shifting)提取动物蛋白是20世纪90年代末新兴的一种技术,该方法是利用蛋白质在不同pH下溶解度不同的原理,先在极端条件下将绝大部分蛋白质溶解,去掉不溶解物,再调pH至蛋白质的等电点沉淀回收[6]。将此方法用于鱼肌肉分离蛋白的制备能显著提高产率,使废水中蛋白质的含量大大降低,从而减少了废水处理成本[7-8]。此外,前期研究发现,在功能性方面用该方法分离的鱼蛋白也有明显的优势[9]。
鲢为中国淡水养殖四大鱼类之一,虽然易饲养、生长快、成本低,但其肉薄、鱼刺多,风味不及其它淡水鱼,在市场上不很受欢迎,是典型的低值水产品。本研究中,作者采用酸碱处理法分别对鲢普通肉和血合肉进行加工处理,得到普通肉分离蛋白(Isolated ordinary muscle protein,IMP-1)和血合肉分离蛋白(Isolated dark muscle protein,IMP -2),并对处理过程中所表现出来的鲢肌肉蛋白质的分离特性,以及蛋白质的溶解度、回收率和黏度等进行比较研究,旨在为进一步探索低值鱼加工的新工艺、新方法提供参考资料。
1 材料与方法
1.1 仪器设备
试验仪器有:DS21型高速匀浆机(上海样品模型厂生产);GL-21M高速冷冻离心机(湖南湘仪实验仪器开发有限公司生产);PHS—3C型pH计(上海精密科学仪器有限公司生产);721型分光光度计(上海光谱仪器有限公司生产);电热恒温鼓风干燥箱(上海跃进医疗机械厂生产); NDJ—8S型数字黏度计(上海精密科学仪器有限公
司生产);GH型鱼肉脱骨机(深圳市奇华达实业有限公司制造生产);分析天平(北京赛多利斯仪器系统有限公司生产)。
1.2 原料及处理
鲜活鲢购自大连市长兴水产品市场,平均体质量为0.8 kg。将鲢解剖,剪去鳍和尾,刮鳞后去头、去内脏,用冰水洗净后,采用手工刨片,然后用采肉机采肉,上述操作均在4℃下进行。第一次采肉所得鱼肉颜色白嫩,绝大多数为普通肌肉,将此鱼肉作为试验用普通肉原料(Ordinary muscle, OM);第二次采肉所得鱼肉颜色为暗红色,绝大多数为血合肉,将此鱼肉作为试验用血合肉原料(Dark muscle,DM)。将两种鱼肉装入包装袋真空密封,每袋质量均为1 kg,然后将鱼肉立即放入冰柜(-20℃)中冷冻保存,以供试验用。
1.3 肌肉蛋白质的酸碱溶解处理与回收
1.3.1 鱼肉匀浆的准备 从冰柜中取出普通肉原料或血合肉原料各150 g,4℃下解冻。将解冻后的鱼肉与去离子水按质量比1∶9混合,并在匀浆机中以10 000 r/min匀浆30 s(4℃),分别得到普通肉匀浆(Ordinary muscle homogenate,OMH)和血合肉匀浆(Dark muscle homogenate,DMH)。
1.3.2 蛋白质的溶解 将普通肉匀浆分为两份,以0.5 pH为梯度,一份用1 mol/L HCl依次调节pH到1.5(酸处理),另一份采用1 mol/L NaOH依次调节pH到12.5(碱处理),即得到不同pH值下普通肉的溶解蛋白(Solution ordinary muscle protein,SMP-1)。采用同样方法处理血合肉,即得到不同pH值下血合肉的溶解蛋白(Solution dark muscle protein,SMP-2)。
1.3.3 蛋白质的等电点沉淀 调节SMP-1的pH到等电点,即得到普通肉分离蛋白(Isolated ordinary muscle protein,IMP-1);采用同样方法处理SMP-2,即得到血合肉分离蛋白(Isolated dark muscle protein,IMP-2)。
采用酸碱处理法制备分离鱼蛋白质的流程见图1。
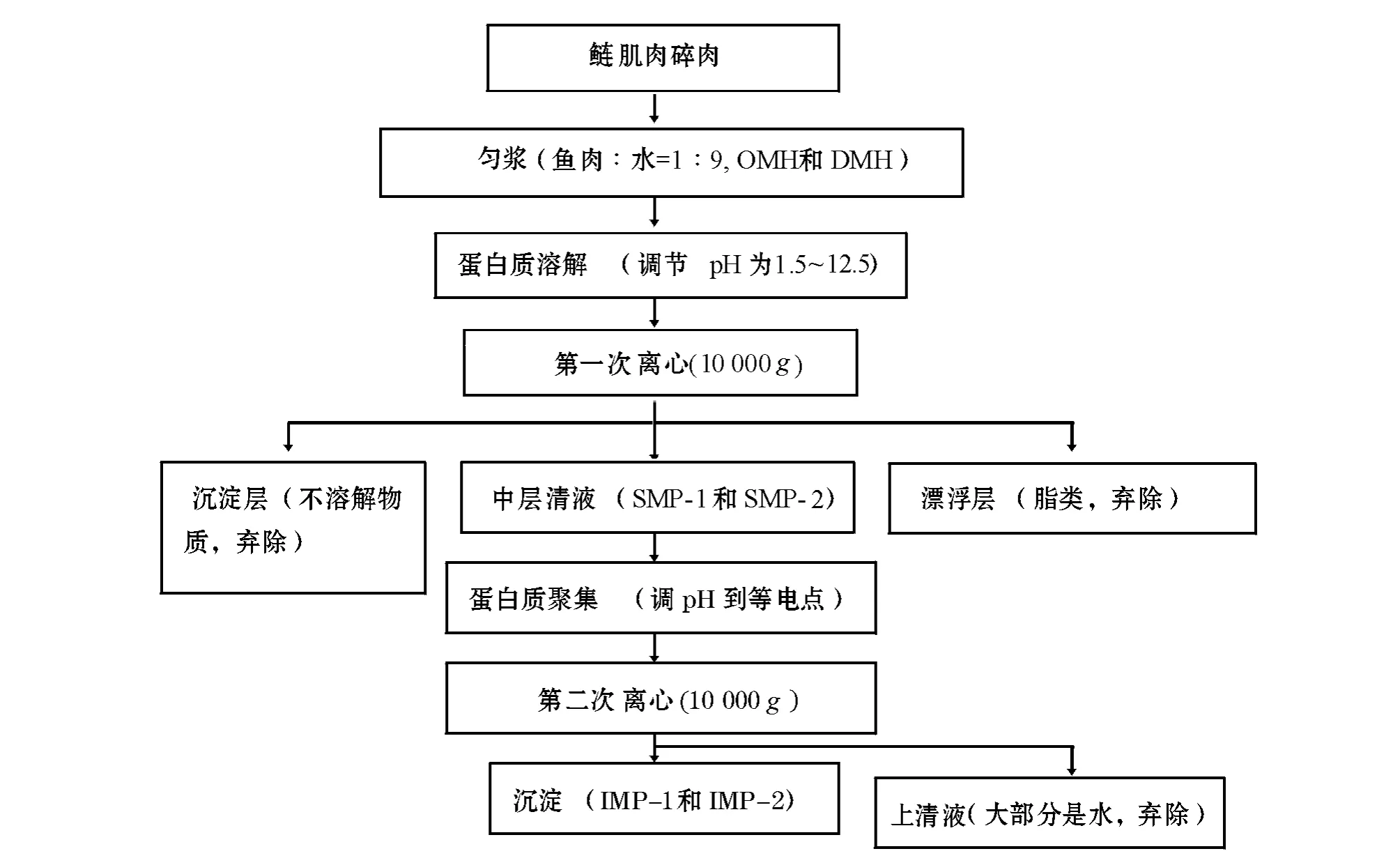
图1 采用酸碱处理法制备分离鲢蛋白质的流程图Fig.1 Flowing chart of the acid and alkaline process used in the production of fish muscle protein isolates
1.4 分析测试
1.4.1 蛋白质含量的测定 采用双缩脲法测定蛋白质的含量[10],用721型分光光度计测定吸光度时,波长为540 nm,测定前加入体积分数为10%的脱氧胆酸以减少因脂质的存在而造成的浑浊[11]。
1.4.2 蛋白质溶解度的测定 测定鲢SMP-1和SMP-2在pH为1.5~12.5(以0.5为梯度)时蛋白质的溶解度。计算公式如下:
蛋白质溶解度=(中层清液蛋白质浓度×中层清液体积)/(总蛋白质浓度×匀浆体积)×100%。
1.4.3 肌肉匀浆黏度的测定 测定鲢OMH和DMH在pH为1.5~12.5(pH的梯度为0.5)时的黏度,取OMH和DMH各两份,一份用1 mol/L HCl依次调节pH到1.5,另一份用1 mol/L的NaOH依次调节pH到12.5,采用NDJ—8S型数字黏度计测定每一个pH下的黏度,转子选取1号转子,转速为60 r/min。
1.4.4 蛋白质回收率的测定 测定鲢IMP-1和IMP-2在pH为1.5~12.5(pH的梯度为0.5)时蛋白质的回收率。计算公式如下:
蛋白质回收率=(A-B)/C×100%,
式中:A为第一次离心中层清液中蛋白质的含量(mg),A=第一次离心中层清液中蛋白质浓度(mg/mL)×第一次离心中层清液的体积(mL);B为第二次离心上清液中蛋白质的含量(mg),B=第二次离心上清液中蛋白质的浓度(mg/mL)×第二次离心上清液的体积(mL);C为总蛋白质含量(mg),C=总蛋白质浓度(mg/mL)×匀浆体积(mL)。
总蛋白质浓度和上清液蛋白质浓度的测定方法与蛋白质溶解度的测定方法相同。
2 结果与讨论
2.1 酸碱处理过程中鲢肌肉蛋白的溶解特性
蛋白质在水中并不是真正溶解而是形成蛋白胶体,蛋白质的溶解是蛋白质与蛋白质相互作用以及蛋白质与溶剂相互作用的结果[12]。鲢SMP-1和SMP-2在pH为1.5~12.5时的溶解度曲线显示出蛋白质溶解度在这一区间随pH变化的趋势(图2)。当pH为5~9时,蛋白质之间缺乏静电斥力,疏水作用增强了蛋白质与蛋白质相互作用,因此溶解度不高;当pH为5.5(等电点)时,蛋白质的溶解度最小;而当pH高于10.5和低于4时,蛋白质呈现较高的溶解度。可以认为,在上述pH条件下,强烈的蛋白质分子内静电斥力导致蛋白质分子结构的肿胀和展开,因而导致蛋白质的变性。强烈的静电斥力同样使得蛋白质分子之间难以聚合沉淀,因而溶解度比较高[13]。当pH为4~5以及pH为9~10.5时,蛋白质的溶解度发生了急剧变化,由接近pI点的10%~20%突然升高到80%~90%。
比较图2中的两条曲线可以看出:SMP-1和SMP-2的溶解特性未有明显差别,SMP-1和SMP -2所表现出的溶解特性均为:pH为2.5时,此时溶解度最大,可以达到95%;pH为11.5~12.5时,溶解度能达到94%左右;pH为5.5时,溶解度小于10%。比较图2中的酸性区域和碱性区域可以看出:pH为1.5~4时,两种鱼肉蛋白的溶解度均呈先增加后减少的趋势,pH为2.5时其溶解度最大;而在碱性区域其溶解度先增加后趋于平衡。pH小于2.5时溶解度呈下降趋势的原因是, HCl浓度的上升增加了阴离子强度,从而降低了蛋白分子之间的静电斥力[14]。
蛋白质溶解度曲线的测定,是进一步研究的基础。通过不同pH下的溶解度曲线,可以确定酸碱处理过程中最适的操作参数。
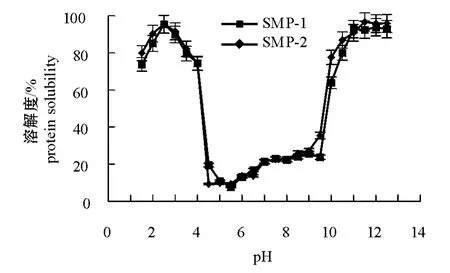
图2 鲢普通肉溶解蛋白和血合肉溶解蛋白的溶解度随pH变化的曲线Fig.2 Protein solubility of soluable ordinary muscle protein(SMP-1)and soluable dark muscle protein(SMP-2)at pH 1.5-12.5
2.2 酸碱处理过程中鲢肌肉匀浆黏度的特性
在酸碱处理过程中,肌肉匀浆的黏度是十分重要的。在一定程度上黏度能反映出肌肉蛋白质分子的理化特性和结构的变化。而低黏度是离心分离可溶性蛋白质和不溶性物质的关键,同时低黏度也可使脂类物质的去除变得更加容易[11]。液体的黏度并不完全取决于蛋白质的特性,还受到温度等试验条件的影响。由于蛋白质匀浆液属于典型的非牛顿性流体,测定的黏度值随着所受剪切力的变化而变化,因此研究中必须使用同一个转子以及同种转速进行测量。虽然测量的有效量程有限,所得数据的重现性较差,但对于本研究中仅做定性分析来说,依然可以得出较完整的结论[15]。
从图3可见,当pH为1.5~12.5时,OMH和DMH的黏度曲线均在pH为2.5~3.5以及pH为10.5~11.5时出现峰值,两者在酸性和碱性区间的黏度要明显大于中性区域。蛋白质溶解度的增加会伴随黏度的上升,这是因为随着pH的上升或下降,极端pH下的高净电荷引起的强大分子内静电斥力导致蛋白质分子的肿胀和展开,实际上也导致蛋白质的变性。正是由于蛋白质在分子构象上的改变增加了其流体动力学体积,引起液体黏度的上升[16]。比较两种匀浆的黏度曲线可以看出:OMH黏度要高于DMH,这应该与两种鱼肉的组成成分不同有关。与普通肉相比,血合肉中含有更多的水溶性蛋白、糖原、酶类和脂肪[16]。比较图3中两条曲线的酸性区域和碱性区域可以看出:采用酸处理时OMH的黏度要高于碱处理下的黏度,而DMH在两种处理方式下黏度无明显差别。
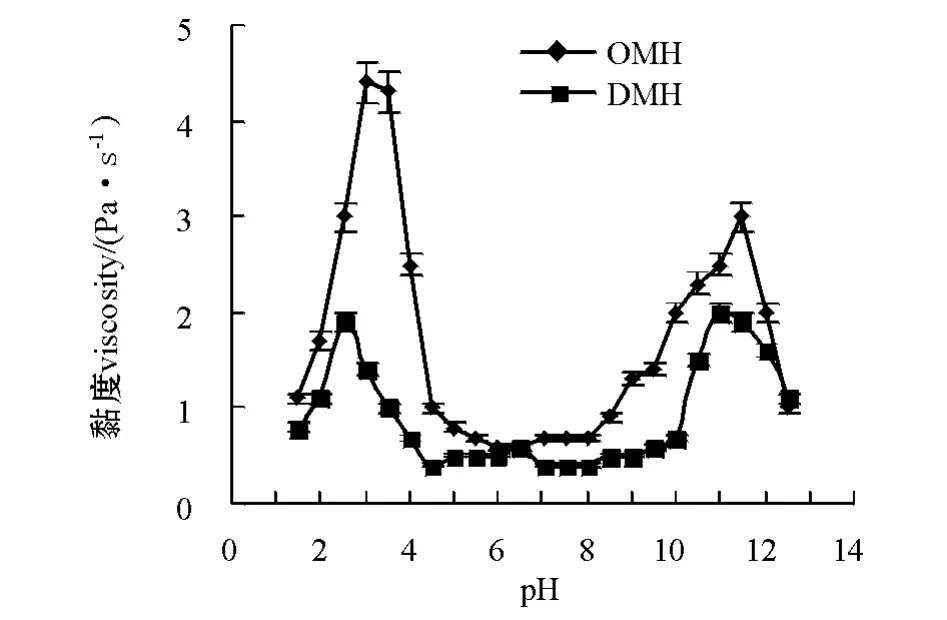
图3 鲢普通肉匀浆和血合肉匀浆的黏度随pH变化的曲线Fig.3 Viscosityofordinarymusclehomogenate (OMH)anddarkmusclehomogenate (DMH)at pH 1.5-12.5
2.3 等电点处理过程中鲢肌肉蛋白的回收特性
蛋白质回收率是评价肌肉分离蛋白制备工艺水平的一个重要指标。与传统加工方法相比,采用酸碱处理时,蛋白质的回收率要高[17]。从图4可见:酸处理过程中IMP-1的回收率最高能达到90.5%, IMP-2能达到87.5%;碱处理过程中IMP-1和IMP-2回收率都能达到89.5%。这说明该工艺在鱼肌肉分离蛋白的制备方面具有很好的开发利用潜力。
鲢IMP-1和IMP-2回收率随pH的变化趋势均与溶解度的变化规律一致,即两种鱼肉在酸性区域和碱性区域的蛋白回收率明显要高于中性区域。比较图4中的两条曲线可以看出:pH为1.5~ 12.5时,IMP-1和IMP-2的回收率未有明显差别,但在酸性区域IMP-1的回收率略微高于IMP-2。pH为1.5~4.0时,其回收率呈先增加后减少的趋势,当pH为2.5时其回收率最大;pH大于10.5时,其回收率先增加后趋于平衡。蛋白质回收率随pH变化的曲线图为采用酸碱处理方法制备鱼肌肉分离蛋白提供了参考,若仅考虑尽可能多地回收蛋白质,采用酸处理方法的最佳pH为2.5,而采用碱处理时最佳pH为11.5。
虽然蛋白质的回收率主要受溶解度的影响,但在实际处理过程中还受有许多其它因素的影响,如蛋白匀浆中脂类及一些残留物质的影响,匀浆机和离心机的转速,以及操作过程中蛋白质的损失等[18]。
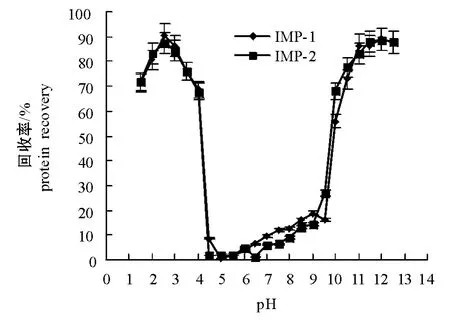
图4 鲢普通肉分离蛋白和血合肉分离蛋白的回收率随pH变化的曲线Fig.4 Recovery of isolated ordinary muscle protein (IMP-1)and isolated dark muscle protein (IMP-2)at pH 1.5-12.5
3 小结
本研究中探索了用等电点法时鲢肌肉蛋白的分离特性,对比了碱溶解和酸溶解两种处理方法对鲢肌肉蛋白分离特性的影响,同时还对普通肉和血合肉的蛋白分离特性进行了比较。结果显示:1)采用酸溶解和碱溶解两种处理方法对鲢肌肉蛋白的分离特性的影响基本相同,蛋白溶解度、回收率和匀浆黏度等项指标变化规律均未有明显差别;2)在同种处理条件下,普通肉与血合肉蛋白的溶解特性基本相同,且溶解度越高,回收率和黏度就越高,二者在最大溶解条件下表现出较高的蛋白质回收率,普通肉最高能达到90.5%,血合肉最高能达到89.5%。总之,本研究结果表明,等电点法在鲢肌肉蛋白分离方面具有一定的优越性,在低值鱼
蛋白精深加工方面极具开发应用潜力。此外,酸碱溶解方法、处理条件以及血合肉的存在对鲢肌肉分离蛋白功能特性的影响等还有待进一步研究。
[1] 白福玉,郑华,蒋爱民.低值水产品及水产副产品的加工与综合利用[J].农产品加工,2007(4):76-79.
[2] 佟长青,刘俊荣,周丽敏,等.用鱼产品下脚料开发饲用液体蛋白技术的研究[J].大连水产学院学报,2006,21(4):394-396.
[3] 刘俊荣.鱼蛋白的综合利用途径1——鱼粉[J].水产科学, 2000,19(5):37-39.
[4] 刘俊荣.鱼蛋白的综合利用途径2——酸贮液体鱼蛋白[J].水产科学,2000,19(6):36-39.
[5] 刘俊荣.鱼肉蛋白质组织化方法的研究与应用[J].大连水产学院学报,1998,13(3):72-76.
[6] Nolsöe H,Undeland I.The acid and alkaline solubilization process for the isolation of muscle proteins:state of the art[J].Food Bioprocess Technol,2009(2):1-27.
[7] 陈申如,张其标,倪辉.酸法提取鲢鱼鱼肉蛋白质技术的研究[J].海洋水产研究,2004,25(5):61-64.
[8] 付湘晋,许时婴,王璋,等.酸碱提取鲢鱼蛋白功能特性的研究[J].食品工业科技,2007(4):116-118.
[9] 刘俊荣,汪涛,石泰,等.不同pH条件下罗非鱼肌肉蛋白分离效果及其功能特性的研究[J].水产科学,2010,29(6):317-323.
[10] Palafox H,Co’rdova-Murueta J H,Navarrete del Toro M A,et al. Protein isolates from jumbo squid(Dosidicus gigas)by pH-shift processing[J].Process Biochemistry,2009,44:584-587.
[11] Kristinsson H G,Ingadottir B.Recovery and properties of muscle proteins extracted from tilapia light muscle by pH shift processing [J].Food Engineering and Physical Properties,2006,71(3):132 -141.
[12] Damodaran S.Amino acids,peptides,and proteins[M]//Fennema O R.Food Chemistry.New York:Marcel Dekker Inc,1996: 370,389.
[13] Foegeeding E A.Characteristics of edible muscle tissues[M]// Fennema O R.Food Chemistry.New York:Marcel Dekker Inc, 1996:936.
[14] Goto Y,Fink A L.Acid induced folding of heme proteins[J]. Meth Enzymol,1994,232:3-15.
[15] 杨同舟.食品工程原理[M].北京:中国农业出版社,2001:20 -23.
[16] 汪之和.水产品加工与利用[M].北京:化学工业出版社, 2002:10-11.
[17] Kristinsson H G,Theodore A E,Demir N,et al.A comparative study between acid and alkali-aided processing and surimi processing for the recovery of proteins from channel catfish muscle [J].Food Chemistry and Toxicology,2005,70(3):298-306.
[18] Kristinsson H G,Liang Y.Effect of pH-shift processing and surimi processing on Atlantic croaker muscle proteins[J].Food Chemistry and Toxicology,2006,17(5):C304-C312.
Effect of isoelectric precipitation processing on isolating properties of fish muscle proteins
FU Run-ze,LIU Jun-rong,WANG Shuai,WANG Tao,XIN Cao
(College of Food Science and Engineering,Dalian Ocean University,Dalian 116023,China)
Ordinary muscle and dark muscle of silver carp were prepared using twice mechanical meat separating method,respectively,and soluable ordinary muscle protein(SMP-1)and dark muscle protein(SMP-2)were obtained under critical pH.Isolated ordinary muscle protein(IMP-1)and isolated dark muscle protein(IMP-2) were extracted by isoelectric precipitation processing.Main parameters including solubility,viscosity and recovery of protein of the acid and alkaline solubilization process and recovered with isoelectric precipitation were investigated.Results showed that there was no significant difference in soluble properties between SMP-1and SMP-2.Both SMP-1and SMP-2 showed a maximum solubility at pH 2.5 and 11.5,and their isoelectric pH were found at 5.5. Their viscosity were both changing with solubility,but the SMP-1 higher viscosity than the SMP-2 did.The acidaided and alkali-aided processes had effect on the yield of protein recovered in the same way,leading to very high recoveries of protein,90.5%for IMP-1 and 89.5%for IMP-2.
silver carp;ordinary muscle;dark muscle;protein isolate;isoelectric precipitation processing
TS254.9
A
2095-1388(2011)06-0539-05
2011-01-10
辽宁省海洋与渔业厅科研计划项目(200913)
傅润泽(1988-),男,硕士研究生。E-mail:furunze@126.com
刘俊荣(1963-),女,教授,博士。E-mail:ljunrong@dlou.edu.cn

