药物动力学-药效动力学联合模型的研究概况
胡 苹,李玉平
(上海市肺科医院药剂科,上海 200433)
药物动力学(pharmacokinetics, PK)-药效动力学(pharmacodynamics, PD)联合模型是将PK与PD紧密结合,用于研究药理效应随时间变化规律的一种模型。此模型可应用于药物开发的临床前和临床试验的各个阶段。本文介绍了该领域的一些概念和国内外研究概况,包括:效应室理论和Hill’s方程,PK-PD联合模型的属性,常用计算程序,应用及国内外研究实例。
PK是定量研究药物在体内随时间变化规律的科学,PD是定量地研究药物的药理效应随浓度变化规律的科学,长期以来,二者被认为是两门分离的学科。药物的药理效应是我们最关注的内容,许多药物药效过程很复杂,PK虽然提供了药物的体内行为,但不能提供药效信息,这就需要将PK与PD的结合。近年来,PK-PD联合模型能定量描述药物的效应-时间过程,还能解释造成这种效应-时间过程的原因[1]。通常PK提供的是血液中药物浓度的变化,但药物的作用部位一般不是血液。药物从血液分布到作用部位需要一定时间,这就导致了药物效应的变化滞后于血药浓度的变化[2]。因此,建立PK-PD结合模型的意义不言而喻。
1 Sheiner效应室理论与Hill's方程
根据药效滞后于血药浓度的现象,Sheiner等提出了效应室理论[3]。该理论认为:效应室(作用部位)是以一级动力学与中央室连接的假想室;出现药效滞后是由于药物从中央室分布到效应室需要一定的时间;从中央室分布到效应室的药量与实际给药量相比极小,它的存在对药物体内过程的影响可忽略不计。
PD模型有:线性模型、对数模型、米氏方程和Hill’s方程,然而Hill’s方程覆盖了前3个模型,所以应用最多。表达如下:

其中E0为基础药理效应值;Em为最大药效强度的增量;EC50为药效强度达最大药效强度一半时的药物浓度;r为形状因子,一般在1附近变化,主要影响曲线斜率,当r=1时,Hill’s方程就等于米氏方程,Ce为药效部位的药物浓度。
将估算得到的PK参数固定,拟合出Ce,并代入方程,根据测得的药效数据可估算出方程中相应参数。
2 PK-PD模型的属性
2.1 直接连接或间接连接模型
直接连接模型(Direct link mode1)是假设中央室和药物作用部位直接相连,且两者中的药物浓度可迅速平衡,故可用血药浓度直接作为PD模型中的Ce,药物浓度和效应最大值同时出现,效应浓度曲线没有滞后。
如果药物从中央室向作用部位的分布需要一定时间,作用部位的药物浓度变化滞后于中央室药物浓度(血药浓度)变化,导致药效的变化也滞后于血药浓度的变化。此类药物,可根据Sheiner提出的效应室理论,建立间接连接模型(Indirect link mode1),以效应室(Effect compartment)药物浓度Ce输入PD模型。
两种模型中,药物效应均与作用部位浓度直接相关,只是血药浓度与作用部位浓度的相关性不同。
2.2 直接效应或间接效应模型
直接效应(Direct response)和间接效应(Indirect response)是根据药效与药物的直接作用的相关性来区分的。当药效是由药物直接引起的,则为直接效应模型。当给药后通过影响一系列受体或酶等物质的水平才能起效时,因体内物质水平的变化需要时间,药效的出现将滞后于药物浓度的变化,此时适用间接效应模型。
前节的直接连接和间接连接模型的分类模式是从药物分布是否存在滞后的角度,而本节的直接反应和间接反应模型则是从药物的作用机制的角度。有时两种模型可以根据需要与内部机制联合使用。
2.3 时间变化或时间恒定模型
如果药效只取决于作用部位的药物浓度,药效学参数保持恒定,则为时间恒定模型;若在作用部位药物浓度相同的情况下,不同时间的药效不同,则为时间变化模型。时间变化药效学需要用耐受模型和敏感模型来描述,抗生素药效学研究常常会遇到这种状况。
(1)耐受模型:尽管效应部位的药物浓度恒定,但是药物效应却会下降,效应对浓度作图会出现一滞后环。在最大效应模型中,假如受体下调,最大效应随时间减低,假如受体脱敏,E50会随时间而增大。
(2)敏感模型:当效应部位的药物浓度恒定时药物效应却随时间而增加,这时效应对浓度作图会出现一滞后环。仅仅分析单剂量的浓度-效应数据不能准确地识别,只有在多剂量或稳态情况下才能解析这种过程。
3 常用计算程序
常用的运算程序包括WinNonLin、NONMEM、ADAPTII等,它们或具有PD模型,或具有PK-PD模型,其中以NONMEM最适合进行群体PK-PD的解析。
4 PK-PD联合模型的应用
4.1 临床前药物评价
可用于建立给药剂量、血药浓度和药效或毒性间的定量关系,计算PK-PD参数,研究化合物的有效性和安全性,为进一步开发提供参考。PK-PD结合模型也可用于评价剂型和给药系统,为以后临床剂型和给药方案提供指导;估算生物利用度和药物间相互作用;评价长期用药是否产生耐药性等。
4.2 在药物开发临床试验中的作用
在药物开发的临床试验阶段,PK-PD联合模型可用于评价药效与代谢物的关系;年龄和疾病对药效学的影响;预测药物产生的副作用以及临床试验的模拟等。
同时,基于机制的PK-PD联合模型在药物的研发[4-5]过程中起到了越来越重要的作用。
5 近年研究实例
抗癫痫药物苯妥英钠对颅内手术病人使用的罗库溴铵(一种骨骼肌松弛药物,作为全身麻醉的辅助剂进行常规的气管内插管,并使骨骼肌在手术或机械呼吸时放松,以便于手术操作及提高机体的气体交换)的PK及PD的影响[6]。苯妥英钠对骨骼肌松弛药的神经肌肉阻断作用的影响已有文献报道[7],但研究较为浅薄,不能从PK及PD的机制方面加以定量阐述。本研究的目的在于从PK及PD的机制方面定量描述苯妥英钠使用与否对罗库溴铵的药理作用的影响。作者搜集21位接受颅内手术患者,所有患者均使用罗库溴铵,其中10位患者合并使用苯妥英钠。使用NONMEM软件建立、评价及验证PK-PD模型。结果表明,苯妥英钠能够增加罗库溴铵的清除率(从0.26到0.75),但是对其它PK及PD参数并无影响。从而从PK机理方面解释了苯妥英钠对罗库溴铵的影响。
特布他林(Terbutaline)是一种选择性β2受体激动剂,由于肝中表达这种受体,故可作用于肝脏增加肝糖输出,进而提高血糖。特布他林的体内药物动力学行为符合二室模型。静脉滴注硫酸特布他林1 h后停止,由于药物的作用部位为血流丰富的肝脏,故可以认为中央室和效应室间的药物浓度可迅速达到平衡。血糖的提高会刺激胰岛素的分泌,胰岛素分泌的增加又会提高机体对血糖的利用,从而降低血糖,其PK-PD模型框图(图1)[8]。

图1 PK-PD模型框图
对于药物动力学解析较为常规,这里不再赘述。将获得的药物动力学模型与参数值固定,拟合生成血药浓度,代入药效动力学模型中,根据药效强度求算药效动力学参数。
药效动力学模型中的微分方程可以写为:
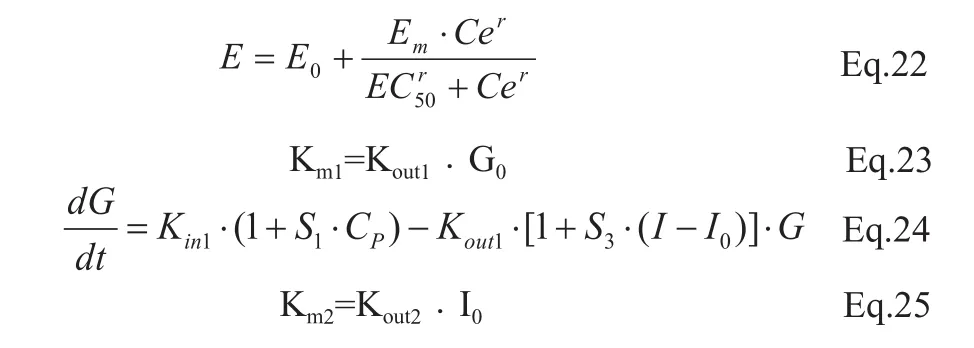
Cp=血浆药物浓度;G=血浆葡萄糖浓度mg/dL;G0=基础葡萄糖浓度;I=血浆胰岛素浓度(μU/mL);I0=基础胰岛素浓度;Kin1=葡萄糖产生速率;Kin2=胰岛素产生速率;Kout1=葡萄糖分布速率常数;Kout2=胰岛素分布速率常数。
本阶段需要拟合的参数有S1、S2、S3、Kin1、Kout1、Kin2、Kout2,S1越大,药物的作用强度越大;S2与S3有相似的功能;Kin1与Kin2反映机体单位时间内产生葡萄糖及胰岛素的量,而Kout1与Kout2反映机体利用葡萄糖及胰岛素的速率。可使用NONMEM软件对参数进行计算和评估。限于篇幅,此例只作原理及过程说明。对药物的作用机制研究越透彻,PK-PD模型就越接近真实,对药物在体内效应的预测就越理想。
丹参酮对大鼠血浆中高半胱氨酸的双向作用[9],基于此,Yuancheng Chen等[10]建立了基于机制的丹参酮的PK-PD模型,以表述及预测药物的双向作用。丹参酮对血浆中的高半胱氨酸具有降低作用,而其提高作用是由丹参酮的甲基化代谢物[11]引起的。模型化和仿真的结果表明:提高作用发生于降低作用之前,但降低作用比提高作用表现出了更强的剂量依赖性;模型使复杂的药理作用过程被简化成两步;在正常大鼠中,长期给予丹参酮并不能影响高半胱氨酸的水平,但如果同时给予蛋氨酸的话,则能明显降低高半胱氨酸的量,这与以前文献报道一致[12]。这些可为多酚类药物对高半胱氨酸的影响研究提供一个范例。
6 结论
综上所述,PK-PD联合模型研究,无论是对临床前的药物开发还是临床合理用药,都有非常重要的意义。特别是根据受体原理研究出的基于机制的PK-PD联合模型,将使PK-PD结合模型越来越完善,在未来的药物开发中PK-PD结合研究必将更充分地发挥其重要作用并加速药物开发的进程。
[1] Derendof H.Modeling of pharmacokinetic/pharmaco dynamic (PK-PD)relationships: concepts and perspectives[J].Pharm Res,1999,16(2):176-185.
[2] Derendorf H.Pharmacokinetic/ Pharmacodynamic modeling in drug research and development[J].J Clin Pharmacol,2000,40(12):1 399-1 418.
[3] Sheiner LB.Simultaneous modeling of pharmacokinetics and pharmaco- dynamics: Application to d-tubocurarine[J].Clin Pharmacol Tther,1979,25:358-379.
[4] 凌树森.治疗药物监测新理论与新方法[M].中国医药科技出版社, 2002:106-132.
[5] Ryosei LK.Mechanism-Based PKPD projections in Exploratory Drug Develop ment[J].Drug Metab Pharmacokinet,2009,24:1-2.
[6] Juan Fernández-Candil.Pharmacokinetic–pharmacodynamic modeling of the influence of chronic phenytoin therapy on the rocuronium bromide response in patients undergoing brain surgery[J]. Eur J Clin Pharmacol,2008,64:795-806.
[7] Richard A.Cisatracuriuminduced neuromuscular blockade is affected by chronic phenytoin or carbamazepine treatment in neurosurgical patients[J].Anesth Analg,2005,100:538-544.
[8] John J,Lima.Modeling the metabolic effects of terbutaline in β2-adrenergic receptor diplotypes[J].Clinical Pharmacology & Therapeu tics,2004,2004,76(1):27.
[9] Cao YG.Beneficial effects of danshensu, an active component of Salvia miltiorrhiza,on homocysteine metabolism via the transsulphuration pathway in rats[J].Br J Pharmacol,2009,10:1 476-1 485.
[10] Chen YC.Mechanism-Based Pharmacokinetic-Pharmaco dynamic Model ing of Bidirectional Effect of Danshensu on Plasma Homocysteine in Rats[J].J Pharm Res,2009,26:1 863-1 873.
[11] Zhang ZC.Metabolic analysis of four phenolic acids in rat by liquid chromategraphy-tandem mass spectrometry[J].J Chromatogr B Analyt Technol Biomed Life Sci,2008,871:7-14.
[12] Sekiya A.Suppression of methionine-induced hyperhomocysteinemia by dietary eritadenine in rats[J].Biosci Biotechnol Biochem,2006,70:1 987-1 991.

