粪钙卫蛋白测定判断感染性腹泻的临床价值
白乌日娜,蒋 琳,计春燕,黄平晓,陈志强,覃丽佳,谭诗云
武汉大学人民医院 1.消化内科;2.检验科,湖北武汉 430060;3.湖北省新华医院
钙卫蛋白(calprotectin,CP)是一种炎症活动性标志物[1],而粪便钙卫蛋白(fecal calprotectin,FCP)以往国内外对其研究大多集中在炎症性肠病活动性的判断[2,3],至今为止国内外尚未报道 FCP与感染性腹泻相关关系的研究。本课题对感染性腹泻患者和腹泻型肠易激综合症(diarrhea-predominant irritable bowel syndrome,D-IBS)患者粪便钙卫蛋白的含量进行了初步探讨,以期探索一种判断感染性腹泻和非感染性腹泻有价值的临床指标。
1 材料与方法
1.1 病例和标本的收集
1.1.1 入选标准:按照国家《细菌性痢疾和阿米巴痢疾诊断标准及处理原则》、《感染性腹泻诊断标准和处理原则》为标准随机选择以急性腹泻(病程 <3周,每日排便量达 200 g以上,次数超过 3次,粪便稀薄,水分超过粪便总量的85%)为主要临床表现的粪便细菌培养结果阳性患者,排除其他脏器炎症及消化道肿瘤病变。以腹泻为主症的肠易激综合征(IBS)患者,参照罗马Ⅲ标准确诊[4]。
1.1.2 对照组:选择1周内在我院行健康体验各项指标均正常的健康志愿者;且所有入选者在纳入研究时均无明显上消化道症状、无严重心、肺、肝、肾及神经精神疾病等;排除酗酒、药物成瘾、孕妇及长期服用非甾体类抗炎药者[5]。
1.1.3 标本及临床资料收集:留取急性腹泻患者、DIBS患者及健康志愿者粪便少许(5~10 g),1 h内送实验室并置于 4℃冰箱保存,3天内进行集中抽提。同时收集所有入选者病史、临床资料。
1.2 方法
1.2.1 主要试剂和仪器:人粪便钙卫蛋白检测ELISA试剂盒(瑞士Buhlmann公司),酶标仪(Perkin Elmer公司1420型),全自动酶标洗板机(奥地利Asys Hitech公司Flexiwash),微量低温高速离心机(德国贺力氏公司的Thermo Heraeus Fresco 21),SS琼脂(上海医学化验所试剂厂生产),API20E肠道菌鉴定生化条(法国生物梅里埃公司)。
1.2.2 抽提:将留存粪便置于室温下平衡解冻,用一次性的取样环挑取约50~100mg,放入15 mL聚丙烯管(带螺口帽),取样环一并放入称重,按照质量/容积(g/mL)=1/49的比例加入抽提液,置于多管涡旋混合器充分摇动(最高速度)30 min,混匀样本后取1.5 m L置于 2 mL离心管中,用微量离心机离心5 min (10 000×g),取上清液1 mL留存于-50℃冰箱备用。1.2.3 酶联免疫反应:严格按照人粪便钙卫蛋白检测ELISA试剂盒说明书进行,将钙卫蛋白提取液置于室温下平衡解冻,以 1∶50比例稀释,室温下(18~28℃)孵育,采用常规双抗体夹心法。测定:将酶标仪设置为450 nm进行测定,标准品包括 5个质量浓度(600、300、100、30、10μg/g),共进行了两次样本检测,最高浓度标准液的光密度值为 2.397及 2.284,用四参数法计算得出标准曲线,以 1∶50稀释的样本若超过标准曲线范围而未被测出,则需用缓冲液进一步稀释并重新测定直至测出为止,稀释倍数计算在最终的结果中,每次样本检测要重新建立当次的标准曲线。
1.2.4 粪便细菌培养:将粪便直接接种于SS琼脂平板上,在37℃温箱中孵育 24~36 h,然后挑选细小透明菌落接种于克氏半固体琼脂斜面,应用API20E肠道菌鉴定生化条进行分纯。
1.3 统计学分析 应用SPSS 16.0统计软件进行分析。计算样本的中位数、四分位间距、全距,组间比较采用非参数检验Mann Whitney U检验,P<0.05表示差异有统计学意义。相关系数用Spearman相关分析计算,r>0表示呈正相关。
2 结果
2.1 各组病人临床资料分析 48例感染性腹泻患者男28例,女 20例,男女比为 1.4∶1;发病年龄 2~68岁,中位年龄 32岁,其中腹泻次数 >5次/d的有 30例,大便常规镜检白细胞数 <20个/HP有 9例,≥20个/HP有39例,≥30个/HP有28例,≥40个/HP有12例。D-IBS 30例,男 12例,女 18例,男女比为1∶1.5,发病年龄 20~67岁,中位年龄 39岁。正常对照组 30例,男 18例,女 12例,男女比为1.5∶1,发病年龄 22~64岁,中位年龄 34岁。三组年龄、性别差异均无统计学意义(P>0.05),资料具有可比性。
2.2 大便细菌培养结果 48例急性腹泻患者粪便标本感染志贺菌 16例,肠侵袭性大肠杆菌 12例,肠致泻性大肠埃希菌 11例,致病性弧菌9例。
2.3 各组之间FCP的检测值的比较 感染性腹泻组FCP含量显著高于D-IBS组和正常对照组(P<0.01),后两者之间无显著性差异(P>0.05,见表1)。
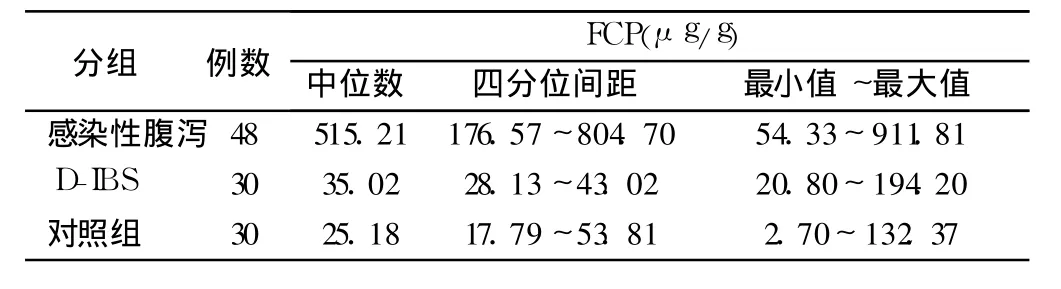
表1 各组之间FCP测定结果Tab 1 The levels of FCP in different groups
2.4 FCP检测值与镜下白细胞个数之间的相关性分析 感染性腹泻患者FCP检测值与粪便显微镜下白细胞个数之间进行相关性分析显示两者呈正相关(r= 0.761),即镜下白细胞个数越多,其FCP检测值越高(见图1)。
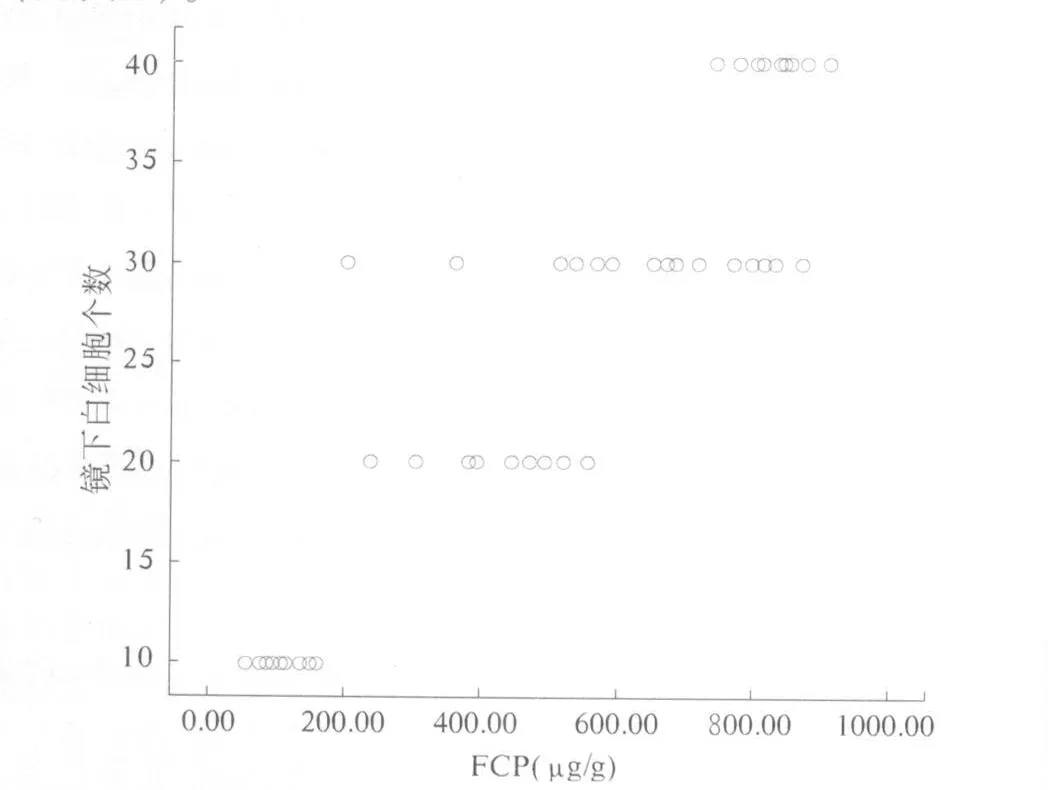
图1 FCP检测值与镜下白细胞个数之间的相关性Fig 1 Correlation between the levels of FCP and the quantity o f feca l leukocytes
2.5 FCP检测的敏感性、特异性和准确性 78例腹泻病人中,当将FCP值100μg/g为临界值时,病人判断感染性腹泻的检测敏感性为 85.4%,特异性为90.0%,准确性为87.2%(见表2)。

表2 FCP检测的敏感性、特异性和准确性Tab 2 Diagnostic sensitivity,specificity and accuracy of FCP
3 讨论
钙卫蛋白主要来源于中性粒细胞及巨噬细胞,能通过鳌合锌离子而具有耐热性和结合钙离子而发挥抗蛋白酶活性,在肠腔和外界环境中可长期保持相对稳定而不被酶和细菌所破坏,不会随粪便降解而被水解掉,甚至样本在室温下放置 5 d也不会使其浓度有明显丢失[6]。有研究表明FCP含量约是血浆钙卫蛋白含量的 6倍[7],故粪便炎性标志物比血清标志物应更能敏感地反映消化道炎症程度。此外,钙卫蛋白具有免疫调节[8]、抗微生物活性[9]、炎症反应中的调节蛋白[10]等多种生物保护功能。
本研究检测了48例感染性腹泻、30例D-IBS患者及 30例健康对照组 FCP,结果发现感染性腹泻组FCP检测值显著高于D-IBS组和正常对照组,后两者无显著性差异(P>0.005)。感染性腹泻FCP值升高的原因可能为病原体进入肠道后在小肠内繁殖,并黏附于黏膜释放致病性肠毒素,从而在肠道引起分泌性反应导致腹泻,并且借助其侵袭力可直接侵袭肠上皮细胞引起肠黏膜充血、水肿、中性粒细胞的浸润和炎症介质的渗出及溃疡的形成,中性粒细胞通过病变黏膜逐渐迁移至肠腔使FCP增高,从粪便排出。而D-IBS是肠功能紊乱导致肠道动力功能障碍而引起的腹泻,不存在肠黏膜的炎症和组织损伤,从而无中性粒细胞的浸润。本研究还发现感染性腹泻FCP检测值与粪便镜下白细胞个数呈正相关。镜下白细胞数越多其FCP检测值越高,说明钙卫蛋白的水平与肠道黏膜炎症程度密切相关[11]。以往有学者将 FCP值定为 50 μg/g[12]作为临界值来判断炎症性肠病患者的活动性有较高敏感性与特异性。本研究将FCP临界值定为100μg/g时判断感染性腹泻敏感性为85.4%,特异性为90%,准确性为87.2%,因此认为FCP可作为感染性腹泻初步判断标准。
因此,本研究认为粪便 FCP作为非侵入性肠道炎症指标,对肠道感染性疾病的初步诊断和鉴别诊断中具有较大临床价值。且该指标具有简便、经济、快速、准确性较高等特点,值得临床推广应用。
[1] Kerkhoff C,Klempt M,Sorg C.Novel insights into structure and function of MRP8 and MRP14[J].Biochim Biophys Acta,1998, 1448(2):200-211.
[2] Erbayrak M,Turkay C,Eraslan E,et al.The role of fecal calprotectin in invetigating inflammatory bowel diseases[J].Clinics,2009, 64(5):421-425.
[3] Konikoff MR,Denson LA.Roleof fecalcalprotectin asa biomarker of intestinal inflammation in inflammatory bowel disease[J].Inflamm Bowel Dis,2006,12(6):524-534.
[4] Drossman MD.Rome III/functional gastrointestinal disorders[M]. 3rd ed.Ke MY,Fang XC.Beijing:Science Press,2008:231-346.
德罗斯曼.罗马III/功能性胃肠病[M].第3版.柯美云,放秀才,等译.北京:科学出版社,2008:231-346.
[5] Poullis A,Foster R,Mendall MA,etal.Proton pump inhibitors are associated with elevation of faecal calprotectin andmay affect specificity[J].Eur JGastroenterol Hepatol,2003,15(5):573-574.
[6] Huang PX,Tan SY,Luo XF,et al.Fecal calprotectin in estimation of activity of peptic ulcers[J].Chin JDig Endosc,2010,27(3): 97-100.
黄平晓,谭诗云,罗小芳,等.粪便钙卫蛋白判断消化性溃疡活动性的临床价值[J].中华消化内镜杂志,2010,27(3):97-100.
[7] Roseth AG,Fagerhol MK,Aadland E,et al.Assesment of theneutrophil dominating protein calprotectin in fecesamethodologic study[J].Scand JGastroenterol,1992,27(9):793-798.
[8] Brun JG,Haga HJ,Boe E,et al.Calprotctin in patients with rheumatoid arthritis:relation to c linical and laboratory variabises of disease activity[J].Rheumatol,1992,19(6):859-862.
[9] Lehrer RI.Holocrine secretion of calprotectin:a nertrophil-mediated defense against Candida albicans[J].Lab Clin Med,1993,121 (2):193-194.
[10] Brun JG,Haland G,Haga HJ,et al.Effects of calprotectin in avridine-induced arthritis[J].APMIS,1995,103(3):233-240.
[11] Roseth AG,Aadland E,Jahnsen J,et al.Assessmentofdisease activity in ulcerative colitis by faecal calprotectin,a novel granulocyte marker protein[J].Digestion,1997,58(2):176-180.
[12] Fagerberg UL,Lööf L,Myrdal U,et al.Colorectal inflammation is well predicted by fecal calprotectin in children with gasteointestinal symptoms[J].Pediatr Gastroenterol Nutr,2005,40(4): 450-455.

