偏侧咀嚼致咀嚼肌功能紊乱发病机制的研究
王子娴 徐龙博 祁冬 林雪芬 应王贵 孙圣军 陈彬 汲平,2
(1.山东大学口腔医院 修复科;2.山东省口腔生物医学重点实验室,济南 250012)
偏侧咀嚼致咀嚼肌功能紊乱发病机制的研究
王子娴1徐龙博1祁冬1林雪芬1应王贵1孙圣军1陈彬1汲平1,2
(1.山东大学口腔医院 修复科;2.山东省口腔生物医学重点实验室,济南 250012)
目的 探讨偏侧咀嚼所导致的咀嚼肌功能紊乱的发生机制。方法 用原子分光光度法检测Ca2+含量;用比色法检测钙调神经磷酸酶活性;用三磷酸腺苷酶(ATPase)染色检测肌纤维类型。结果 1)除8周组外,实验组拔牙侧Ca2+含量均升高,且明显高于对照组(P<0.05)。其中,4周组Ca2+含量升高最为明显。2)实验组非拔牙侧Ⅰ型肌纤维/(Ⅰ+Ⅱ)型肌纤维比例升高,高于正常对照组水平(P<0.05)。3)CaN活性随Ca2+含量的升高呈钟形变化。4)慢肌纤维比例与CaN活性呈正相关(r=0.876,P<0.05)。结论 高含量Ca2+激活了与骨骼肌生长和肌纤维转化有关的信号通路,使肌纤维实现从快到慢的转化。这可能是偏侧咀嚼致咀嚼肌功能紊乱的发生机制之一。
偏侧咀嚼; 钙调神经磷酸酶; 肌纤维类型; 肌功能紊乱
偏侧咀嚼是咬合功能紊乱的一种表现形式,也是一种常见的口腔疾病。长期偏侧咀嚼会对口颌系统、主要是颞下颌关节和咀嚼肌的组织结构造成不同程度的影响,与颞下颌关节紊乱症(temporomandibular disorder,TMD)的发病密切相关。TMD的临床症状包括:颞下颌关节区及咀嚼肌疼痛,下颌运动异常和伴有功能障碍及关节弹响等。有些TMD患者就诊时提出其咀嚼肌酸痛无力,难以忍受。那么为何一些经久不愈、病程迁延的颞下颌关节紊乱症患者会出现上述症状呢?
大量研究[1-2]表明:骨骼肌类型的转化对骨骼肌功能的改变有重要影响。为了深入研究TMD咀嚼肌损伤和疲劳发生的机制,本研究依据李宁毅等[3]的方法,模拟临床患者长期缺牙后常出现偏侧咀嚼的致病方式,建立偏侧咀嚼动物模型,通过比较偏侧咀嚼组与正常对照组以及拔牙侧与对侧的咬肌Ca2+、钙调神经磷酸酶(calcinuerin,CaN)和肌纤维类型的变化,分析Ca2+和CaN、CaN和肌纤维类型之间的相关性,研究CaN在偏侧咀嚼致咀嚼肌损伤中的作用,并从CaN影响肌纤维类型变化的角度探讨TMD咀嚼肌功能紊乱的发生机制。
1 材料和方法
1.1 实验动物
健康雌性Wistar大鼠36只(山东大学动物中心提供),约8周龄,每只质量250~300 g,无牙齿磨耗及牙颌畸形。
1.2 实验方法
将36只Wistar大鼠用随机数字表法先分成4组,每组9只,分别于拔牙2、4、6、8周后进行样品的采集和制备。每组再按1∶2分为2组,一组3只为对照组,一组6只为实验组即偏侧咀嚼模型组。实验组大鼠经腹腔注射3%戊巴比妥钠(1.2mL·kg-1)麻醉,全麻后置于手术台上,用4条细绳分别固定大鼠的前后肢,正畸用结扎丝固定上切牙于手术台上,用探针将大鼠口腔拉开,固定舌头。拔除左侧上颌后牙,术后给予抗生素控制感染。对照组不拔牙,其余操作同实验组。
1.3 咬肌标本的制备
大鼠分批行颈椎脱臼法处死后,迅速切取咬肌中段浅层2mm×2mm×2mm大小,液氮冰冻,放入-80℃冰箱保存。取出剩余咬肌上段及下段,放入预冷(4℃)的生理盐水中洗去余血,去除结缔组织后,分别称取0.4 g和0.2 g肌肉(湿重),于-80℃保存。
1.4 咬肌Ca2+含量的测定
取出存于-80℃冰箱中的咬肌组织,用原子吸收分光光度法测定钙离子含量。取组织块0.4 g,烘干,硝化,低温冻干,在波长为422 nm的原子分光光度计(此波长为钙离子的特异性曲线)上测定含量。测得数值表示为每克干重组织Ca2+/含量(μg·g-1)。
1.5 咬肌CaN活性的测定
应用德国Merke公司生产的CaN活性比色法测试盒进行CaN活性测定。
1.6 咬肌肌纤维类型的测定
取出标本,-20℃恒温连续切片(片厚约6μm),吹干,冷丙酮固定10min,晾干,4℃保存。染色前取出,吹干,烤片,行三磷酸腺苷酶(adenosinetriphosphate,ATPase)染色。采用盲法,用DT2000图像分析系统进行分析,根据ATPase活性差异,将肌纤维分为慢肌纤维(Ⅰ型),颜色浅灰;快肌纤维(Ⅱ型),颜色深灰。取均值,计算出慢肌纤维百分比构成(Ⅰ型纤维数/合计肌纤维数×100%)。
1.7 统计方法
用SPSS 16.0统计软件对Ca2+含量、CaN活性和肌纤维类型比例各周组内对照组和实验组及实验组双侧间进行单因素方差分析和LSD检验,并对Ca2+和CaN、CaN和肌纤维类型比例进行相关性分析。
2 结果
2.1 咬肌组织中Ca2+含量
除8周组外,实验组拔牙侧Ca2+含量均有升高并且高于对照组(P<0.05);各组拔牙侧Ca2+含量高于非拔牙侧,其中,4周组Ca2+含量升高最为明显,拔牙侧高于非拔牙侧,差异有显著性(P<0.05),见表1。
表1 咬肌Ca2+含量的变化Tab 1 Changes of Ca2+contents of masseter muscle μg·g-1,±s
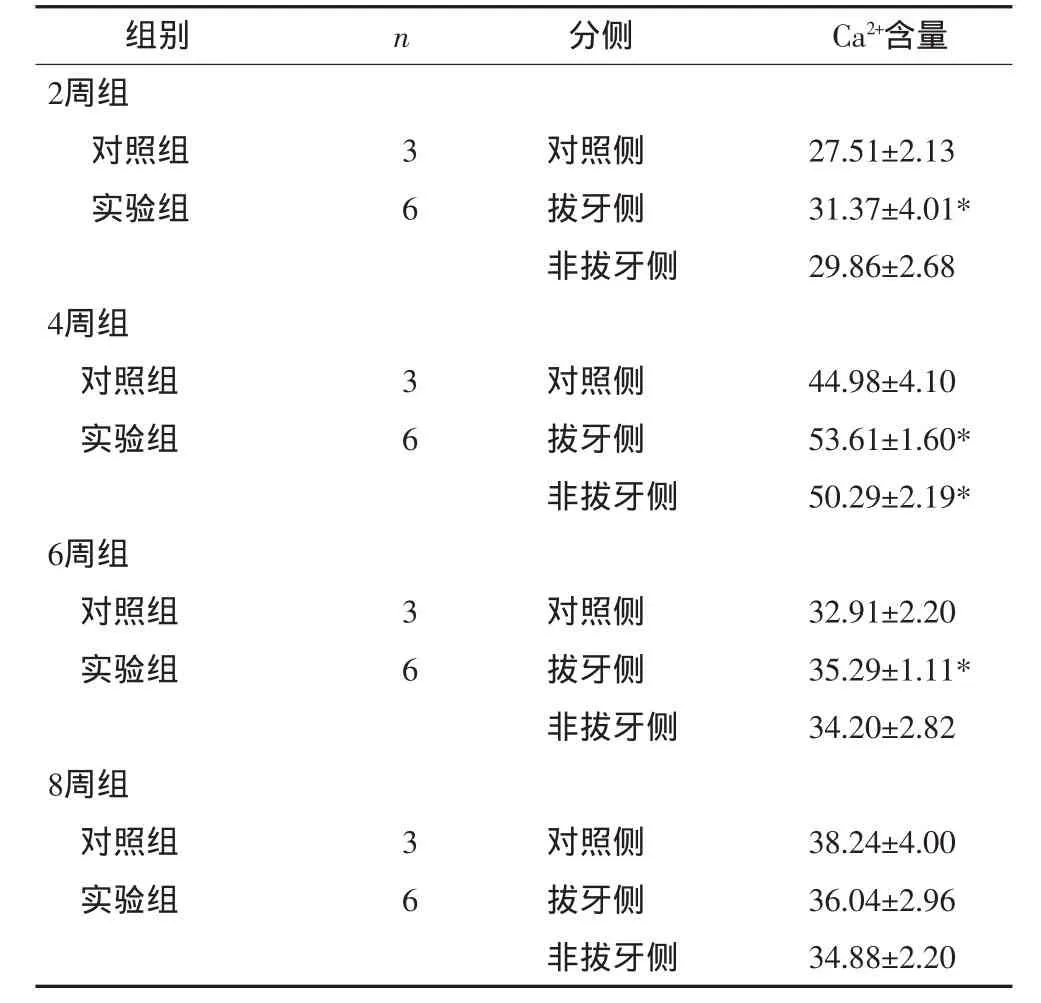
表1 咬肌Ca2+含量的变化Tab 1 Changes of Ca2+contents of masseter muscle μg·g-1,±s
注:*P<0.05。
组别 n 分侧 Ca2+含量2周组对照组 3 对照侧 27.51±2.13实验组 6 拔牙侧 31.37±4.01*非拔牙侧 29.86±2.68 4周组对照组 3 对照侧 44.98±4.10实验组 6 拔牙侧 53.61±1.60*非拔牙侧 50.29±2.19* 6周组对照组 3 对照侧 32.91±2.20实验组 6 拔牙侧 35.29±1.11*非拔牙侧 34.20±2.82 8周组对照组 3 对照侧 38.24±4.00实验组 6 拔牙侧 36.04±2.96非拔牙侧 34.88±2.20
2.2 咬肌CaN活性
除2周组外,随时间延长,实验组双侧CaN活性有所升高(表2)。
表2 咬肌钙调神经磷酸酶活性的变化Tab 2 Changes of CaN activities of masseter muscle nmol,±s

表2 咬肌钙调神经磷酸酶活性的变化Tab 2 Changes of CaN activities of masseter muscle nmol,±s
注:*P<0.05。
组别 n 分侧 CaN活性2周组对照组 3 对照侧 -1.14±0.07实验组 6 拔牙侧 1.17±0.05*非拔牙侧 0.96±0.10* 4周组对照组 3 对照侧 -0.18±0.01实验组 6 拔牙侧 -0.24±0.00非拔牙侧 0.74±0.24* 6周组对照组 3 对照侧 -0.03±0.01实验组 6 拔牙侧 -0.02±0.01非拔牙侧 -0.05±0.00 8周组对照组 3 对照侧 0.01±0.00实验组 6 拔牙侧 0.29±0.01*非拔牙侧 -0.04±0.04
2.3 咬肌肌纤维类型
除2周组外,实验组非拔牙侧Ⅰ型肌纤维/(Ⅰ+Ⅱ)型肌纤维比例逐渐升高,高于拔牙侧,高于正常对照组水平(P<0.05),见表3。
表3 咬肌慢肌纤维类型的变化Tab 3 Changes of fibre types of massetermuscle %,±s
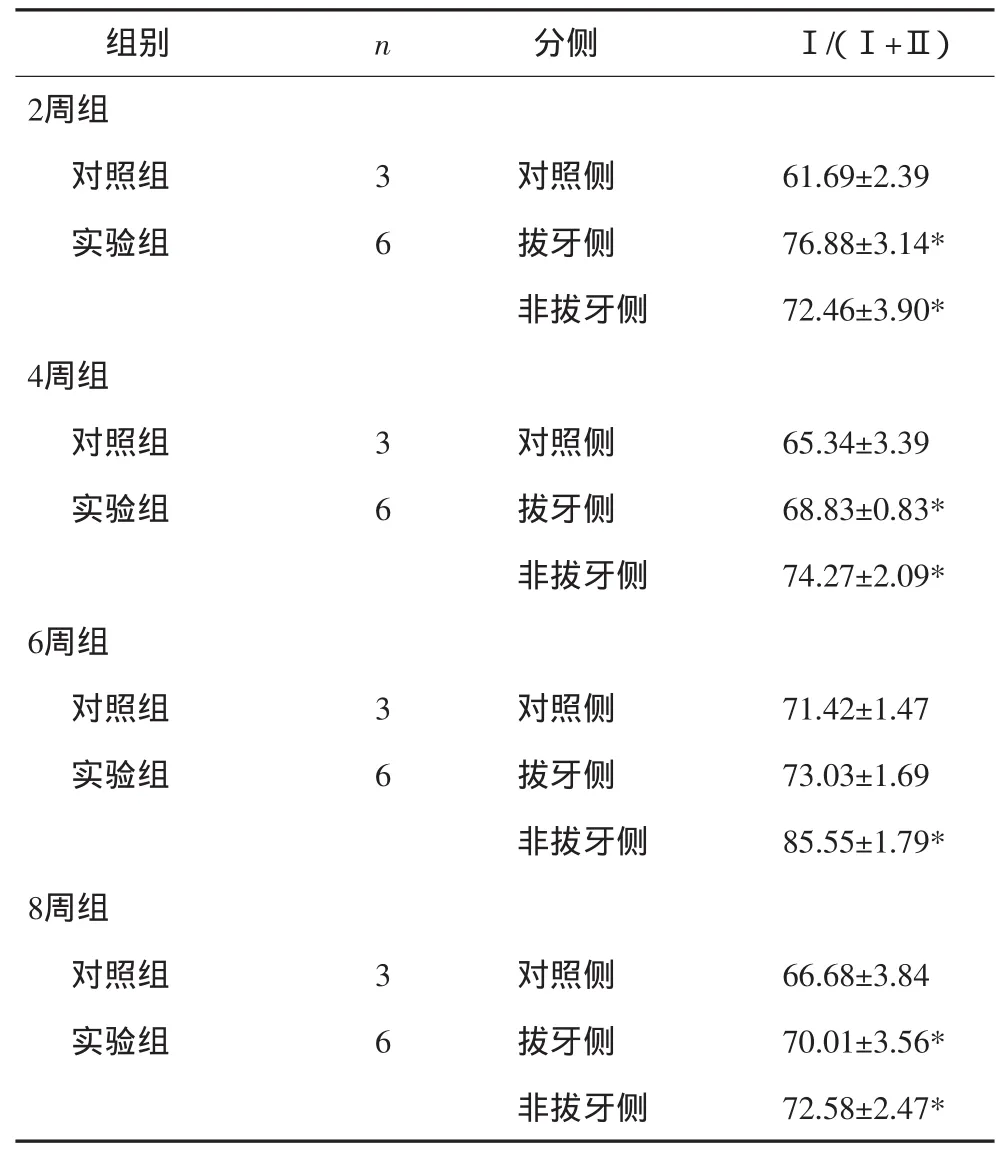
表3 咬肌慢肌纤维类型的变化Tab 3 Changes of fibre types of massetermuscle %,±s
注:*P<0.05。
组别 n 分侧 Ⅰ/(Ⅰ+Ⅱ)2周组对照组 3 对照侧 61.69±2.39实验组 6 拔牙侧 76.88±3.14*非拔牙侧 72.46±3.90* 4周组对照组 3 对照侧 65.34±3.39实验组 6 拔牙侧 68.83±0.83*非拔牙侧 74.27±2.09* 6周组对照组 3 对照侧 71.42±1.47实验组 6 拔牙侧 73.03±1.69非拔牙侧 85.55±1.79* 8周组对照组 3 对照侧 66.68±3.84实验组 6 拔牙侧 70.01±3.56*非拔牙侧 72.58±2.47*
2.4 Ca2+含量和CaN活性的关系
由图1看出,CaN活性随Ca2+含量升高呈钟形变化。当Ca2+含量为31.56μg·g-1时,CaN活性达到峰值。

图1 咬肌Ca2+含量和CaN活性Fig 1 Ca2+contents and CaN activities of masseter muscle
2.5 CaN活性与肌纤维类型的关系
如散点图2所示,慢肌纤维所占总肌纤维的比例与CaN活性呈正相关(r=0.876,P<0.05)。

图2 咬肌CaN活性与肌纤维类型比例Fig 2 CaN activities and ratio of fibre type of masseter muscle
3 讨论
有学者[4]实验得出,大鼠正常的咀嚼模式为双侧对称,频率基本相同。通过磨牙法可观察到大鼠咀嚼时下颌切点运动轨迹随着磨牙时间的增长,口腔静止时下颌相对于上颌有位移,偏向健侧,形成了偏侧咀嚼习惯,用大鼠来建立偏侧咀嚼的动物模型是可行的。本实验采取拔除一侧后牙造成的偏侧咀嚼动物模型是公认的比较成熟的模型。虽然拔牙可能会使咀嚼肌组织结构产生一定程度的病理变化,但在本实验中观察到所有大鼠的拔牙创均在5~8 d愈合,2周后牙槽窝基本平复,因此对本实验结果不会有影响。
偏侧咀嚼造成了牙合紊乱,为适应其变化,神经肌肉活动及局部循环均有一定的改变,伴随而来的是肌肉功能的改变与损伤,它是由可逆性向不可逆性逐渐变化与发展的。但是目前这种损伤发生的机制尚未十分明确。
3.1 偏侧咀嚼引起Ca2+含量的持续升高
多年来,Ca2+都被认为是与调控骨骼肌生理机能密切相关的第二信使,在骨骼肌损伤与疲劳的同时总是伴随着细胞内Ca2+含量的升高。Ca2+可能是通过细胞膜上的Ca2+通道进入细胞内;或者是各种原因引起细胞膜损伤而造成胞外Ca2+内流;Ca2+的泵出发生障碍也是使Ca2+水平持续升高的原因。Bani等[5]通过磨除大鼠一侧后牙牙尖造成错牙合实验发现:2周后细胞内Ca2+含量出现明显的升高。随后,Ca2+含量持续升高。这同本研究结果相似。8周时,实验组双侧Ca2+含量均低于对照组,可能与机体代偿及咬肌内出现大量新生肌纤维有关[6]。传统组织病理学观点认为,生物体成熟的骨骼肌细胞属于终末分化细胞,一旦遭受破坏,就成为永久性的功能障碍和组织缺失。而现代创伤修复学认为再生是创伤愈合的始动和基础,事实上骨骼肌的损伤和再生是一个连续病理过程中的不同阶段[7]。Ruiz-Bonilla等[8]也证实成年大鼠骨骼肌中同样存在骨骼肌的再生。
3.2 CaN对慢肌纤维基因表型的下调作用
根据组织化学染色方法,通常将骨骼肌分为2大类:慢肌(Ⅰ型)和快肌(Ⅱ型)。其化学特征反映,Ⅰ型纤维在咀嚼的强大收缩中产生高张力,耐疲劳;Ⅱ型纤维适宜维持姿势和嚼磨等中等力量的持续收缩,易疲劳。咀嚼肌多以Ⅱ型纤维占优势。肌纤维类型的转化可以通过多种不同的信号通路和分子机制进行调控。目前研究比较多的2条途径是肌源调节因子途径和钙:钙调磷酸酶途径。
高含量的Ca2+可以激活钙依赖性信号传导途径CaN通路,国内外学者普遍认为CaN是骨骼肌重塑的重要信号分子[9-10]。研究[11]发现:CaN足以激活生物体内编码慢肌纤维表型的基因程序。本研究中慢肌纤维基因显型随CaN活性升高出现上调的趋势,也证实了CaN对慢肌纤维的调控作用。另外有学者[12]指出:单纯CaN的存在不能完全掌控慢肌纤维的转化与维持。这也解释了本实验中虽然CaN活性随Ca2+含量升高而呈钟形变化,但慢肌纤维比例依旧持续升高,同时提示关注另一种钙依赖性信号传导途径——CAMK通路。随着Ca2+含量变化CaN活性呈钟形曲线变化,这种现象可能是由于组织中的CaN内源性抑制因子作用而产生的[13]。Mu等[14]通过实验得出:分别阻断CaN或CAMK信号通路均能观察到骨骼肌纤维由快到慢的转变,然而,只有当2条通路协同作用时,才能使肌纤维发生最大程度的转化。本实验CaN活性随时间的变化并无明显的规律可循。分析可能是由于骨骼肌中钙调神经磷酸酶含量较少且样本含量小,从而导致结果无统计学意义。
3.3 偏侧咀嚼与咀嚼肌功能紊乱
咀嚼肌功能紊乱是指咀嚼肌疼痛,张口痛性受限,下颌运动不协调,咀嚼无力等一系列症状综合征。发病因素为咬合异常、下颌的过度运动、精神因素、偏侧咀嚼习惯、神经衰弱等。本实验结果证明偏侧咀嚼组双侧肌纤维类型变化明显,非拔牙侧慢肌纤维所占比例显著高于拔牙侧,左右同名肌不对称指数增加。Hylander等[15]研究得出偏侧咀嚼时非咀嚼侧关节所承受的压力大于咀嚼侧,由于左右两侧所处的生物机械环境不同,其组织反应亦不相同,结果显示非咀嚼侧的病理变化较咀嚼侧显著。这也正是本实验中非拔牙侧比拔牙侧肌纤维类型改变明显的原因。
根据本实验,偏侧咀嚼导致TMD患者的咀嚼肌功能紊乱的机制可能是:长期偏侧咀嚼引起咀嚼肌组织中Ca2+含量升高。高含量的Ca2+激活了大量与骨骼肌生长和肌纤维转化有关的信号通路,激活后的信号通路促进编码慢肌表型蛋白基因转录,诱导肌纤维实现从快到慢的转化,左右同名肌不对称指数增加,下颌运动不协调,出现咀嚼肌功能紊乱。本研究为TMD的临床治疗提供了新的靶点,可以从抑制钙依赖性信号通路着手[16],通过调控肌纤维类型的转化,来维持咀嚼肌的正常功能,从而减轻咀嚼肌紊乱综合征患者的痛苦。
[1] Sargeant AJ,de Haan A.Human muscle fatigue:The significance of muscle fibre type variability studied using a micro-dissection approach[J].J Physiol Pharmacol,2006,57(Suppl 10):5-16.
[2] Matsakas A,Bozzo C,Cacciani N,et al.Effect of swimming on myostatin expression in white and red gastrocnemius muscle and in cardiac muscle of rats[J].Exp Physiol,2006,91(6):983-994.
[3] 李宁毅,肖进,陈发明.偏侧咀嚼对大鼠颞下颌关节及咀嚼肌影响的研究[J].口腔医学,2003,23(6):321-323.
LI Ning-yi,XIAO Jin,CHEN Fa-ming.The impaction of unilateral mastication on the temporomandibular joint and masticatory muscles in rats[J].Stomatology,2003,23(6):321-323.
[4] 李波,李晓箐,易新竹.偏侧咀嚼习惯对口颌系统的影响——动物模型建立[J].实用口腔医学杂志,2006,22(2):152.
LI Bo,LI Xiao-jing,YI Xin-zhu.Effect of lateral mastication on maxillofacial system—establish an animalmodel[J].JPract Stomatol,2006,22(2):152.
[5] Bani D,Bani T,Bergamini M.Morphologic and biochemical changes of the masseter muscles induced by occlusal wear:Studies in a rat model[J].J Dent Res,1999,78(11):1735-1744.
[6] Akagawa Y,Nikai H,Tsuru H.Histologic changes in rat masticatory muscles subsequent to experimental increase of the occlusal vertical dimension[J].J Prosthet Dent,1983,50(5):725-732.
[7] Carlson BM,Faulkner JA.The regeneration of skeletal muscle fibers following injury:A review[J].Med Sci Sports Exerc,1983, 15(3):187-198.
[8] Ruiz-Bonilla V,Perdiguero E,Gresh L,et al.Efficient adult skeletal muscle regeneration in mice deficient in p38beta,p38gamma and p38delta MAP kinases[J].Cell Cycle,2008,7(14):2208-2214.
[9] Talmadge RJ,Otis JS,Rittler MR,et al.Calcineurin activation influencesmuscle phenotype in a muscle-specific fashion[J].BMC Cell Biol,2004,5:28.
[10]Pandorf CE,Jiang WH,Qin AX,et al.Calcineurin plays a modulatory role in loading-induced regulation of type I myosin heavy chain gene expression in slow skeletal muscle[J].Am J Physiol Regul Integr Comp Physiol,2009,297(4):1037-1048.
[11]da Costa N,Edgar J,Ooi PT,et al.Calcineurin differentially regulates fast myosin heavy chain genes in oxidative muscle fibre type conversion[J].Cell Tissue Res,2007,329(3):515-527.
[12]Chin ER.The role of calcium and calcium/calmodulin-dependent kinases in skeletal muscle plasticity and mitochondrial biogenesis [J].Proc Nutr Soc,2004,63(2):279-286.
[13]Cao X,Kambe F,Miyazaki T,et al.Novel human ZAKI-4 isoforms:Hormonal and tissue-specific regulation and function as calcineurin inhibitors[J].Biochem J,2002,367(Pt 2):459-466.
[14]Mu X,Brown LD,Liu Y,et al.Roles of the calcineurin and CaMK signaling pathways in fast-to-slow fiber type transformation of cultured adult mouse skeletal muscle fibers[J].Physiol Genomics,2007,30(3):300-312.
[15]Hylander WL,Johnson KR,Crompton AW.Loading patterns and jaw movemen ts during mastication in Macaca fascicularis:A bone-strain,electromyographic,and cineradiographic analysis[J]. Am J Phys Anthropol,1987,72(3):287-314.
[16]Tabata C,Ogita K,Sato K,et al.Calcineurin/NFAT pathway:A novel regulator of parturition[J].Am J Reprod Immunol,2009,62(1):44-50.
(本文编辑 汤亚玲)
Research about the mechanism in masticatory muscle dysfunctional induced by hem imastication
WANG Zixian1,XU Long-bo1,QI Dong1,LIN Xue-fen1,YING Wang-gui1,SUN Sheng-jun1,CHEN Bin1,JI Ping1,2.(1.Dept. of Prosthodontics,College of Stomatology,Shandong University,Jinan250012,China;2.Key Laboratory of Oral Biomedicine of Shandong Province,Jinan250012,China)
ObjectiveTo study the mechanism in masticatory muscle dysfunctional induced by hemimastication.MethodsCa2+contents were measured with atomic absorption spectrometry;calcinuerin were measured with colorimetric method;muscle fiber types were measured with adenosine-triphosphate(ATPase)staining.Results 1)Compared with the controls,Ca2+contents in experimental group had the higher level except 8 weeks(P<0.05).2)The ratio of slow fiber in experimental group increased,higher than the match groups(P<0.05).3)With Ca2+contents rise,the activities of calcinuerin present a bell-like shape.4)The ratio of slow-type fiber was positively correlated to the activities of calcinuerin(r=0.876,P<0.05).ConclusionThe signal way of muscle fiber growth and fiber transformation were activated by high concentration of calcium,then,muscle fiber transfered from fast to slow type.It may play an important role in the mechanism that hemimastication result in masticatory muscles dysfunction.
hemimastication; calcinuerin; muscle fiber type; masticatory muscles dysfunction
R 783.5
A
10.3969/j.issn.1000-1182.2011.01.023
1000-1182(2011)01-0096-04
2010-05-10;
2010-09-14
山东省自然科学基金资助项目(Y2006c216)
王子娴(1984—),女,山东人,硕士
汲平,Tel:0531-88382448

