运用手持技术测定尿素的摩尔质量
冯雪琦 马宏佳
(南京师范大学课程与教学研究所 化学与材料科学学院 江苏 南京 210046)
一、问题的提出
人教版教材《化学》(九年级下册)在第十一单元《盐化肥》中指出——公路上的积雪可以用氯化钠来消除。在实际的教学过程中,学生对食盐融化积雪的原理不知甚解。原来,非挥发性溶质溶解在溶剂中后,溶液的凝固点会低于纯溶剂,而且其凝固点降低值只与溶质的分子数有关而与溶质的种类无关,这种性质称为稀溶液的依数性。因此,当向积雪中加入氯化钠后,体系凝固点的降低促使冰雪融化。
经查阅资料,在稀溶液中,溶质、溶剂质量已知的前提下,根据溶液凝固点的降低值可以测定出溶质的摩尔质量。本实验即以冰乙酸为溶剂、尿素作溶质,运用手持技术监测溶剂在加入溶质前后凝固点的变化情况,从而计算出尿素的摩尔质量。
二、实验原理
一定压力下,固态物质与液态物质呈相平衡时的温度称为该物质的凝固点。拉乌尔用实验证明了,溶液的凝固点下降ΔTf(即纯溶剂A与溶液B的凝固点之差)与溶液的质量摩尔浓度bB呈正比:

通常情况下,测定凝固点的方法是将溶液逐渐冷却,使其结晶。但是,实际上溶液冷却到凝固点,往往并不析出晶体。这是因为新相的形成需要一定的能量,故结晶并不析出,这就是所谓的过冷现象。然后由于搅拌或加入晶种促使溶剂结晶,由结晶放出的凝固热使体系温度回升至凝固点。
三、实验过程
1.试剂与仪器
Vernier温度传感器及数据采集器、分析天平、酒精灯、试管、烧杯;冰乙酸(分析纯)、尿素(分析纯)、粗盐、冰块。
2.实验步骤
(1)冷剂准备及温度调节
向200mL烧杯中装入适量的冰块和水,取适量粗盐与冰水混合,使冷剂温度达到-2℃~3℃。实验时冷剂应经常搅拌,并间断地补充少量的碎冰或食盐,使冷剂温度基本保持不变。
(2)溶剂凝固点的测定
将Vernier数据采集器、温度传感器、计算机三者连接(见图1)。 双击“Logger Pro”软件,设置采集长度:600秒,取样速度:1样本/秒。向干燥的试管内加入约10mL冰乙酸,加热试管使冰乙酸的温度高于其凝固点。将温度传感器插入试管中,待温度稳定后将其放入冰水浴中(试管中液面高度低于冷水浴液面),并点击 “采集”按钮。用温度计传感器缓慢搅拌,使溶剂较快地冷却。当温度低于凝固点0.2~0.3℃时急速搅拌(防止过冷),促使固体析出。当固体析出时,温度迅速回升,立即改为缓慢匀速搅拌。待数据采集停止后,选中图中的稳定阶段,点击按钮,统计得出此段的平均值即为冰乙酸的凝固点。
(3)溶液凝固点的测定
用分析天平称量mAg冰乙酸和mBg尿素。将准确称量的尿素加入盛有冰乙酸的试管(注意不要粘于试管壁上),加热试管,同(2)测定溶液的温度随时间的变化关系。

图1 实验装置图
3.实验数据与分析
(1)溶剂凝固点的测定
选中温度回升后的平稳阶段进行拟合,求得该段的平均值为15.71℃。如图2,冰乙酸的凝固点是15.71℃。

图2 冰乙酸的冷却曲线
(2)溶液凝固点的测定

图3 实验1中乙酸-尿素体系的冷却曲线
文献中查得冰乙酸的凝固点下降常数为3.9 K·kg·mol-1,五次实验测得的实验数据见表1。
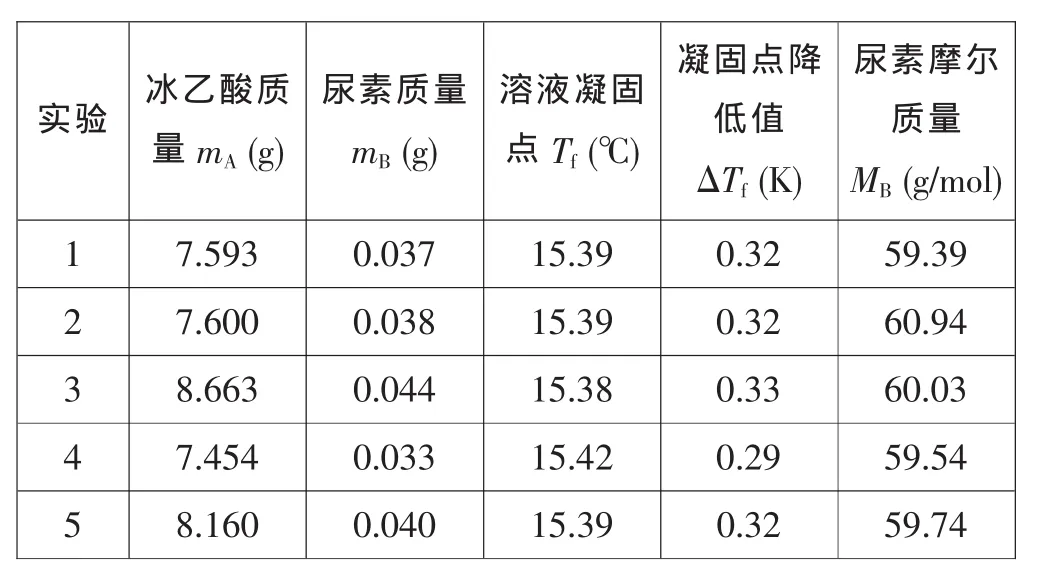
表1 五次实验的实验结果
根据表1中的测量数据可以算出尿素的摩尔质量,其算术平均值为59.93g/mol,实验标准偏差S=0.61g/mol。测量值与理论值(60.06g/mol)的平均误差b=0.13g/mol,相对误差R=0.22%,说明测量结果的准确度较好。
四、实验说明
(1)实验所用试管必须洁净、干燥。
(2)在冷却过程中,使用温度传感器轻轻地充分搅拌,以免把样品溅在试管内壁上。
(3)为了避免冰乙酸的大量挥发,在每次测完冰乙酸的凝固点后,最好都换成新的溶剂,溶入尿素后再测定溶液的凝固点。
(4)根据稀溶液的依数性,溶质加入的量要少;太多则不符合稀溶液的条件,太少凝固点下降不明显。
(5)在冰乙酸-尿素体系中,冰乙酸与尿素发生了缩合反应。在该体系中的溶质即发生了变化,但因反应前后化学计量数相等,且加入尿素的质量符合稀溶液的标准,故消耗的冰乙酸和生成的水对体系的影响,在误差允许的范围内可以忽略不计。且为了降低缩合反应发生的程度,采集数据前对溶液的加热温度不宜过高。

[1] 课程教材研究所等.化学(九年级下册)[M].北京:人民教育出版社,2001:68
[2] 北京师范大学等校.无机化学(第4版)[M].北京:高等教育出版社,2002:302
[3] 夏海涛,许越,滕玉洁.物理化学实验(第1版)[M].哈尔滨:哈尔滨工业大学出版社,2003:37

