GnRH脉冲对体外原代培养大鼠GTH细胞中FSHβ mRNA表达水平的影响
王 新,谭建华,赖小平,万忠海*,韦旭斌
(1.青岛农业大学动物科学技术学院,山东青岛266109;2.广州中医药大学中药学院,广东广州510006;3.解放军军事医学科学院军事兽医研究所,吉林长春130062;4.吉林大学畜牧兽医学院,吉林长春130062)
促性腺激素释放激素(gonadotropin releasing hormone,GnRH)脉冲频率的改变是调节哺乳动物垂体促性腺激素亚单位基因表达的一个重要因素。促卵泡素(follicle stimulating hormone,FSH)和促黄体素(luteinizing hormone,LH)均由两个亚基组成,其中α亚基为两者所共用,β亚基互不相同,决定了两种激素的特异性。因此,要特异性的检测Gn-RH脉冲频率对FSH分泌的影响,应检测FSH的β亚基或编码亚基的mRNA对不同GnRH脉冲频率所做出的不同应答反应。本文试验利用细胞体外培养技术结合荧光定量PCR技术,研究体外培养的大鼠原代垂体细胞在不同脉冲频率GnRH刺激下,定量检测不同脉冲频率和振幅GnRH刺激时细胞内FSHβ mRNA,确认细胞内促性腺激素(gonadotropic hormone;gonadotropin;GTH)亚单位基因表达对不同GnRH脉冲频率所做出的不同应答反应,从分子水平阐述不同脉冲频率GnRH对GT H分泌FSH的影响。
1 材料与方法
1.1 材料
1.1.1 实验动物 4月龄雌性Wistar大鼠,吉林大学基础医学院实验动物中心提供。
1.1.2 主要试剂和仪器 GnRH(Sigma),凝胶回收试剂盒(Axygen),实时荧光定量PCR仪(ABI);RPMI 1640培养基(Gibco);凝胶成像仪(Vilber);生物安全柜(Thermo Forma);CO2培养箱(Kendro)等。
1.2 方法
1.2.1 进行垂体前叶细胞体外原代培养 将大鼠断头,取垂体前叶细胞进行体外原代培养。分离到的垂体细胞,部分用于RNA的提取;部分细胞悬液调整到1×106个/mL,每孔1 mL移入24孔板中,共两个培养板,放入37℃体积分数为5%的CO2培养箱培养。
1.2.2 用不同脉冲频率的GnRH对GT H细胞的刺激试验 将GnRH的浓度定为20 nmol/L,刺激时间为30 min,间隔时间分别为30、60、120、240 min。每3孔为一组,另设3孔为阴性对照组(加无血清培养液),连续刺激24 h,弃培养液,胰酶消化后进行细胞计数,取等量细胞用于总RNA的提取。
1.2.3 荧光定量标准品的制备 用Trizol提取垂体细胞总RNA,测OD值定量RNA浓度。根据GenBank中大鼠的FSH的序列设计的引物,以总RNA逆转录的cDNA作为反应模板进行PCR扩增,得到FSH和LH目的基因。再用PCR产物回收试剂盒回收目的基因片段,并将目的基因片段连接到pMD 19-T Vector上(选取合适比例进行连接反应),利用蓝/白菌落筛选法进行阳性克隆的筛选。采用TaKaRa质粒提取试剂盒提取重组质粒,完成荧光定量标准品的制备。用超纯水将含有特异片段的重组质粒(荧光定量标准品)溶液稀释成每微升含1×1010、1×109、1×108、1×107、1×106、1×105、1×104、1×103个拷贝的阳性质控标准品。置—20℃保存。
1.2.4 荧光定量测定细胞FSHβ的表达量 将标准品设6个水平即1010、109、108、107、106、105copies/μ L,每个水平设2个重复,取GnRH振幅20 nmol/L,刺激频率分别是30、60、120、240 min样品和阴性对照组各1 μ L。设阴性质控(NTC)。将除模板以外的其他组分充分混匀,按不同处理和检样的重复加1管进行第一次分装,再加入模板,充分混匀后分装各管。用荧光定量PCR仪测定细胞FSHβ和LHβ的表达量。
1.2.5 数据处理与统计 采用生物统计软件SPSS12.0对数据进行统计分析,数值用Mean±SD表示。
2 结果
2.1 细胞总RNA的提取与浓度测定
完整的RNA有3条带,根据沉降系数可以分为28、18、5 S。从图1中可以看出,较完整的RNA 28 S的条带最亮,其次是18 S,5 S最模糊。260、280代表RNA溶液在260 nm和280 nm处吸光度,分别反映了RNA溶液的核酸和蛋白质等有机物的吸光度(表1)。OD260/280体现了RNA溶液中的蛋白质等有机物的污染程度,质量较好的RNA OD260/280值应该在1.7~2.0之间。OD260/280<1.7时,说明溶液中的蛋白质等有机物的污染比较明显;OD260/280>2.0时,说明溶液中的RNA已经被水解成了单核苷酸。从图1和表1光密度值结果来看,提取的细胞总RNA没有降解,完全符合反转录要求;OD260/280值介于1.7~2.0之间,达到实验的纯度要求。从图3看,以重组质粒为模板,采用FSHβ-FP和FSHβ-RP、LHβ-FP和LHβ-RP两对引物进行常规PCR鉴定,电泳可见101 bp和124 bp特异条带,与预期的片段大小相符。表明已成功制备阳性质控标准品。
2.2 FSHβ基因的PCR扩增
结果见图1,FSHβ目的基因片段,长度是101 bp(图2)。
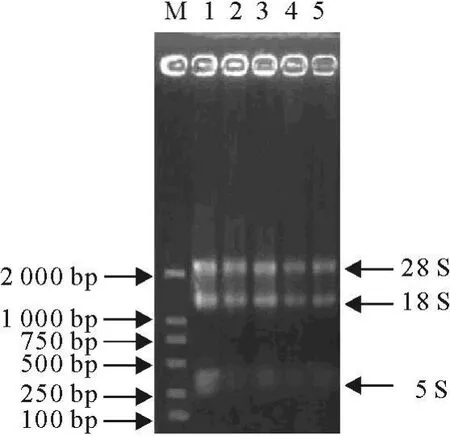
图1 细胞总RNA电泳结果Fig.1 The eletrophoresis result of Total RN A from Cells
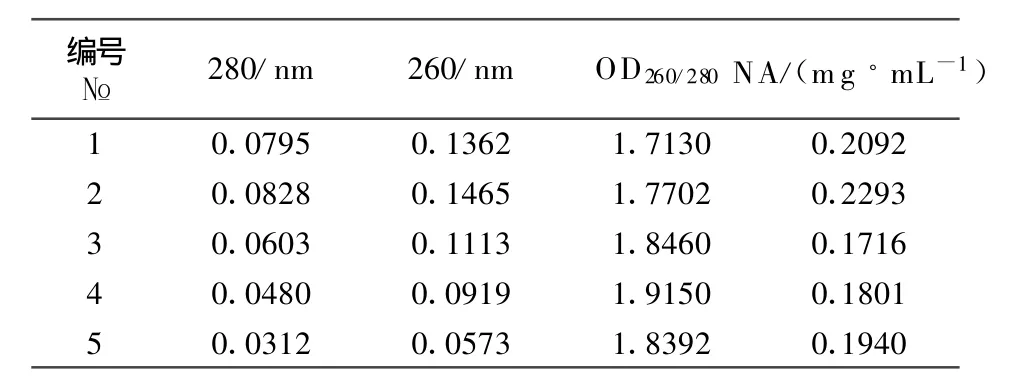
表1 总RNA光密度值及浓度结果T able 1 OD and concentration of total RNA
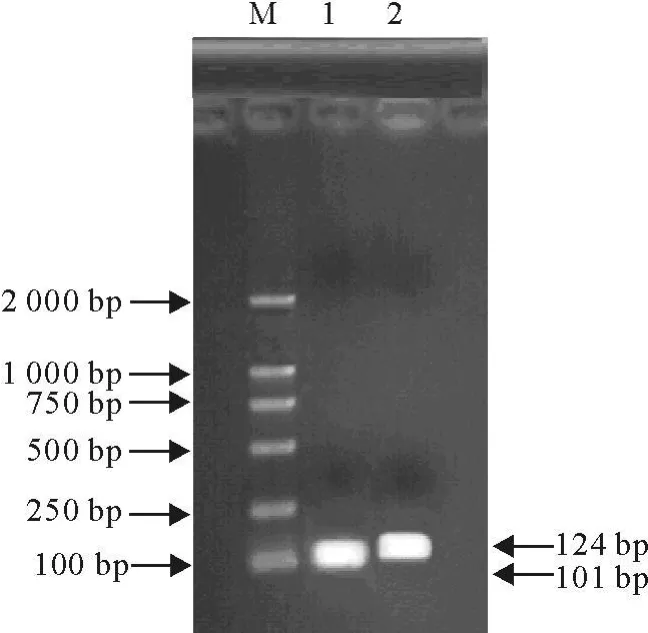
图2 FSHβ和LHβ基因目的片段大小Fig.2 The length of FSHβ gene fragment
2.3 阳性质控标准品重组质粒的PCR鉴定
以重组质粒为模板,采用FSHβ-FP和FSHβ-RP引物进行常规PCR鉴定,电泳可见101 bp特异条带,与预期的片段大小相符(图3)。表明已成功制备阳性质控标准品。
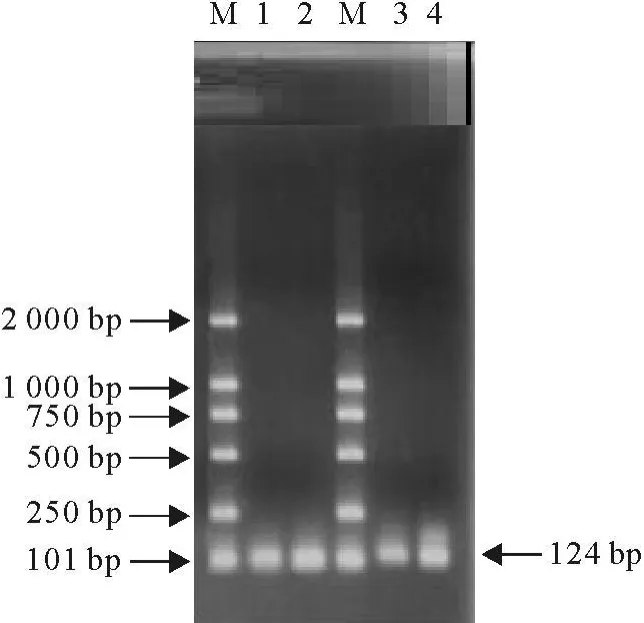
图3 FSHβ和LHβ重组质粒的PCR鉴定结果电泳图Fig.3 Identification of FSHβ and LHβ recombinant plasmid by PCR
2.4 样品FSHβ基因的荧光定量PCR结果
GnRH振幅为20 nmol/L,刺激频率分别为30、60、120、240 min,对细胞中FSHβ基因进行荧光定量PCR,所得检样循环数与荧光强度的关系。每份样品所含的拷贝数都可通过Ct值(荧光定量PCR反应过程中出现荧光信号的初始循环数)与标准曲线比较而得到,荧光定量PCR仪ABI PRISM 7000可通过计算机处理直接给出定量结果。表2表明,当振幅一定、频率为120 min时,FSH β mRNA的Ct值最小,拷贝数Qty最大,也就是说,当振幅一定,频率为120 min时,FSHβ mRNA的表达水平最高。从分子水平解释了为什么在频率为120 min时,最有利于FSH的分泌。以上结果说明,引起FSH表达的最合适GnRH脉冲频率是120 min。

表2 样品中FSHβ的拷贝数Table 2 The number of copies of FSHβ in cells
3 讨论
成年动物的生殖能力主要依赖于下丘脑-垂体-性腺轴的建立和完善,垂体处于轴系的中间环节,分泌的促性腺激素(GTH)是参与生殖的重要激素。促性腺激素细胞分泌的促卵泡素(FSH)和促黄体素(LH)在哺乳动物生殖调控中占据中心地位,它们一方面与性腺内各自受体结合,直接参与性腺功能的调控,另一方面又接受中枢神经系统和内分泌系统的调节。近年来,Burger L L等[1],Shrim A等[2],Reichler I M等[3],Lisowski P等[4],Lopot M等[5],Akhter N等[6]进行了相关研究。GnRH是性腺轴上的最高一环,主要由下丘脑促垂体区(主要是弓状核内)肽能神经元分泌,再由神经突触末端释放进入垂体门脉系统,刺激垂体前叶促性腺激素细胞合成释放FSH和LH。促性腺激素又可以反馈到下丘脑,调节GnRH的分泌。这在指导实践中得到大量应用,如近年来方富贵等[7],宾红等[8],乔跃兵等[9]均有报道。欧阳五庆等[10]研究,下丘脑GnRH脉冲发生器调节GnRH间歇地释放到垂体门脉循环中,进而调节LH和FSH的脉冲式分泌。LH和FSH都是由腺垂体的促性腺激素细胞合成分泌的,在大鼠的发情周期中,LH分泌有明显的规律性。在发情前期,LH的分泌和释放主要受GnRH的调控。FSH和LH的分泌规律是相似的,都是在发情前期有一个分泌高峰,在排卵后分泌较低。一般认为在体内低频低振幅有利于FSH的分泌。体外的情形已有许多报道证实是与体内相似[11-13],我们的研究结果也证实了这一点。
在本试验中,为了摸索FSH应答的最佳GnRH脉冲方式,利用实时荧光定量PCR技术(RT-PCR),研究了相同振幅条件下,4种脉冲频率的GnRH刺激对FSH在mRNA表达水平上的影响。
用PCR对目的基因定量时,首先应考虑的是PCR扩增动力学的有关因素。每一次循环的PCR产物均是下一次循环的底物,模板的扩增呈指数式。随着循环次数的增加,酶活性下降、溶液中反应物的消耗增加,扩增不再呈指数式进行,导致扩增产物的累积处于平台期。在平台期低水平表达的目的RNA可能会增加到与高水平表达目的RNA相同的浓度。因此定量时要保证循环次数在指数期内,才能保证PCR产物与模板量呈线性关系。本试验选择了处于指数期内的45个循环为本试验检测FSH和LH的扩增循环数,保证了PCR产物与模板量线性关系及结果的准确性。
GnRH脉冲频率本身就是一个调控信号,不同脉冲频率GnRH对FSH表达有着明显不同的影响,在相同振幅条件下,低频脉冲刺激(120 min间隔)时,FSHβ mRNA表达水平达到高峰,从分子水平阐述低频GnRH脉冲刺激时FSH的分泌达到高峰的机理,支持了GnRH脉冲频率本身就是一个调控信号的假说。
[1] Burger L L,Haiseuleder D J,Wotton G M,et al.The regulation of FSH beta transcription by gonadal steroids:testosterone and estradiol modulation of the activin intracellular signaling pathway[J].Am J Physiol Endocfinol Metab,2007,293(1):E277-285.
[2] Shrim A,Elizur S E,Seidman D S,et al.Elevated day 3 FSH/LH ratio due to low LH concentrations predicts reduced ovarian response[J].Reprod Biomed Online,2006,2:418-422.
[3] Reichler I M,Welle M,Sattlcr U,et al.Comparative quantitative assessment of GnRH-and LH-receptor mRNA expression in the urinary tract of sexually intact and spayed female dogs[J].T heriogenology,2007;67(6):1134-1142.
[4] Lisowski P,Robakowska-Hyzorek D,Blitek A,et al.Development of realtime PCR assays in the study of gonadotropin subunits,follistatin and prolactingenes expression in the porcine anterior pituitary during the preovulatory perled[J].Neuro Endocrinol Lett,2008,29(6):958-964.
[5] Lopot M,Ciechanowska M,Malewski T,et al.Changes in the G nRH mRNA and GnRH receptor(GnRH-R)mRNA levels in the hypothalamic-anterior pituitary unit ofan estreus ewes afterinfusion of GnRH intothethirdcerebral ventricle[J].Reprod Biol,2008,8(2):149-161.
[6] A khter N,Johnson B W,Crane C,et al.Anterior pituitary leptin expression changes in different reproductive states:in vitro stimulation by gonadotropin-releasing hormone[J].J Histochem Cytochem,2007,55(2):151-66.
[7] 方富贵,蒲 勇,王索路,等.重组GnRH主动免疫公猪的效果及对垂体GnRH受体、FSHβ和LHβ基因表达的影响[J].中国免疫学杂志,2009,25(9):824-827.
[8] 宾 红,贾 晶,邱玉莹.促性腺素释放素拮抗剂在体外受精-胚胎移植中的LH峰抑制[J].生殖与避孕,2008,28(7):432-435.
[9] 乔跃兵,马秀艳,崔慧先.瘦素与生殖[J].生殖与避孕,2008,28(5):312-317.
[10] 欧阳五庆,王秋芳.与GnRH分泌相关的电生理变化[J].动物医学进展,1997,18(2):14-18.
[11] Goodyer C G,Hall C S,Guyda H,et al.Human fetal pituitary in culture:hormone secretion and response to somatostatin,luteinizing hormone releasing factor,thyrotropin releasing factor and dibutyryl cyclic AM P[J].J Clin Endocrinol Metab,1977,45(1):73.
[12] 谢衷明,毛全福,徐美红,等.雌性大鼠离体垂体前叶内在促黄体生成激素释放节律性现象[J].生理学报,1997,49(6):649-656.
[13] Kaiser U,Jakubowiak A,Steinberger A,et al.Differential effects of gonadotropin-releasing hormone(GnRH pulse frequency on gonadotropin subunit and GnRH receptor messenger ribonucleic acid levelsin vitro[J].Endocrinology,1997,138(3):1224-1230.

