鸡传染性贫血病毒广西株全基因组的克隆与序列分析*
邓显文,谢芝勋,谢丽基,刘加波,谢志勤,庞耀珊
(广西兽医研究所,广西南宁530001)
鸡传染性贫血(Chicken infectious anemia,CIA)是由鸡传染性贫血病毒(CIAV)引起的,可引起3周龄以内的鸡严重贫血、出血,骨髓和淋巴器官严重萎缩[1]。随着鸡年龄增长对CIAV的抵抗力增强,成年鸡感染后不出现任何临床症状,但种鸡可将CIAV垂直传播给其子代,引起子代发生传染性贫血;临床上CIAV感染鸡群常伴发或继发其他疾病,甚至引起疫苗免疫失败等。近几年的流行病学调查表明,CAIV在我国鸡群中的感染非常普遍,感染率高达40%~96%[2-3],导致了巨大经济损失。
CAIV可在鸡群中长期存在,引起免疫抑制,常导致疫苗免疫失败,加大了对该病预防和控制的困难。为了解CIAV广西野毒株的变异情况,本研究对1株广西分离株进行全基因扩增、克隆及测序,并与国内外已发表的31株CIAV全基因核苷酸序列及其推导的氨基酸序列进行比较分析,为广西CIAV的研究奠定基础。
1 材料与方法
1.1 材料
1.1.1 样品来源与处理 CIAV(GXC060821)株由广西兽医研究所分离自某公司38日龄的三黄鸡。免疫接种新城疫疫苗7 d后发病,鸡群羽毛粗乱,精神沉郁,鸡冠、肉垂略显苍白,而死亡鸡的小腿骨骨髓呈淡黄色。无菌操作取死亡鸡的胸腺、骨髓、肝、脾等组织,置—30℃保存备用。
1.1.2 试剂与仪器 大肠埃希菌DH5α由广西兽医研究所兽医分子生物技术实验室保存;克隆载体pMD18-T PCR试剂盒为宝生物工程(大连)有限公司产品;LB培养基和凝胶回收试剂盒为GIBCO公司产品;氨苄青霉素为Promega公司产品;100 bp DNA ladder为北京天为时代科技有限公司产品;PCR仪为美国Perkin Elmer Cetus公司生产的PE9600型。
1.2 方法
1.2.1 样品处理 无菌采取2 g可疑传染性贫血病待检鸡的胸腺、骨髓、肝、脾等组织,置于乳钵或玻璃研磨器中,加入无菌的PBS充分研磨,收集组织悬液于1.5 mL离心管,冻溶3次,以2 500 r/min离心5 min,收集上清液650 μ L,供CIAV总DNA抽提。
1.2.2 病毒分离鉴定 将经参考谢芝勋建立的CIAV-PCR检测方法进行鉴定[4]为阳性的病鸡骨髓悬液,分别用氯仿和乙醚处理,除去可能存在的其他囊膜病毒后卵黄囊接种7日龄SPF鸡胚,取部分刚出壳雏鸡的骨髓和脾脏的悬液作为种毒[5]置—70℃保存备用,另取适量冻溶3次后取上清供CIAV总DNA抽提,用PCR检测证实含有CIAV。
1.2.3 核酸抽提 参照酚:氯仿法抽提其DNA[4、6],保存于—20℃备用。
1.2.4 PCR扩增 根据已发表的CIAV基因(No.AF311900),设计3对PCR引物(表1)。引物由宝生物工程(大连)有限公司合成,用TE buffer配成适当浓度,贮存于—20℃备用。PCR反应体系100 μ L:3 μ L 8 mmol/L MgCl2,4 μ L 2.5 mmol/L dNTP,10 μ L 10×PCR缓冲液,300 ng上游引物和下游引物,0.5 μ L(2.5 U)Taq DNA聚合酶,DNA模板4 μ L,用灭菌ddH2O加至总体积为100 μ L。首先94℃5 min;然后94℃1 min,57.5℃退火1 min,72℃1 min的循环,循环35次;最后72℃10 min结束,4℃终止反应。

表1 引物设计Table 1 Primer design
1.2.5 基因的克隆 用凝胶回收试剂盒回收纯化PCR产物。取适量纯化回收的PCR产物与pMD18-T载体于16℃连接过夜,转化DH5α大肠埃希菌。挑取在含氨苄青霉素的选择培养基上长出的白色菌落,37℃培养,用碱裂解法抽提质粒进行PCR快速鉴定[6],阳性克隆菌送大连宝生生物技术有限公司进行测序。
1.2.6 序列分析 用DNA Star软件将CIAV广西株全基因组与其它全基因序列进行同源性比较。同时对广西分离株基因序列推导的氨基酸序列进行分析。
2 结果
2.1 PCR扩增
用CIAV广西分离株抽提的DNA为模板,引物XZCIAV21、XZCIAV22可扩增出约931 bp的片段,引物XZCIAV23、XZCIAV24可扩增出约870 bp的片段,引物XZCIAV15、XZCIAV16可扩增出约1 091 bp的片段,扩增产物大小与预期结果相符(图1)。
2.2 克隆与鉴定
CIAV广西株的PCR纯化产物与pMD-18T载体连接后,转化到DH5α大肠埃希菌,经过PCR快速鉴定及测序结果表明,克隆的阳性重组质粒均带有相应菌株的基因。
2.3 同源性比较
将CIAV广西株的核苷酸序列和推导的氨基酸序列与基因文库中America(L14767)[7],Australia(U65414,Unpublished),Gemany(M 81223)[8],Japan(E51057,Unpublished)、Malaysia(AY040632)[9]、Tianjin(AY846844,Unpublished)、ChimrHarbin(AF475908)[10],Taian(EF176599)[11]等31株CIAV全基因序列进行同源性比较,结果显示,核苷酸同源性为96.1%~98.5%;氨基酸的同源性为89.8%~94.2%,也具有较高的同源性。
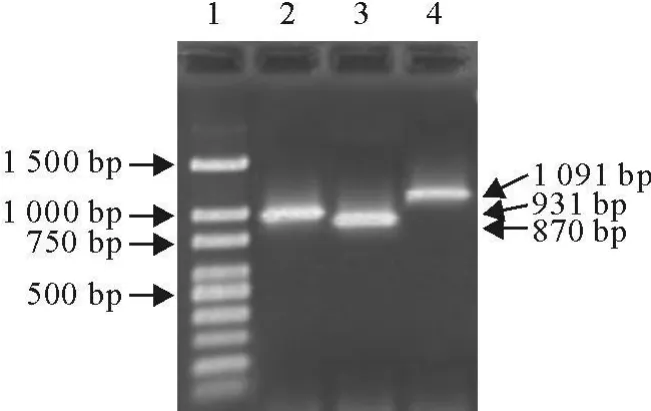
图1 鸡传染性贫血病毒PCR产物电泳图Fig.1 Electrophoresis of PCR products of CIAV
2.4 基因遗传进化树
为分析广西分离株与其他毒株在遗传进化关系上的距离,把广西分离株与国内外31株CIAV毒株一起构建遗传进化树(图2)。广西分离株与中国的TJBD40株(NO.AY846844)、LF4株(NO.AY839944)的亲缘关系较近,而与美国的98D06073分离株(NO.AF311900)及中国的HA4分离株(NO.DQ124934)的亲缘关系较远。
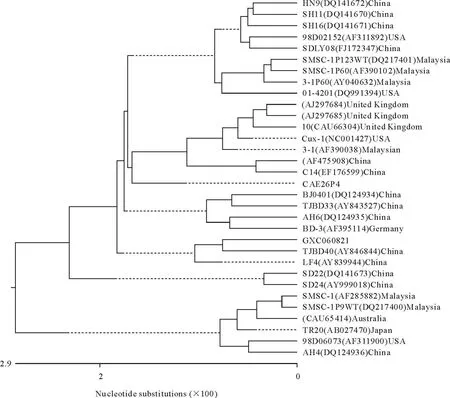
图2 GXC060821毒株全基因遗传进化树Fig.2 Phylogenetic tree of gene of GXC060821 strains
3 讨论
CIAV属于圆环病毒科(Circoviridae),为无囊膜的20面体的小病毒,直径只有20 nm左右;CIAV的基因组是一条只有2.3 kb单股环状DNA[1],只产生一个转录子,可编码3个蛋白质,即衣壳蛋白VP1及其相关蛋白VP2,细胞凋亡因子VP3[12]。CIAV的致病性在于通过CAIV编码产生的细胞凋亡基因造成的细胞程序性死亡[5],主要是造血细胞和淋巴细胞的程序性死亡,进而造成感染鸡的贫血,出血及免疫抑制;何成强等[10]和李延鹏等[5]己报道对几株CAV野毒株完成了全基因组序列的测定,但末见广西CAIV野毒株全基因组序列的测定的报道,为了解广西野毒株的变异情况,我们利用PCR技术对1株广西分离株进行全基因扩增、克隆及测序,并进行比较分析,为鸡场防控和净化该病提供技术支持。
利用PCR方法扩增出GXC060821分离株基因组内的3条片段。将各段PCR产物分别克隆于T载体中并测序,拼接获得GXC200601分离株的全基因序列。分析表明GXC060821分离株CAV基因组全长2 292 bp,含有3个互相重叠的开放阅读框,分别编码VP1(1 350 bp)VP2(651 bp)和VP3(366 bp)。我们比较了广西分离株病毒与基因文库中31株VP1,VP2和VP3基因所编码的氨基酸序列,结果发现,广西分离株与基因文库中31株VP1、VP2、VP3基因核苷酸同源性分别为94.4%~98.6%、98.6%~99.5%、98.6%~99.7%,氨基酸的同源性为96.7%~99.6%、96.8%~98.6%、96.7%~99.2%。广西分离株VP2氨基酸序列和中国的AH4、SD24、TJBD40、SH11等10株只有1个氨基酸差异,与美国的Cux-1株只有2个氨基酸差异;广西分离株VP3氨基酸序列和中国的HN9、SD24、TJBD40、SH11等10株、美国的98D06073等国外5株没有差异,与美国的Cux-1株只有2个氨基酸差异;广西分离株VP1氨基酸序列和中国的TJBD40株只有1个氨基酸差异,SH16有2个氨基酸差异、TJBD33、SD22、HN9有3个氨基酸差异,与其他参考株的氨基酸差异比较大,这是因为VP1是CAV的衣壳蛋白组成成分,也是抗原蛋白基因,它的变异可能与宿主免疫反应的选择压有关。
CAIV全基因序列同源性比较结果表明,广西分离株与基因文库中31株全基因核苷酸同源性为96.1%~98.5%;氨基酸的同源性为89.8%~94.2%,也具有很高的同源性。系统发育进化树分析显示,广西分离株和中国天津TJBD40株、LF4株都处于一个分支,它们的亲缘关系较近,而与美国的98D06073分离株及中国天津的HA4分离株的亲缘关系较远。
综上分析可知,CIAV广西分离株与国内的TJBD40、SH16、TJBD33、SD22、HN9等参考株比较,氨基酸序列没有引起大的变异,只是VP1的氨基酸差异比较大些,但这些氨基酸差异并没有引起质的变异,这些分析结果为广西鸡传染性贫血灭活苗的研制及基因工程亚单位疫苗的研究奠定基础。
[1] 卡尔尼克B W.禽病学[M].高 福,苏敬良,译.10版.北京:中国农业大学出版社,1999:938-962.
[2] 欧阳文军,秦卓明,周京昌.鸡传染性贫血病研究进展[J].家禽科学,2005,8:44-47.
[3] 周方红,陈奖励,尹训南,等.鸡传染性贫血病毒的分离鉴定[J].中国兽医科技,1998,28(2):6-8.
[4] Xie Z X,Fadl A A,Theodore G.Detection of avian adenovirus by polymerase chain reaction[J].Avian Dis,1999,43(1):98-105.
[5] 李延鹏,崔治中.一株鸡传染性贫血病毒野毒株致病性及其全基因组序列比较[J].微生物学报,2007,27(50):894-898.
[6] 萨姆布鲁克J,弗里奇E F,曼尼阿蒂斯T.分子克隆实验指导[M].金冬雁,黎孟枫,等,译.2版.北京:科学出版社,1993:956.
[7] Renshaw R W,Soine C,Weinkle T,et al.A hypervariable region in VP1 of chicken infectious anemia virusmediatesrate of spread and cell tropism in tissue culture[J].J Virol,1996,70(12):8872-8878.
[8] M eehan B M,Todd D,Creelan J L,et al.Characterization of viral DNAs from cells infected with chicken anaemia agent:Sequence analysis of the cloned replicative form and transfection capabilities of cloned genome fragments[J].Arch Virol,1992,124:301-319.
[9] Chowdhury S M,Omar A R,Aini I,et al.sequence and phylogenetic analysis of Malay sian Chicken anaemia virus obtained after low and high passages in MSB-1 cells[J].Arch Virol,2003,148(12):2437-2448.
[10] 何成强,丁乃峥,李只鹏,等.鸡贫血病毒哈尔滨分离株全基因克隆和序列分析[J].微生物学报,2002,42(4):436-441.
[11] Phenix K V,Meehan B M,Todd D,et al.Transcriptional analysis and genome expression of chicken anaemia virus[J].J Gen Virol,1994,75:905-909.
[12] Noteborn M H M,Koch G.Chicken anaemia virus infection:molecular basis of pathogenicity(review)[J].Avian Pathol,1995,24:11-31.

