螺旋CT后处理技术在主动脉壁内血肿诊断中的应用
谢品超, 叶文钦, 文康彦, 练旭辉, 聂悦富, 梁权海, 陈 忠
(南方医科大学附属新会医院放射科, 广东 江门 529100)
主动脉壁内血肿(aortic intramural hematoma,AIH)是指没有内膜撕裂口的主动脉夹层,也称不典型主动脉夹层,可自行吸收或继续发展成为典型主动脉夹层,被认为是一种变异的主动脉夹层及主动脉夹层的早期阶段,与典型主动脉夹层相似,也有很高的危险性和致死率[1]。AIH临床诊断率低,患者常得不到及时、正确治疗而死亡,而AIH诊断主要依靠影像学检查。搜集我院2007年至2010年12例AIH资料,回顾性分析AIH螺旋CT表现及探讨螺旋CT图像后处理技术在AIH诊断的价值。
1 资料与方法
1.1 临床资料:搜集我院2007年1月至2010年12月螺旋CT诊断为AIH患者12例,男9例,女3例,年龄59-78岁,平均年龄67岁。12例患者均出现胸背痛,发病急骤,呈撕裂样或刀刺样痛,其中3例伴有腹部疼痛。12例中有高血压病史10例,3例合并冠心病,1例合并糖尿病,2例有脑出血病史。
1.2 检查方法:所有病例采用Philips Ultra Z螺旋CT机扫描,扫描条件为120kv,220-250mA,平扫层厚为8-10mm,增强扫描层厚为4mm或3mm,螺距1.5容积扫描。扫描范围从胸廓入口至髂动脉分叉水平。造影剂用碘海醇(300mg I/mL),采用Medrad vi-stronct高压注射器,注射速率为3.0-3.5mL/s,经肘正中静脉或手背静脉注入,造影剂总量为100-150mL。延迟20-25s后开始扫描。增强扫描后获取轴位图像减薄至1.5mm层厚传至 Mxview图像工作站,分别进行MPR、MIP和SSD重建。所有病例经3名主治职称以上医师阅片,分析AIH螺旋CT表现及CT图像后处理方法应用。
2 结果
12例AIH参照Stanford分型,A型3例,B型9例。12例平扫均见主动脉壁呈新月状或环状增厚,呈高密度,增强扫描相应高密度未见强化(如图1、2),未见内膜片撕裂形成典型主动脉夹层的“双腔”改变,主动脉壁增厚大于5mm,内膜钙化内移(如图1)4例,5例合并心包积液或胸腔积液,左侧胸腔积液程度较右侧明显,3例合并穿透性粥样硬化性主动脉溃疡,溃疡边缘规则或不规则,周围有明显的钙化灶。2例显示主动脉弓部内壁欠光整,可见针尖状龛影。MPR可以明确显示AIH的范围,有无合并穿透性粥样硬化性主动脉溃疡(如图3),有无胸积液或心包积液情况。MIP可显示AIH及溃疡的整体形态及分支血管形态。SSD对AIH范围不能显示(如图4),对较小的溃疡显示不清,对胸积液和心包积液不能显示。经心血管内科保守治疗后半年至1年复查,2例明显吸收,3例轻度吸收,3例无明显变化,4例未能随访。

图1 平扫主动脉壁呈新月状增厚,呈稍高密度,内膜钙化内移(箭头)
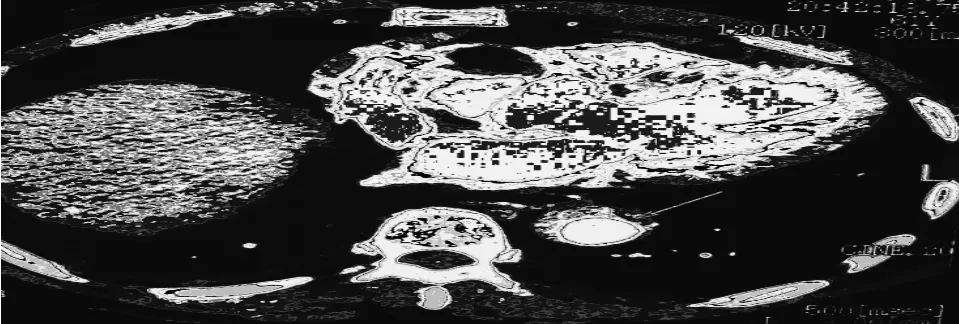
图2 增强扫描增厚主动脉壁未见强化(箭头),未见双腔征和撕裂内膜片

图3 MPR显示AIH部位、范围及溃疡(箭头)

图4 SSD未能显示AIH
3 讨论
主动脉壁内血肿为主动脉壁内滋养血管的破裂导致血液进入动脉内外膜之间,而没有内膜撕裂的主动脉病变[2]。有学者认为壁内血肿与主动脉溃疡有关,是动脉硬化斑块的溃疡穿过主动脉壁的内弹力层并在主动脉中膜内形成壁内血肿的一种病变[3]。AIH的病因和发病机制目前尚不明确,一般认为与高血压和主动脉硬化有关。在主动脉硬化斑块的侵蚀,主动脉硬化溃疡形成或者主动脉中层弹力纤维及平滑肌细胞退行性改变的基础上,由于高血压等促发因素的存在,主动脉滋养管破裂、穿透性粥样硬化性主动脉溃疡造成血液渗入主动脉壁中层形成壁内血肿。医源性或创伤性也可引起AIH。本组12例AIH均有不同程度主动脉硬化改变,其中10例有明确高血压病史,3例有穿透性溃疡。2例在主动脉弓部显示欠光整,并见针尖样小龛影,其病理改变可能是血管内膜损伤,在内膜片上形成一个或多个小的破裂口,增强扫描主动脉真腔内含碘造影剂的血液进入小的破裂口而形成较小的针尖样龛影。因此,AIH很可能是血液通过内膜微小的破裂口进入内外膜之间形成。往往由于设备空间分辨率不足或/和内膜撕裂口太小而未能将撕裂口显示出来。
螺旋CT表现和CT后处理技术应用:①主动脉壁呈新月状或环状增厚,这是诊断AIH最重要征象之一。本组12例患者均有此征象。增厚的主动脉壁为壁内血肿,其密度视血肿形成时间长短有所不同,急性期表现为高密度,亚急性期为等密度或稍高密度,慢性期为低密度或等密度。大部分患者起病急,均为急性期,平扫表现为高密度,增强扫描未见强化。本组8例半年至1年复查,2例表现为等密度,平扫未能显示,6例表现为低密度。②内膜钙化内移,本组有4例出现此征象。由于壁内血肿存在推压钙化内膜而出现此征象。③穿透性粥样硬化性主动脉溃疡,增强扫描表现为向主动脉腔外突出的龛影,边缘规则或不规则,周围主动脉壁有明显钙化灶。本组3例有穿透性粥样硬化性主动脉溃疡表现。溃疡性AIH可进一步发展成为典型主动脉夹层、动脉瘤甚至主动脉破裂。④主动脉壁小点状强化,增强扫描表现为壁内血肿邻近内壁见小点状强化灶,本组有2例出现此征象。其病理改变可能是血管内膜损伤,在内膜片上形成较小的破裂口。⑤胸腔积液和心包积液,本组5例合并心包积液和胸腔积液,左侧胸腔积液程度较右侧明显。⑥螺旋CT后处理技术包括MPR、MIP、SSD等,MPR可获得任意层面的横断面、冠状面、矢状面和斜冠状面图像,可清楚显示AIH的位置、范围及穿透性粥样硬化性主动脉溃疡和胸腔积液、心包积液等合并症。从多角度观察溃疡的情况,使弯曲的主动脉显示在同一个平面上,更直观显示主动脉管壁情况,能将较小的溃疡显示出来,能清楚显示主动脉分支是否受累。本组12例MPR所获得的图像均能显示AIH的位置、范围及溃疡、胸腔积液和心包积液等情况。MIP可得到类似血管造影的图像,可显示溃疡的位置和形态,显示壁内血肿的位置和范围不如MPR,但心包积液、胸腔积液和较小的溃疡不能显示。SSD由于受到CT阈值选择的影响较大,容积资料丢失较多,对壁内血肿和心包积液、胸腔积液均不能显示,对较小的溃疡显示阳性率也较低。本组资料MPR对AIH的位置、范围和并发症显示为100%,优于MIP和SSD,故认为MPR作为AIH后处理技术首选。
螺旋CT与其它影像学检查比较:AIH临床表现缺乏特异性,其诊断主要依靠影像学检查,目前的检查方法有CT、MR、DSA及血管内超声。MRA对壁内血肿的慢血流及流空有一定价值,但检查时间长,狭窄所致涡流引起的信号丢失夸大狭窄程度,胸腹部的呼吸、心跳及肠蠕动等可能影响图像清晰度,不能显示血管壁钙化,金属植入物会影响MR检查[5]。血管内超声和DSA对于溃疡和破裂口的确定、判断分支血管受累准确度非常高,对壁内血肿帮助不大,且价格昂贵,为有创性检查。而螺旋CT成像速度快,而且为无创性检查,能准确显示AIH部位、范围和并发症。
[1] Nienaber CA,Sievers HH.Intramural hematoma in acute aortic syndromemore than one variantof dissection[J].Circulation,2002,106(3):284 -285.
[2] Krukenburg E.Baitrage Zur Frage Des Aneurysma Disscans[J].Beitr Pathol Anat Allg Pathol,1920,67(2):329 -335.
[3] 李子川,黄连军,杨剑,等.主动脉壁内血肿的影像学诊断[J].临床放射学杂志,2004,23(1):49 -52.
[4] 董海波,李晖,王波,等.主动脉壁内血肿的16层CT诊断[J].放射学实践,2009,24(11):1199 -1202.
[5] 徐光明,刘斌,吴兴旺,等.64层螺旋CT血管成像技术对主动脉夹层动脉瘤的诊断价值[J].医学影像学杂志,2007,17(1):14 -18.

