简青霉对酚类和苯胺类污染物的降解研究*
胡天觉,吴娟娟,曾光明,刘 晖,张 滢,黄丹莲,余 冰,沈莹
(1.湖南大学环境科学与工程学院,湖南长沙 410082;
2.湖南大学环境生物与控制教育部重点实验室,湖南长沙 410082)
简青霉对酚类和苯胺类污染物的降解研究*
胡天觉†,吴娟娟,曾光明,刘 晖,张 滢,黄丹莲,余 冰,沈莹
(1.湖南大学环境科学与工程学院,湖南长沙 410082;
2.湖南大学环境生物与控制教育部重点实验室,湖南长沙 410082)
在培养4 d的简青霉培养体系中,分别加入不同浓度的酚类和苯胺类物质,观察这些有毒物质对简青霉生长的影响,并研究简青霉对这几种有毒物质的降解效果.结果表明:低浓度的酚类和苯胺类物质能促进简青霉的生长,高浓度的这些物质则对简青霉的生长有一定的抑制作用.同时简青霉能够很好地催化氧化苯酚,2,4-二氯苯酚和苯胺.当苯酚质量浓度为500μg/ m L,2,4-二氯苯酚质量浓度为50μg/m L,苯胺的质量浓度为1 000μg/m L时,简青霉对这三者的降解率都接近100%.在2,4-二氯苯酚质量浓度为60~125μg/m L,苯胺质量浓度为2 000~5 000 μg/m L时,简青霉对它们的降解率分别达到60%和70%以上.简青霉对对硝基苯酚和对硝基苯胺降解效果不明显,在研究的浓度范围内,简青霉对它们的降解率只在10%左右.
苯胺类化合物;简青霉;酚类化合物;生物降解
酚类化合物主要来源于煤气厂、石油化工厂和制药厂等,是重要的化工原料和中间体[1].苯胺类物质是制药、杀虫剂、除草剂和染料等工业制备中重要的化工原料[2].由于它们对生物有机体的毒性作用,以及大多数难以生物降解,已被美国EPA列为优先控制的污染物,在我国也被列为“水中优先控制污染物”[2-3].
目前酚类和苯胺类化合物的降解方法主要有物理法、化学法和生物法.与物理法和化学法相比,生物法具有成本低,效率高,反应条件温和以及无2次污染等优点.目前,在对微生物降解酚类和苯胺类化合物的研究中,大多数为细菌降解,如:恶臭假单胞菌、产碱杆菌、不动杆菌和红球菌降解等[4-5].而细菌的生长容易受有机物浓度,废水的pH值等因素的影响,尤其对重金属很敏感.与细菌相比,真菌对有毒污染物具有较强的忍耐性和解毒作用.在酚类和苯胺类的污染中常伴随着其它各种有害物质的污染,因此利用真菌处理含酚废水和含苯胺类废水具有很大的应用潜力.
本文研究简青霉真菌对酚类和苯胺类污染物的降解,为难降解有机物的生物降解提供研究基础.
1 材料与方法
1.1 仪器设备
无菌操作室,高压蒸汽灭菌锅,恒温振荡培养箱,浊度仪,离心机,UV-2550紫外分光光度计.
1.2 菌种和培养基
简青霉由湖南大学环境科学与工程学院863课题研究组提供.
固体培养基(PDA培养基):葡萄糖20 g,琼脂15 g,去皮土豆200 g,蒸馏水1 000 m L.
液体培养基:葡萄糖10 g,NH4 Cl2.0 g,MgSO4◦7H2O 0.5 g,KH2PO41.0 g,Na2HPO4◦12H2O 0.504 g,MnSO4◦H2O 0.039 g,CuSO4◦5H2O 0.007 g,FeSO4◦7H2O 0.007 g,蒸馏水1 000m L.
1.3 降解体系的建立
250 m L的锥形瓶中装入100m L的液体培养基(即100/250m L的培养体系),在灭菌后的培养体系中无菌接入107个/m L的孢子悬浮液2 m L,于30℃,140 r/min的恒温振荡培养箱中振荡培养.4 d后在培养体系中分别加入不同浓度酚类和苯胺类物质,继续振荡培养.每组实验均做3个平行样.有机物浓度的选择根据文献[6-10]确定.
1.4 降解率的测定
在振荡培养4 d后的100/250 m L的培养体系中分别加入不同浓度酚类和苯胺类物质,以未加这些物质的培养体系为对照样,取适量菌液,6 000 r/m in离心15m in,过滤,取上清液,测初始浓度.继续培养,同样方法分别测7 d后和10 d后的有机物浓度.最后结果用对照样的菌液吸光度加以校正,计算降解率.
酚类化合物采用4-氨基氨替比啉法测定,苯胺类化合物采用萘乙二胺偶氮光度法测定[11].
1.5 漆酶活性测定
以ABTS为底物,反应总体积为3 m L.取2.0 m L 0.1 mol/L的柠檬酸-柠檬酸钠缓冲液(pH= 5.0),加入0.5 m L 5 mmol/L的ABTS和0.5 m L的粗酶液,混合于30℃水浴中反应3 min,迅速测定OD420值.每个样品重复做3次,相对标准偏差小于5%.对照组以同等体积的缓冲液代替粗酶液.酶活力单位(U)为:每分钟催化1 m ol ABTS氧化所需的酶量.
粗酶液的制取:取一定量培养液,6 000 r/min离心15 min,再经过孔径为0.22 m的滤膜过滤.
2 结果与分析
2.1 酚类和苯胺类物质对简青霉生长的影响
2.1.1 酚类和苯胺类物质对简青霉形态的影响
在振荡培养条件下,简青霉呈球状生长,培养2 d后,菌球较小,4 d后菌球的直径为3~4mm,生长较均匀,菌液呈微红色.继续培养,10 d后菌球的直径为5mm,并且菌球表面产生倒刺,如图1所示.

图1 对照样的简青霉形态Fig.1 Themorphology of Penicillium sim p licissimum cu ltured w ithout adding toxic substances
加入苯胺和对硝基苯胺后,菌液体系的颜色分别如图2和图3所示.在苯胺质量浓度为4 000和5 000μg/m L时,菌液呈褐色,且后者比前者的菌液颜色更深,其它浓度的菌液呈土黄色.当加入不同浓度对硝基苯胺时,各浓度体系中均有少量的黄色絮状沉淀.继续培养,沉淀溶解,菌液颜色呈黄色,对硝基苯胺的浓度越高,菌液的颜色越深,且菌球也呈黄色,这是因为菌球对对硝基苯胺有一定的吸附作用.加入苯酚、对硝基苯酚、2,4-二氯苯酚后菌液的颜色还是呈微红色,与对照样相比,未发现有明显的变化.
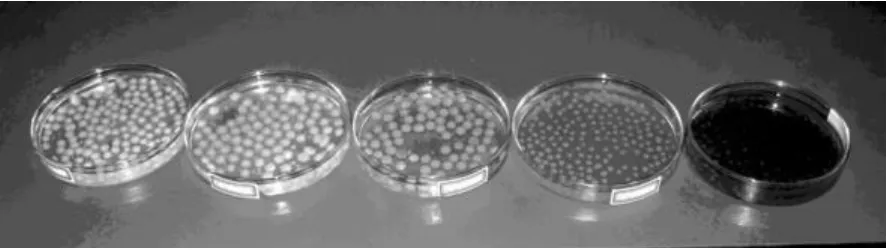
图2 苯胺质量浓度依次为1 000,2 000,3 000, 4 000和5 000μg/m L条件下培养的简青霉形态Fig.2 Themorphology of Penicillium simp licissimum cu ltured w ith aniline at the concentration o f 1 000, 2 000,3 000,4 000,5 000μg/m L respectively

图3 对硝基苯胺质量浓度依次为50,100, 150和200μg/m L条件下培养的简青霉形态Fig.3 Themorphology of Penicil lium simp licissimum cu ltured with p-nitroanilineat the concentration of 50,100,150,200μg/m L respectively
2.1.2 酚类和苯胺类物质对菌球直径的影响
培养10 d后的降解体系,在不同浓度酚类和苯胺类物质作用下简青霉的菌球直径如表1所示.

表1 不同浓度酚类和苯胺类物质作用下简青霉菌球直径Tab.1 The sphere diameter of Penicillium simp licissimum under different concentration of phenols and anilines
低浓度的有机物对简青霉的生长影响不大,与对照样中的菌球直径相比,没有明显变化,菌球直径都在5mm左右.有机物对简青霉的毒性作用随着有机物本身浓度的增加而增大,菌球直径则随有机物浓度的增加而减小.简青霉在高浓度有机物作用下,菌球直径是3~4 mm,当苯胺的质量浓度为4 000,5 000μg/m L时,简青霉的菌球直径最小,为2~3 mm.
2.1.3 酚类和苯胺类物质对简青霉生物量的影响
培养10 d后的降解体系经6 000 r/min的离心机离心15m in后,过滤,菌体烘干至恒重,称重,测量不同浓度酚类和苯胺类物质作用下简青霉的生物量.
由表2可以看出,与对照样中的简青霉生物量相比,在低浓度有机物的作用下,简青霉的生物量有一定的增加,当有机物的浓度逐渐增大时,简青霉的生物量则明显减少.
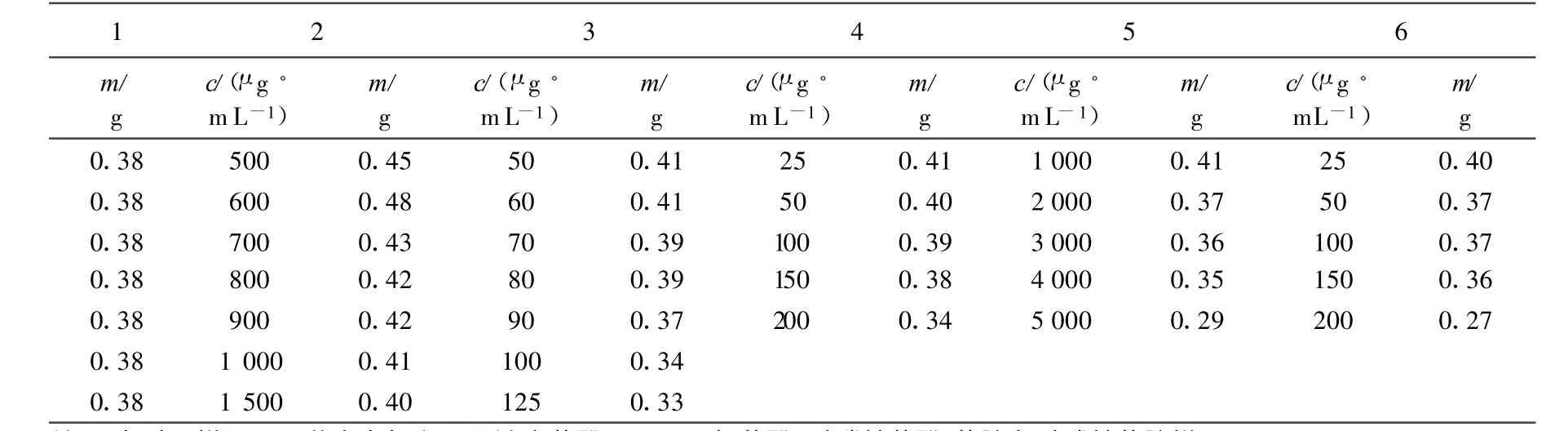
表2 不同浓度酚类和苯胺类物质作用下简青霉生物量Tab.2 The biomass of Penicillium sim plicissimum under different concentration of phenols and anilines
2.2 液体培养条件下简青霉的漆酶活性
在培养4 d后的体系中,分别加入苯酚、对硝基苯酚、2,4-二氯苯酚、苯胺和对硝基苯胺,使它们在菌液体系中的质量浓度分别为500,50,25,1 000和25μg/m L,每天取样测酶活性,对照样则在培养开始时每天取样测酶活性.液体培养条件下的漆酶活性随时间的变化如图4所示.

图4 液体培养条件下简青霉漆酶活性Fig.4 Laccase activities o f Penicillium sim p licissimum in liquid cu ltivation
在培养的初始阶段,漆酶的活性很低,几乎接近零.随着时间的增加,酶活性缓慢上升.在培养4~7 d时,酶活性明显增加,且变化率要大于培养8~10 d时的上升率.培养4 d后,加入酚类和苯胺类物质,漆酶的活性随时间的变化趋势和对照样是一致的,只是在数值上有些微差异.刚加入污染物,漆酶活性相比于对照样略有上升,在培养的后几天漆酶活性与对照样酶活性基本维持在一个水平.
2.3 简青霉对几种酚类和苯胺类物质的降解
简青霉对酚类和苯胺类物质的降解如图5所示.
简青霉对酚类和苯胺类物质的降解率随酚类和苯胺类物质质量浓度的增加逐渐减小.
简青霉对苯酚、2,4-二氯苯酚、苯胺的降解效果较好.当苯酚的质量浓度在500μg/m L左右时, 10 d后的降解率高达100%.当2,4-二氯苯酚的质量浓度为50μg/m L时,降解率达到100%,随着2,4-二氯苯酚浓度增加至90μg/m L时,10 d后简青霉对它的降解率减少至60%,且在一定的浓度范围内,降解率均保持在60%以上.当苯胺的质量浓度为1 000,2 000μg/m L时,简青霉对它的降解率高达80%以上,质量浓度为3 000,40 000和5 000 μg/m L时,简青霉对它的降解率均在60%左右.
简青霉对对硝基苯酚和对硝基苯胺很难降解,当对硝基苯酚质量浓度为25μg/m L时,降解率只有15%左右,在研究的浓度范围内简青霉对对硝基苯酚的降解率均低于15%.当对硝基苯胺质量浓度为25μg/m L时,降解率达到13%左右.可见简青霉对对硝基苯酚和对硝基苯胺很难降解.

图5 7 d和10 d后不同浓度酚类和苯胺类物质的降解效果Fig.5 The degradation rate o f phenols and anilines in different concentrations by Penicil lium simp licissimum after 7 and 10 days
2.4 酚类和苯胺类物质降解随时间的变化关系
在培养4 d后的体系中,分别加入苯酚、对硝基苯酚、2,4-二氯苯酚、苯胺和对硝基苯胺,使其在菌液体系中的质量浓度分别为500,60,25,1 000, 25μg/m L.每天定时取样.简青霉对酚类和苯胺类物质的降解随时间的变化关系如图6所示.

图6 酚类和苯胺类物质的降解随时间的变化关系Fig.6 The degradation rate of pheno ls and anilines in the variation of time
简青霉对苯酚、2,4-二氯苯酚、苯胺有很好的降解作用,在培养5~7 d时,简青霉对它们的降解作用比较明显,随着培养天数的增加,降解率的增幅逐渐减小.而简青霉对对硝基苯酚和对硝基苯胺较难降解,培养10 d后,降解率均低于20%.而且在降解的前几天,简青霉对它们基本上没有降解.随着培养时间的增加,降解率缓慢增加.
2.5 分析
在培养的初始阶段,营养物质比较充足,简青霉大量生长,当培养4 d以后,简青霉的菌球直径达到3~4 mm,菌球数量较多,营养物质也被大量消耗, C,N源短缺,从而促进漆酶的分泌.所以从图4中可以看到,培养4 d以后漆酶活性较培养初期有大幅提高.培养7 d以后,漆酶仍呈增加的趋势,只是增幅较前一阶段有所下降.这与酚类和苯胺类物质随时间的降解情况是一致的(图6).这说明,酚类和苯胺类物质的降解与简青霉漆酶活性有一定的关系,降解率随漆酶活性的增加而增大.
低浓度的酚类和苯胺类物质对简青霉的生长有一定的促进作用,这是因为低浓度的有机物为简青霉补充了一定的C,N源,促进了简青霉的生长,所以在低浓度的有机物作用下,简青霉的生物量比对照样中多,分泌的漆酶活性相比对照样中的漆酶活性也要略高一点.当酚类和苯胺类物质浓度逐渐增加,它们对简青霉的毒性逐渐增强,简青霉的生物量和菌球直径均低于对照样中的值(表1,表2).说明高浓度的有毒物质对简青霉的生长有抑制作用.
从简青霉对不同浓度酚类和苯胺类物质的降解情况可以看出,简青霉对低浓度有机物降解率高于对高浓度有机物的降解率,这可能是因为:首先,低浓度的有机物能成为简青霉的营养物质,促进简青霉的生长,简青霉的菌体数量增加,在代谢过程中分泌的漆酶较多;其次,有机物本身对简青霉有一定的毒害作用,当浓度很高时则会抑制简青霉的生长,影响简青霉的代谢.简青霉能较好地降解苯酚、2,4-二氯苯酚、苯胺,而对对硝基苯酚和对硝基苯胺较难降解,这可能与对硝基苯酚和对硝基苯胺中的硝基有一定的关系.
3 结 论
1)低浓度酚类和苯胺类物质对简青霉生长有促进作用,高浓度时对简青霉生长有一定的抑制作用.
2)简青霉对酚类和苯胺类物质的降解随时间的变化,与漆酶活性随时间的变化规律一致.说明酚类和苯胺类物质的降解与简青霉分泌漆酶有关.
3)简青霉对苯酚、2,4-二氯苯酚、苯胺都有很好的降解能力,而对对硝基苯胺和对硝基苯酚的降解效果较差,这说明带硝基的苯环物质比不带硝基的苯环物质更难被简青霉降解.
[1] SRIHARI V,DAS A.Comparative studies on adsorptive removalof phenolby th ree agro-based carbons:equilibrium and isotherm studies[J].Ecotoxicology and Environm en tal Safety, 2008,71(1):274-283.
[2] XIAO CB,NING J,YAN H,et al.Biodegradation of aniline by a new ly isolated Delf tia sp.XYJ6*[J].Chinese Jou rnal of Chem ical Engineering,2009,17(3):500-505.
[3] CASTILLEJOS-LÓPEZ E,NEVSKAIA D M,MUÑOZ V,et al.On the interactions of phenol,aniline and p-nitrophenol on activated carbon su rfacesas detected by TPD[J].Carbon, 2008,46(6):870-875.
[4] LI J,JIN Z,YU B,etal.Isolation and characterization of aniline deg radation sligh tly halophilic bacterium,erw inia sp. strain HSA 6[J].M icrobiological Research,2010,165(5):418 -426.
[5] YAO R S,SUN M,WANG C L,et al.Degradation of phenolic compounds w ith hyd rogen peroxide catalyzed by enzyme from ser ratia marcescens AB 90027[J].W ater Research, 2006,40(16):3091-3098.
[6] 聂永平,邓正栋,袁进.苯胺废水处理技术研究进展[J].环境污染治理与设备,2003,4(3):77-81.
NIE Yong-ping,DENG Zheng-dong,YUAN Jin.Application and development of treatment technology for aniline wastewater[J]. Techniques and Equipment for Environmental Pollution Control, 2003,4(3):77-81.(In Chinese)
[7] 彭红,罗开昆,高中洪,等.产漆酶真菌的筛选、培养及对苯酚的降解[J].华中科技大学学报:自然科学版,2005,33(7):111-114.
PENG Hong,LUO Kai-kun,GAO Zhong-hong,et a l. Screening and cu ltivation of fungi strains producing lassase and its degradation of phenol[J].H uazhong University of Science and Technology:Natu re Science Edition,2005,33(7):111-114.(In Chinese)
[8] 张莹,李小明,杨麒,等.丝瓜瓤固定黄孢原毛平革菌对2,4-二氯酚的降解研究[J].工业用水与废水,2008,39(4):27-31.
ZHANG Ying,LI Xiao-m ing,YANG Qi,et al.Biodegradation of 2,4-DCP by phanerochaetechrysospor ium imm obilized on Iufa cylindrical sponge[J].IndustrialW ater&W astewater, 2008,39(4):27-31.(In Chinese)
[9] 董小军,洪青,李恋,等.对硝基苯酚降解菌Pseudomonas sp. PDS-7的降解特性及其降解相关基因的克隆[J].微生物学报, 2008,48(11):1486-1492.
DONG X iao-jun,HONG Qing,LI Lian,et al.Characterization of a p-nitrophenol degrading bacterium Pseudomonas sp. PDS-7 and cloning of deg radation relevant genes[J].Acta M icrobiologica Sinica,2008,48(11):1486-1492.(In Chinese)
[10]杨彬,雷乐成.混合培养微生物好氧降解对硝基苯胺的特性研究[J].环境工程,2003,21(3):73-75.
YANG Bin,LEI Le-cheng.Study on characteristicsof aerobic degradation of p-nitroanilinum by mixed cu lture microbe[J]. Environmen tal Engineering,2003,21(3):73-75.(In Chinese)
[11]国家环保局.水和废水监测分析方法[M].4版.北京:中国环境科学出版社,2003:460-468.
M inistry of Environm ental Protection of the People's Republic of China.Monitoring and analysis method of w ater and w astew ater[M].4 th ed.Beijing:China Environm ental Science Press,2003:460-468.(In Chinese)
Research on the Degradation Effect of Contaminants like Phenols and Anilines by Using Penicillium sim p licissimum
HU Tian-jue†,WU Juan-juan,ZENG Guang-ming,LIU H ui,ZHANG Ying, HUANG Dan-lian,YU Bing,SHEN Ying
(1.College of Environmental Science and Engineering,Hunan Univ,Changsha,Hunan 410082,China;2.Key Laboratory of
Environmental Biology and Pollution Control(Hunan Univ),Ministry of Education,Changsha,Hunan410082,China)
In order to study the grow th of Penicillium simp licissimum exposed to phenolsand anilines, and the deg radation of these toxic substances,several different concentrations of phenols and anilinesw ere added to the culture system,which was cultured for 4 daysw ith Penicillium sim p licissimum.The results have show n that low concentrations of pheno ls and anilines can p rom ote the grow th of Penicillium sim p licissimum,But on the contrary,the grow thw ould be restrained under the culture of high concentrations.M eanwhile,Penicillium sim p licissim um can catalyze and oxidize phenol,2,4-dich lorophenol and aniline effectively.When the concentration of phenol was controlled at 500μg/m L,2,4-dichlorophenol was 50μg/m L,and anilinew as1 000μg/m L,the degradation rates of phenol,2,4-dichlorophenoland anilinewere all close to 100%.When the concentration of 2,4-dichlorophenolwas controlled at 60~125μg/ m L and anilinew as 2 000~5 000μg/m L,the degradation rates were over 60%and 70%,respectively. However,the degradation effect of p-nitrophenol and p-nitroaniline by Penicillium sim p licissimum was worse,and their degradation rate was only about 10%.
phenolic compounds;Penicillium simp licissimum;aniline compounds;biological degradation
Q89
A
1674-2974(2011)04-0061-05 *
2010-05-07
湖南省自然科学基金资助项目(07JJ5053)
胡天觉(1966-),男,湖南长沙人,湖南大学副教授,博士
†通讯联系人,E-mail:hutj66@yahoo.com.cn.

