男子柔道运动员6周减体重期神经肽水平变化的研究
包呼格吉乐图,曾凡星,冯连世
1 问题的提出
食欲素促进摄食功能、提高唤醒水平和减少能量消耗,其作用的发挥需要NPY的作用来介导实现[38]。在禁食和血中葡萄糖浓度降低时,食欲素水平上升。食欲素在弓状核(hypothalamic arcuate nucleus,ARC)处,与NPY能神经元上的受体结合之后,激活膜上的蛋白激酶 A和钙离子通道,使细胞内的钙离子浓度增加,加强其分泌作用;机体在体脂含量减少、饥饿、血糖浓度下降时瘦素和胰岛素分泌减少,糖皮质激素和食欲素分泌增加。同时,其反馈作用也能直接激活NPY能神经元,促进NPY mRNA的表达。禁食状态下血清食欲素 A水平显著增高,并与血清瘦素水平呈负相关[28],肥胖者血清食欲素 A水平较正常人显著降低,而瘦素水平显著高于正常人,且食欲素和瘦素是对立统一的矛盾体。前者促进摄食并减少能量消耗,后者抑制摄食并增加能量支出,瘦素通过与食欲素神经元表达的瘦素受体结合,抑制食欲素神经元表达前食欲素原mRNA和食欲素[39],运动影响食欲素水平[21]。目前有关限制饮食进行训练减体重期间机体食欲素、瘦素和神经肽Y变化方面鲜见有报道。本实验将观察优秀男子柔道运动员6周减体重实验期间这些指标的变化,对优秀男子柔道运动员减体重能量平衡的内分泌机制进行探索。
2 材料与方法
2.1 实验对象
来自内蒙古柔道队13名优秀男子运动员,减体重组(7人,年龄22.14±3.02岁,身高174.07±7.33 cm,体重73.14±4.91 kg,参赛体重 68.29±6.21 kg,训练年限6.00±1.91年,体重指数24.14±0.80),运动员入选全国第十届运动会决赛,为二级、一级、运动健将,另配对取一组条件相当的运动员为对照组(6人,年龄20.00±2.53岁,身高174.50±5.39 cm,体重72.67±4.50 kg,参赛体重68.50±5.76 kg,训练年限5.50±1.76年,体重指数23.86±0.90),受试者无心、肺、肝、肾疾病以及在研究过程中不服用任何激素类药物。受试者填写书面文件,保证实验顺利进行。受试者自由饮水。在6周的实验中,减体重组运动员每日摄入的总热量从15.14±1.49减少到7.84±2.16 MJ(3617.68±356.56至 1874.01± 516.58 Kcal),减少48.42%,每公斤体重所消耗的热量从0.21±0.01减少至0.11±0.03 MJ.kg-1(50.27±2.50至26.99±6.09 Kcal.kg-1),减少46.17%,在整个实验过程中蛋白质供能下降43.21%,脂肪供能下降63.57%,碳水化合物供能增加39.32%。因此,在6周实验中,减体重组运动员平均体重下降了4.14±1.54 kg或下降5.8%。
2.2 训练安排
第1周适应阶段:第2~4天以心率约160次/min的训练负荷为主。周一:上午对抗练习3 min×5,下午一般活动;周二:上午休息,下午对抗练习5 min×5,技术研究15 min;周三:上午对抗练习5 min×6,下午综合力量或专项力量练习;周四:一般活动,下午对抗练习5 min×8;周五:上午对抗练习3 min×6,下午跑圈;周六:实战对抗5 min×6,综合体力练习3 min×2,下午休息;周日:调整。第2、3、4、5周:逐渐增加训练负荷。训练原则是先增加训练量,然后逐步增加训练强度,至第3、4、5周时达到最大(血乳酸10~14 mmol/L)。周一:上午对抗练习5 min× 10,寝技5 min×2,下午综合力量;周二:爬山或400 m× 4,下午寝技5 min×6,对抗练习5 min×6;周三:同周一 ;周四:上午寝技5 min×2,对抗练习5 min×8,下午机动;周五:上午寝技5 min×3,车轮战 3 min×4,综合体力练习3 min×2,下午爬山;周六:实战对抗5 min×6,综合体力练习3 min×2;周日:调整。第6周:本阶段为训练末期,训练负荷上要保持一定强度,但总训练量有所下降。周一:上午对抗练习3 min×8,下午综合力量;周二:上午休息,下午对抗练习4 min×8;周三:上午对抗练4 min× 6,下午综合力量或专项力量练习;周四:一般活动,下午对抗练习5 min×8;周五:上午对抗练习3 min×6,下午爬山约500 m×(4~5);周六:实战对抗练习4 min×6,综合体力练习3 min×2,下午休息;周日:调整。
2.3 血样处理与保存
本研究中共抽取4次血,每两周抽取一次血,历时6周。运动员清晨7:00-7:30间空腹,准备 EDTA和普通真空采血管,用 EDTA管抽取1ml全血,再用普通真空管抽取4 ml全血,EDTA管当即做三分类血球计数,普通管血清用于测定食欲素A、瘦素、睾酮(testosterone,T)、皮质醇(cortisol,C);另取 EDTA管,加入30μl胰肽酶,取1 m l全血,血浆用于神经肽 Y测定,于-80℃保存待测。
2.4 指标测定
2.4.1 人体测量学指标测定
身高、体重、皮褶和围度指标测定采用全国体质测量专用工具;所有人体测量学工作部分由一名有多年从事体质测量经验的研究人员单独负责。身高、体重取3次测量值的平均值,以避免所取得的值偏离平均值。
2.4.2 食欲素 A测定
采用 EL ISA方法。原理为,酶联免疫吸附剂测定(Enzyme Linked ImmunoSorbent Assay,EL ISA)是一种免疫测定(immunoassay,IA)技术,抗原或抗体的固相化及抗原或抗体的酶标记。试剂盒由ADR公司(ADR Diagnostics,Co., Ltd,Lot No.051222)提供,药盒检测极限为0.06~0.08 ng/ml或3~4 pg/well,线性范围0.06~5.0 ng/ml,组内变异系数小于5%,组间变异系数小于14%。使用美国雷杜(Rayto Life and Analytical Sciences Co.,L td.)RT-6000酶标仪和RT-3000洗板机,在450 nm下读取OD值,自动打印结果,双管测定,取平均值。
2.4.3 瘦素测定
采用放射免疫方法。[125]I标记的抗原和被检测抗原与特异性抗体竞争性抑制反应为其测定原理。血清Leptin RIA Kit由北京北方生物技术研究所提供,检测范围为0.5~24 ng/ml,药盒检测极限为0.45 ng/ml,4℃反应24 h,组内变异系数为5.0%,组间变异系数为9.8%。标准品试剂测定值与实际测定值相关系数r为 0.998(P< 0.001),线性回归方程为 y=0.93X-0.61,R2=0.994。双管加样,在SN-6958智能γ计数器(上海原子能研究所)上计复合物中的1 min的脉冲数,取平均值。
2.4.4 神经肽 Y测定
利用液相竞争抑制原理,采用非平衡法对血浆NPY进行测定。NPY RIA Kit由北京科美东雅生物技术有限公司进口分装试剂,药盒检测极限小于20 pg/ml,组内、组间变异系数分别小于5%和10%。标准品试剂测定值与实际测定值相关系数r为0.997(P<0.001),线性回归方程为y=22.62+0.70x。标准或血浆中的NPY与限量的抗体预先在37℃反应5h,然后在4℃时加入[125]I-NPY参与竞争剩余的抗体结合位点24 h。当样品中的NPY含量越高,剩余的抗体结合位点越少,从而与抗体结合的[125]INPY越少,用分离剂分离出抗原-抗体复合物,双管加样,并在SN-6958智能γ计数器(上海原子能研究所)上计复合物中的1 min的脉冲数。
2.4.5 血清睾酮和皮质醇测定
采用放射免疫方法。[125]I标记的抗原和被检测抗原与特异性抗体竞争性抑制反应为其测定原理。血浆睾酮测定试剂盒为coated tubes TESTO-CT2(CISBio International-Filiale De/Subsidiary of Schering S.A.France),检测范围为0~50 nmol/L,药盒单位换算公式为,睾酮(ng/ml)=睾酮(nmol/L)×0.288,药盒检测极限为0.09 ng/ml,37℃反应1 h,组内变异系数为5.0%,组间变异系数为7.8%。标准品试剂测定值与实际测定值相关系数r为0.998(P< 0.001),线性回归方程为 y=0.9023X+34.562,R2= 0.992。血浆皮质醇测定试剂盒为 Coat-A-Coat TKCO 2(Diagnostic Products Corporation CA,U S A),检测范围为0~1380 nmol/L,单位换算公式为皮质醇(nmol/L)=皮质醇(μl/dL)×27.59,药盒检测极限为0.2μl/dL,37℃反应1 h,组内变异系数为4.5%,组间变异系数为9.8%。标准品试剂测定值与实际测定值相关系数r为 0.999(P< 0.001),线性回归方程为y=0.9133X+3.125,R2=0.998。双管加样,在SN-6958智能γ计数器(上海原子能研究所)上计1 min的脉冲数,取平均值。
2.5 统计分析
采用双因素重复测量方差分析的方法进行2×4(实验处理×时间)处理。先进行球形假设(Mauchly’s Test of Sphericity)检验[30,44],当球形假设成立时,可直接采用双变量方差分析结果(Sphericity Assumed);当球形假设不成立时,则采用双变量方差分析校正结果(用 Greenhouse-Geisser校正)。当处理组、处理组和时程交互作用显著时进行两两比较(Newman-Keuls Post Hoc Test),所测得数据以平均数±标准差表示,显著性水平为P<0.05,非常显著性水平为P<0.01。
对所得数据采用 STATISTICA 6.0(StatSoft,Inc., Tulsa,OK)进行统计分析。
3 实验结果
3.1 体重
减体重期间优秀男子柔道运动员体重数据的双因素重复测量方差分析显示,处理组与时程的交互作用在统计学上有显著意义。其F和P值分别为,处理组(F=0.392,P>0.05),处理组×时程(F=14.389,P<0.01)。Posthoc两两比较后,与0周相比,4周和6周体重明显下降(P<0.01和P<0.01)、与2周相比4周和6周体重也明显降低(P<0.01和P<0.01)、与4周比,6周时的体重也明显低(P<0.01)。各时间点上,对照组体重改变无显著差异(图1)。
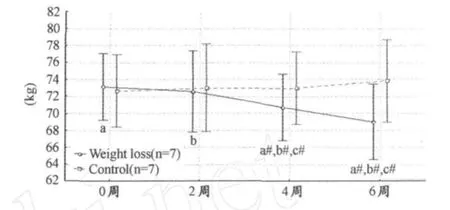
图1 优秀男子柔道运动员体重变化示意图注:相同符号表示显著(P<0.05),#表示非常显著(P<0.01),下同。
3.2 体重指数
减体重期间,优秀男子柔道运动员体重指数的双因素重复测量方差分析显示,处理组与时程的交互作用在统计学上有显著意义。其F和P值分别为,处理组(F=1.712,P>0.05),处理组×时程(F=14.143,P<0.01)。Post-hoc两两比较后:与0周相比,4周优秀男子柔道运动员体重指数明显降低(P<0.01),与0周、2周和4周相比,6周体重指数明显下降(P<0.01、P<0.01和 P≤0.01)。各时间点上,对照组体重指数改变无显著差异(图2)。

图2 优秀男子柔道运动员体重指数变化示意图
3.3 减体重期优秀男子柔道运动员血浆睾酮、皮质醇水平和睾酮/皮质醇比值变化
减体重期间,优秀男子柔道运动员睾酮、皮质醇和睾酮/皮质醇比值的双因素重复测量方差分析显示,处理组与时程的交互作用在统计学上没有显著意义(表1)。其F和P值分别为,T:处理组(F=8.922,P<0.05),处理组×时程(F=0.649,P>0.05)、C:处理组(F=13.879,P< 0.01),处理组×时程(F=0.486,P>0.05)和 T/C比值:处理组(F=16.2819,P<0.01),处理组 ×时程(F= 0.6240,P>0.05),各组数据处理组间均出现P<0.05,但经球形检验后校正其差异,最终结果不显著,从各指标时程变化趋势上看,随着减体重的深入,睾酮水平有下降趋势、皮质醇水平出现上升趋势,睾酮/皮质醇比值有下降趋势。

表1 优秀男子柔道运动员减体重期睾酮、皮质醇水平和睾酮/皮质醇比值变化一览表
3.4 优秀男子柔道运动员食欲素A水平变化
减体重期间,优秀男子柔道运动员食欲素A数据的双因素重复测量方差分析显示,处理组和时程在统计学上有显著意义,其F和P值分别为,处理组(F=92.263,P< 0.01),时程(F=5.134,P<0.01)。Post-hoc两两比较后,各时间点上,减体重组食欲素A水平在2周、4周和6周时与对照组相比显著升高(P<0.01)。减体重组,与实验前相比,4周和6周食欲素 A水平明显升高(P<0.01) (图3)。
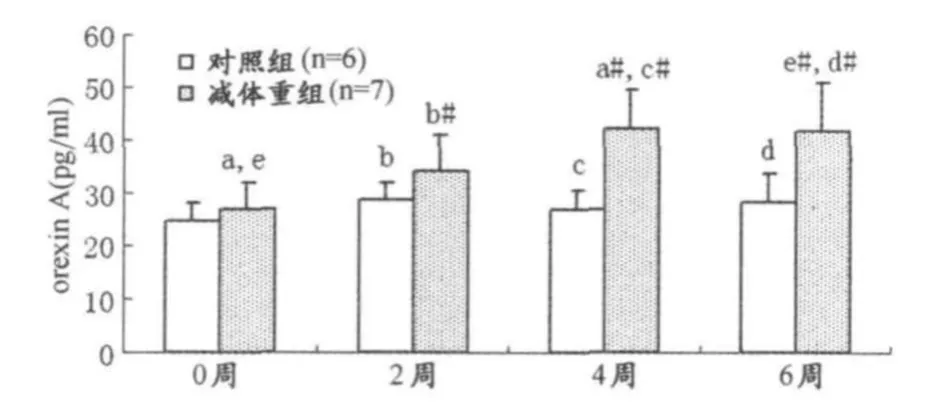
图3 优秀男子柔道运动员食欲素A水平变化直方图
3.5 优秀男子柔道运动员瘦素水平变化
减体重期间,优秀男子柔道运动员瘦素数据的双因素重复测量方差分析显示,处理组和处理与时程交互作用在统计学上有显著意义,其F和P值分别为,处理组(F= 45.602,P<0.01),处理×时程(F=4.185,P<0.05)。Post-hoc两两比较后,减体重组瘦素水平在2周、4周和6周时与对照组相比显著降低(P<0.05、P<0.05和P< 0.01)。减体重组2周、4周和6周时与0周相比,瘦素水平明显下降(P<0.01)(图4)。
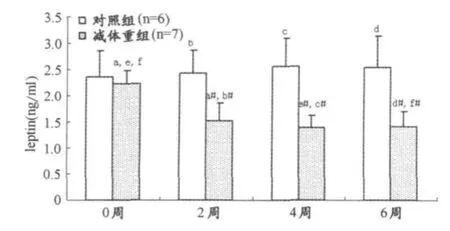
图4 优秀男子柔道运动员瘦素水平变化直方图
3.6 优秀男子柔道运动员神经肽 Y水平变化
减体重期间,优秀男子柔道运动员神经肽 Y数据的双因素重复测量方差分析显示,无论处理组、处理与时程的效互作用,在统计学上没有显著意义,其F和P值分别为,处理组(F=4.656,P<0.05),处理与时程(F=1.205,P>0.05)(图5)。但减体重组与对照组相比有升高趋势。
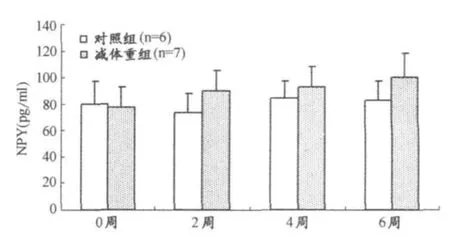
图5 优秀男子柔道运动员神经肽Y水平变化直方图
4 分析与讨论
运动员参加重大比赛前通过系统控制饮食附加既定训练计划进行减体重散见于各类报道中。著名学者杨则宜(2000)论述了竞技运动员减控体重过程中机体代谢及运动能力的变化,并针对其中存在的问题,详细阐述了各种减体重的方法和注意事项[11]。运动员无论采取缓慢减重,还是快速减重的方法都要有详细的计划,并要分阶段进行;运动员减体重方式的选择必须主要考虑到对体能的影响程度;运动员减控体重期间的膳食安排和营养补充要遵循科学性和针对性原则[3]等。机体体重调节机制包括遗传、生理生化和行为因素。机体保持恒定体重要维持两种平衡,即能量摄入与输出平衡和营养物质摄入与消耗平衡,对于这一动态平衡的任何一种影响因素均会导致体重增加或降低[46]。运动员减体重是对上述平衡进行干预,使机体能量平衡趋于负平衡,进而限制饮食进行训练来减体重,使机体能量负平衡进一步加深。
研究显示,经6周的减体重实验,运动员体重下降,从第4周出现显著差异,而对照组运动员体重有所增加,但无显著意义。体重指数也下降显著,具有处理和时程的交互作用,但这些指标的变化在处理组间未出现显著差异,其中,去脂体重变化与Roemmich等(1999)以青少年摔跤运动员为对象,在较长的时间跨度内进行研究的结果有所不同[8]。
笔者未对血中游离睾酮(free testosterone,FT)和性激素结合球蛋白(sex hormone binding globulin,SHBG)进行测定分析。本实验中 T水平未见显著改变。血中各类激素水平的维持具有各自的动态调节机制,因此,优秀男子柔道运动员 T等指标的变化,正是说明在减体重过程中机体产生及清除那些激素的机制运行正常,没有出现因减体重而某一机能能力遭受抑制,这显然与短期减重的结果有所区别[26],减体重可能对上下肢力量的保持上也有所不同[6]。
文献报道,赛季减体重期间运动员血清皮质醇水平未见改变[3],本实验也得出相同的结果,但运动员在较短时期内食用低热饮食进行训练完成减体重的量,其身体机能指标首先改变的是皮质醇、血清CK等指标[7],说明缓慢减体重对机体无不良作用。
本工作首次观察了优秀男子柔道运动员6周减体重期间血浆食欲素、瘦素和神经肽 Y水平的变化。
作为生命有机体,运动员在训练中保持内环境稳态是一件极富有挑战性事件[42]。限制饮食进行训练减体重使机体能量平衡遭到破坏,使分解代谢占主导地位。因此,机体动用各种机能来调节。此时,运动员减体重必然造成机体生理和心理应激。以往在减体重工作中采用不同方法,包括脱水、限制饮食、饥饿,更有甚者采用了催吐和服用泻药等不安全手段。减体重的准备(making weight)伴随着运动员疲劳、易怒和焦虑等心理应激改变[51,2]。如前所述,优秀男子柔道运动员减体重期血清皮质醇水平变化不明显,但有升高趋势。而自由式摔跤运动员在摄入低热量饮食的同时进行大强度身体训练,皮质醇水平明显升高[48]。表明机体已经处于生理性应激中,也是机体在能量负平衡状态下做出的一种反应。
食欲素是新近发现的对进食强有力调控的一类神经肽[47]。研究表明,实验狗经48 h饥饿(24 h日节律外加24 h饥饿)后脑脊液食欲素水平与其基础值没有显著差异,但睡眠剥夺48 h之后其浓度升高70%,并与其自发运动行为呈正相关。同一动物进行2 h的运动所升高的食欲素水平比其正常活动时高57%,同时其升高量与自发运动行为成正比[52]。Martins等(2004)的实验显示,大鼠按其日节律活动结束后,对其长时间固定,发现脑脊液食欲素水平降低,继而短时间被动游泳后明显升高,认为动物食欲素能系统活动与自发运动行为有一定的关系[36]。食欲素能够以简单扩散形式自由通过血脑屏障[28]。
优秀男子柔道运动员减体重期间血浆食欲素水平在第2周、第4周和第6周时明显高于对照组。此时,与实验开始时比较,由于运动员体重减轻,机体已经处于能量负平衡状态。与上述两则动物实验结果的原因不同,运动员血浆食欲素水平升高是由长期训练和限制饮食导致的,这一现象的出现可以在其他指标变化中得以佐证。
研究发现,除了中枢下丘脑之外,胃肠道等部位有食欲素及其受体广泛存在,食欲素有可能作用到外周组织和胃肠道细胞,从而能够激活麦斯纳氏神经丛兴奋,并增强其运动。此类细胞对饮食状态的功能性反应的意义远远超过其中枢调节能量代谢[31]。因此,我们测定了该激素在外周的浓度,有趣的是,血浆食欲素水平在运动员体重控制期间其水平持续升高。所升高的食欲素A迅速通过血脑屏障进入大脑各处组织中,外周所上升的食欲素A,可能仅有少部分参与食欲控制和能量消耗。动物实验发现,脑室注射(intraventricular administration)食欲素后,发现动物 HPA轴激活[23,34],本研究中所升高的食欲素水平,有可能激活 HPA的活动,也有激活下丘脑-垂体-甲状腺轴的证据[17]。因为,在我们另一个研究中看到,限制饮食进行训练使自由式摔跤运动员血清皮质醇水平提高[48]。与瘦素的作用相比,食欲素A和下丘脑-垂体-肾上腺轴激素在饥饿时的相互关系不甚紧密。虽然到目前为止人们对饥饿疗法能够改善由于身心障碍造成的心理综合症的机制不甚明了[33],我们还是推测 HPA轴至少通过食欲素和或瘦素水平的改变来调控日常应激造成的问题。
优秀男子柔道运动员减体重期间血浆瘦素水平在第2周、第4周和第6周时明显低于对照组。有报道显示,体重降低10%伴有血浆瘦素水平下降53%[14,25],本实验也显示类似规律。如此大的瘦素水平变化与小范围体脂变化提示,对于瘦素的分泌除了脂肪组织,还有其他调控机制存在。笔者认为,一个重要的因素是能量摄入的变化。有人提出能量摄入减少伴随着血浆胰岛素水平下降,这对于人或动物来说都是降低血浆瘦素水平的因素[5]。减体重造成的能量消耗也导致血浆瘦素水平下降[35]。瘦素在白色脂肪细胞的表达量下降和机体饥饿之后导致机体为了保存能量而使甲状腺素的生热作用降低、抑制性腺轴功能的同时激活丘脑-垂体-肾上腺轴活动致使机体能量储存过程增强是历来受人们关注的焦点[19]。孔兆伟(1999)阐述运动与瘦素水平变化关系时认为,多种运动形式对瘦素水平改变没有显著作用[4],因此,认为本研究中瘦素变化的意义还是在能量平衡上。
Ob基因编码的瘦素含有167个氨基酸,除了脂肪组织外还有很多组织分泌。在脂肪组织生成的瘦素进入循环后,通过血脑屏障到达中枢神经系统。在下丘脑水平与其受体结合,激活第二信使抑制摄食行为或增强能量消耗。研究发现,给瘦素缺失的ob/ob大鼠脑室注射少量瘦素能够纠正其代谢异常的同时使其体重减轻。在肥胖人群中,瘦素水平比普通人的高,说明此群人已有瘦素抵抗出现。对于此,有人提出,血脑屏障摄入瘦素到中枢神经系统功能低下,可能是瘦素抵抗出现的一个原因。这个推论是从那些肥胖人的血中瘦素水平高,且脑脊液和血浆瘦素比值低的人群中得出的。另一个瘦素抵抗的机制可能是,在下丘脑水平瘦素受体大量表达的部位。出于此种考虑,研究者分析了瘦素作用通路,起初,在众多瘦素介导物中下丘脑部位的神经肽 Y被认为是瘦素作用信号的主要接受者。目前已经清楚,瘦素能够直接抑制下丘脑弓状核NPY mRNA的表达,这样就可以抑制其对摄食行为的有效激活[48]。然而,敲除神经肽 Y肥胖型小鼠对瘦素作用的反应上可以推测,另外有瘦素作用机制[15]。已经证实,除了神经肽 Y之外,还有黑色素细胞刺激素(α-MSH)被认为是瘦素作用的另一个接受者。产生于阿片促黑激素皮质素原(POMC)的α-MSH能够抑制摄食行为,并且在弓状核处瘦素受体和POMC mRNA表达同比例接受瘦素的调控[49]。
本实验中,减体重运动员随着训练进程的深入,优秀男子柔道运动员不仅体重减轻,脂肪减少和体重指数减少,血中瘦素水平也下降明显,在为期6周的减体重工作中,我们反复验证瘦素变化特点。这与前人研究饥饿能够显著降低血中瘦素水平的结果相似[32]。
进一步看到,运动员血浆瘦素和皮质醇水平变化之间虽显相反,但由于受试者例数少,笔者无法对其做进一步的相关性分析。有关以动物为实验材料,在极端应激和饥饿状态下得出的结果显示,瘦素变化与血浆皮质激素变化相反[2],提示瘦素与机体应激有关[22]。限制饮食进行训练可使血浆皮质醇水平提高而抑制瘦素分泌[12]。
Jurimae等(2004)观察6名女子划船运动员做3周的抗阻练习后进行3周的耐力训练,每周期结束后间歇一周,经抗阻练习后 TSH、T3降低、瘦素下降持续到间歇期结束,T4没有变化,耐力训练之后 TSH明显升高。在间歇期瘦素与基础 TSH水平之间显著相关,在整个研究过程中,体重指数和脂肪重量没有变化,并与激素变化之间没有相关,他们推测大强度运动中瘦素和甲状腺轴激素水平的变化与机体能量消耗的变化有关,与体重指数和脂肪没有关系,最终他们得出,瘦素和甲状腺轴激素的降低是由大强度运动所致[27,41]。引用上述工作的目的在于,试图说明大强度运动导致运动员血浆瘦素水平降低的原因。如前所述,机体处在能量负平衡状态时,基础代谢率下降、性腺轴机能抑制和肾上腺轴功能增强[19]。在整个研究过程中,笔者虽然未能发现优秀男子柔道运动员减体重期间血清睾酮和皮质醇水平有显著变化,但有变化的趋势,而在自由式摔跤运动员的睾酮和皮质醇水平下降和升高。前者因为减体重持续时间较长,能量负平衡对机体造成的影响相对于后者缓慢,但机体为了极力保持能量平衡,还是改变瘦素浓度来适应。因此,这些结果提示,今后摔跤项目减体重工作要充分注重能量平衡。
NPY广泛分布于中枢神经系统和外周组织。在中枢神经系统,NPY具有促进进食、影响激素分泌、性行为、呼吸、电解质平衡、体温调节、生物节律、学习记忆和情绪活动等多种生物学功能。
本研究中优秀男子柔道运动员为期6周的减体重中,未能看到NPY水平的显著变化,但在绝对值上高于对照组,并且随着减体重时间的推进,NPY水平逐渐增加,对于该项指标的减体重组与对照组未能出现显著差异,这方面有待于进一步研究。
动物实验发现,饥饿能使动物下丘脑处NPY mRNA表达增强。神经性厌食症患者有较高水平的脑脊液NPY,当其体重增加后恢复到正常水平,并且在健康受试者中同样有此现象[18,29]。强烈应激状态可使机体外周NPY水平提高[1,13],笔者的研究中,起初限制饮食进行训练可能是做为大强度刺激提高循环NPY水平,但相同刺激反复作用到机体,可能使 NPY水平迅速回落。同样 Nam等(2001)以限制饮食来减肥胖女性体重时发现,不仅是脑脊液NPY,还是血浆NPY均未出现实验初所假设那样升高[43],因此,认为调节机体能量平衡可能有另外机制存在。但到目前为至,中枢和外周NPY水平之间关系的认识尚少。因为,在外周,NPY广泛分布于心血管、胃肠道、副交感神经和肾上腺髓质等处。然而,新近的研究发现,转笼运动造成肥胖大鼠丘脑背侧中间部(dorsal medial hypothalamus,DM H)促肾上腺皮质激素释放因子(corticotropinreleasing factor,CRF)表达增强而抑制摄食行为,同时运动训练抑制此部NPY的表达来调控体重反弹[4]。
但是,在不同的生理和心理应激状态下,伴随去甲肾上腺素的分泌,循环NPY水平升高[40]或下降[45]的报道屡见不鲜。NPY与去甲肾上腺素协同存在于交感神经系统中,诸如运动应激和饥饿等都影响其分泌。Hanson等(1997)认为,在不同的应激条件下短时间饥饿(48h)造成的皮质酮水平升高与NPY mRNA含量变化无关[20],强烈的心理应激影响机体免疫机能,但对 NPY含量没有作用[19]。甚至有研究显示,肾上腺切除亦没有影响血中NPY含量的变化[9]。但高血压病人经短时间一次中等强度自行车功率计上运动后即刻,血中儿茶酚胺含量升高的同时,NPY水平也上升[16],Lewandow ski等(1998)认为,跑台训练对经期女子心脏功能调节方面,儿茶酚胺起主要作用,而NPY的作用值得商榷[37]。另有报道显示,SD大鼠在转笼内自发运动18个月后,其肾上腺NPY mRNA含量变化没有显著意义,但将此类动物放置振荡刺激器上进行20min的强烈刺激后,其肾上腺NPY mRNA含量明显高于对照组,提示,长期运动训练能够提高 SD大鼠应激时NPY的表达[36]。
笔者还发现,运动员在减体重期间,饮食结构出现变化,蛋白质、脂肪供能百分比逐渐减少的同时,碳水化合物供能比例加大,这可能对NPY水平未出现显著改变提供一种代偿机制。因为,新近发现,野生型大鼠NPY水平的提高与血中葡萄糖浓度紧密关联[50],注射胰岛素造成动物血糖降低,由此引发NPY在下丘脑mRNA表达增加。
有报道显示,循环NPY水平变化有年龄和取样时间特点,Jensen等(1994)看到,健康的7名年轻的和7名老年受试者起初均以75%O2max运动后,去甲肾上腺素和肾上腺素的变化相同,但继续以此负荷运动5 min后,老年人去甲肾上腺素和肾上腺素水平保持不变,而年轻受试者上述激素水平提高,运动15min后达到显著性水平,并且只有运动后的年轻受试者血浆NPY达最高水平[24],提示老年人交感神经活动水平已达最高,而年轻人随着运动负荷的加大,交感神经活动更加强。因此,推测NPY的如此表现与笔者取样时间有关,有待今后的研究中进一步阐明。
5 结论
本研究首次观察了优秀男柔道运动员6周减体重实验中血浆食欲素、瘦素和神经肽 Y水平的变化,机体在能量负平衡状态下血浆食欲素水平显著升高、瘦素水平明显下降,而神经肽 Y水平未见显著改变;从睾酮、皮质醇水平变化看出,优秀男子柔道运动员减体重期一般机能指标未见明显变化,说明缓慢减体重对身体机能无负面影响。
[1]包呼格吉乐图,曾凡星,冯连世.摔跤运动员两周减体重期等速力量与肌肉生长抑素含量相关性研究[J].体育科学,2008,28 (11):54-61.
[2]包呼格吉乐图,曾凡星,冯连世.运动员减体重研究进展——能量平衡的神经内分泌机制[J].内蒙古师范大学学报(自然科学汉文版),2008,(2):276-285.
[3]归予恒,王爱兰.优秀轻级别拳击运动员减控体重与营养补充方法探讨[J].中国运动医学杂志,2004,23(4):420-421.
[4]孔兆伟.对运动不能改变leptin水平的质疑[A].杨锡让,傅浩坚.运动生理学进展[M].北京:北京体育大学出版社,1999: 381-382.
[5]杨则宜.运动员减、控体重的科学方法及减体重后比赛期的特殊营养补充[J].浙江体育科学,2000,22(5):36-38.
[6]3RD M C A,WANG S,SOUTHW ICK SM,etal.Plasma neuropep tide-Y concentrations in humans exposed to military survival training[J].Biol Psychiatry,2000,47(10):902-909.
[7]ADAM J A,M ENHEERE P R,VAN D F M,etal.Decreased p lasma o rexin-A levels in obese individuals[J].Int JObesity Related Metabolic Disorders,2002,26(2):274-276.
[8]AHIMA R S,PRABAKARAN D,MANTZOROS C,etal.Role of leptin in the neuroendocrine response to fasting[J].Nature, 1996,382(6588):250-252.
[9]BEMET F,DEDIEU J F,LABORIE C,etal.Circulating neuropep tide Y(NPY)and catecholamines in rat under resting and stress conditions.A rguments for extra-adrenal origin of NPY, adrenal and extra-adrenal sources of catecholamines[J].Neuroscience Letters,1998,250(1):45-48.
[10]BIS,SCOTT K A,HYUN J,etal.Running w heel activity p revents hyperphagia and obesity in Otsuka long-evans Tokushima Fatty rats:role of hypothalamic signaling[J].Endocrinol,2005, 146(4):1676-1685.
[11]BODEN G,CHEN X,MOZZOL IM,etal.Effect of fasting on serum leptin in normal human subjects[J].J Clin Endocrinol Metabol,1996,81(9):3419-3423.
[12]BOMSTEIN S R,UHLMANN K,HA IDAN A,etal.Evidence for a novel peripheral action of leptin as a metabolic signal to the adrenal gland:leptin inhibits cortisol release directly[J].Diabetes,1997,46(7):1235-1238.
[13]BROQUA P,WETTSTEIN J G,ROCHER M N,etal.Behavio ral effects of neuropep tide Y receptor agonists in the elevated p lus-maze and fear-potentiated startle p rocedures[J].Behav Pharmacol,1995,6(3):215-222.
[14]CLEM EN T K,VA ISSE C,LA HLOU N,etal.A mutation in the human leptin receptor gene causes obesity and pituitary dysfunction[J].Nature,1998,392(6674):398-401.
[15]ERICKSON J C,CLEGG K E,PALM ITER R D.Sensitivity to leptin and susceptibility to seizuresof mice lacking neuropeptide Y[J].Nature,1996,381(6581):415-421.
[16]GAJEK J,ZYSKO D.The influence of singlemoderate exercise on the sympathetic nervous system activity in patientswith essential hypertension[J].Polskie A rchiwum Medycyny Wew netrznej,2002,108(6):1145-1150.
[17]GARCIA-LUNA C,AMA YA M I,ALVAREZ-SALAS E,et al.Prep ro-o rexin and feeding-related pep tide recep to r exp ression in dehydration-induced ano rexia[J].Regulatory Pep tides, 2010,159(1-3):54-60.
[18]GENDALL K A,KA YE W H,AL TEMUS M,etal.Lep tin, neuropeptide Y,and peptide YY in long-term recovered eating disorder patients[J].Biol Psychiatry,1999,46(2):292-299.
[19]GU IDIL,TRICERRIA,VANGEL IM,etal.Neuropeptide Y plasma levels and immunological changes during academic stress[J].Neuropsychobiol,1999,40(4):188-195.
[20]HANSON E S,LEV IN N,DALLMAN M F.Elevated corticosterone is not required for the rapid induction of neuropeptide Y gene exp ression by an overnight fast[J].Endocrinol,1997,138 (3):1041-1047.
[21]HASKELL-LUEVANO C,SCHAUB JW,ANDREASEN A,et al.Voluntary exercise p revents the obese and diabetic metabolic syndrome of the melanocortin-4 receptor knockout mouse [J].FASEB J,2009,23(2):642-655.
[22]HEIMAN M L,AH IMA R S,CRAFT L S,etal.Leptin inhibition of the hypothalamic-pituitary-adrenal axis in response to stress[J].Endocrinol,1997,138(9):3859-3863.
[23]IDA T,NA KAHARA K,MURA KAM I T,etal.Possible involvement of orexin in the stress reaction in rats[J].Biochem Biophys Res Commun,2000,270(1):318-323.
[24]JENSEN E W,ESPERSEN K,KANSTRUP IL,etal.Exercise-induced changes in plasma catecholamines and neuropeptide Y:relation to age and sampling times[J].J Appl Physiol, 1994,76(3):1269-1273.
[25]JEQU IER E,TAPPY L.Regulation of body weight in humans [J].Physiol Rev,1999,79(2):451-480.
[26]JOHANSON A,FREDRIKSSON R,W INNERGREN S,etal. The relative impact of chronic food restriction and acute food dep rivation on p lasma ho rmone levels and hypothalamic neuropeptide exp ression[J].Peptides,2008,29(9):1588-1595.
[27]JURIMAE J,JURIMAE T.Plasma leptin responses to p rolonged sculling in female rowers[J].J Sports Med Phy Fitn, 2004,44(1):104-109.
[28]KASTIN A J,A KERSTROM V.O rexin A but not o rexin B rapidly enters brain from blood by simp le diffusion[J].J Pharmacol Experimental Therapeutics,1999,289(1):219-223.
[29]KA YE W H,BERRETTIN IW,GW IRTSMAN H,etal.A ltered cerebrospinal fluid neuropeptide Y and peptide YY immunoreactivity in anorexia and bulimia nervosa[J].A rchives General Psychiatry,1990,47(6):548-556.
[30]KESELMAN H J,KESELMAN J C.The analysis of repeated measures designs in medical research[J].Statistics Med,1984, 3(2):185-195.
[31]KIRCHGESSNER A L,L IU M.Orexin synthesis and response in the gut[J].Neuron,1999,24(4):941-951.
[32]KOLACZYNSKIJW,CONSIDINE R V,OHANNESIAN J,et al.Responses of leptin to short-term fasting and refeeding in humans:a link w ith ketogenesis but not ketones them selves [J].Diabetes,1996,45(11):1511-1515.
[33]KIMA KIG,NA TSUMOTO Y,N ISH IKA TA H,etal.O rexin-A and lep tin change inversely in fasting non-obese subjects[J]. Eur J Endocrinol,2001,144(6):645-651.
[34]KURU M,UETA Y,SERINO R,etal.Centrally administered orexin/hypocretin activates HPA axis in rats[J].Neuroreport, 2000,11(9):1977-1980.
[35]LEIBEL R L,ROSENBAUM M,H IRSCH J.Changes in energy expenditure resulting from altered body weight[J].New England JMed,1995,332(10):621-628.
[36]LEVENSON C W,MOORE J B.Response of rat adrenal neuropeptide Y and tyrosine hydroxylase mRNA to acute stress is enhanced by long-term voluntary exercise[J].Neurosci Letters,1998,242(3):177-179.
[37]LEWANDOWSKIJ,PRUSZCZYK P,ELAFFIM,etal.Blood p ressure,p lasma NPY and catecholamines during physical exercise in relation to menstrual cycle,ovariectomy,and estrogen replacement[J].Regulatory Peptides,1998,75-76:239-245.
[38]L I Y,DEN POL AN V.Differential target-dependent actions of coexp ressed inhibitory dyno rphin and excitatory hypocretin/ orexin neuropeptides[J].J Neurosci,2006,26(50):13037-13047.
[39]LOPEZM,SEOANE L,GARCIA M C,etal.Lep tin regulation of prep ro-orexin and orexin receptorm RNA levels in the hypothalamus[J].Biochem Biophy Res Commun,2000,269(1):41-45.
[40]LUNDBERG J M,MARTINSSON A,HEMSEN A,etal.Corelease of neuropeptide Y and catecholamines during physical exercise in man[J].Biochem Biophy Res Commun,1985,133 (1):30-36.
[41]MAESTU J.The perceived recovery-stress state and selected hormonalmarkers of training stress[D].Tartu:Jurgen Steinaker,Juri Allik(Ph.D);Tartu University;2004.
[42]MARTINS PJ,D’ALM EIDA V,PEDRAZZOL IM,etal.Increased hypocretin-1(orexin-a)levels in cerebrospinal fluid of rats after sho rt-term fo rced activity[J].Regulato ry Pep tides, 2004,117(3):155-158.
[43]NAM S Y,KRA TZSCH J,KIM KW,etal.Cerebrospinal fluid and p lasma concentrations of lep tin,NPY,and alpha-MSH in obese women and their relationship to negative energy balance [J].J Clinical Endocrinol Metabol,2001,86(10):4849-4853.
[44]OVERALL J E.How many repeated measurements are useful? [J].J Clin Psychol,1996,52(3):243-252.
[45]RASMUSSON A M,HAUGER R L,MORGAN C A,etal. Low baseline and yohimbine-stimulated plasma neuropeptide Y (NPY)levels in combat-related PTSD[J].Biological Psychiatry,2000,47(6):526-539.
[46]ROBERTS SB,FUSS P,EVANSW J,etal.Energy expenditure,aging and body composition[J].J Nut,1993,123(2 Supp l):474-480.
[47]SA KURA IT,AM EM IYA A,ISH IIM,etal.Orexins and o rexin recep to rs:a family of hypothalamic neuropep tides and G p rotein-coup led recep to rs that regulate feeding behavio r[J].Cell, 1998,92(5):1.
[48]SCHWARTZM W,SEELEY R J,CAMPFIELD L A,etal.I-dentification of targetsof lep tin action in rat hypothalamus[J]. J Clin Invest,1996,98(5):1101-1106.
[49]SCHWARTZ M W,SEELEY R J,WOODS S C,etal.Lep tin increases hypothalamic p ro-opiomelanocortinmRNA exp ression in the rostral arcuate nucleus[J].Diabetes,1997,46(12):2119-2123.
[50]SINDELARD K,STEM L,M IURA G I,etal.Neuropeptide Y is required for hyperphagic feeding in response to neuroglucopenia[J].Endocrinol,2004,145(7):3363-3368.
[51]STEEN SN,BROWNELL KD.Patternsof weight loss and regain in w restlers:has the tradition changed?[J].Med Science Sports Exe,1990,22(6):762-768.
[52]WU M F,JOHN J,MA IDMENT N,et al.Hypocretin release in no rmal and narcolep tic dogs after food and sleep dep rivation, eating,and movement[J].Am J Physiol,2002,283(5):R1079-1086.

