慢性阻塞性肺疾病下呼吸道细菌定植的动态变化与肺功能和痰细胞因子的关系
杨兴慧,王浩彦
慢性阻塞性肺疾病 (chromic obstructive pulmonary disease,COPD)的患病率和死亡率均较高,社会经济负担沉重,已成为重要的公共卫生问题。它的主要特征是慢性气流阻塞,并呈进行性发展,伴有对气道有害颗粒或气体的异常炎症反应。气道慢性炎症作为COPD发病和进行性发展的中心环节已得到多数学者的认同,但引起气道慢性炎症的病因和发病机制目前尚未完全阐明。近十几年来,国内外的一些研究证实,部分COPD患者的下呼吸道存在细菌[1-3]。下呼吸道细菌定植(lower airway bacterial colonization,LABC)是指在正常无菌的下呼吸道出现了持续存在的细菌,且不断生长、繁殖,而不引起显著的细菌感染的临床症状。很多研究者发现部分稳定期COPD患者气道内细菌定植与炎症存在一定的关系。目前的研究多为横断面研究,关于下呼吸道细菌定植的动态变化与肺功能的纵向研究较少。本研究就COPD稳定期患者是否存在LABC,LABC是否存在动态变化,LABC与气道炎症的关系及他们的肺功能变化进行研究分析。
1 资料与方法
1.1 一般资料 选择2007年12月—2008年2月北京友谊医院门诊就诊的COPD患者。均符合2007年中华医学会呼吸病学分会组织制定的COPD诊治规范 (草案)中关于COPD的定义[4],且均处于稳定期。合并哮喘、肺栓塞等其他呼吸系统疾病或严重心脏疾病、肿瘤、慢性消耗性疾病者均不入选。
1.2 方法
1.2.1 留取痰液 受试者清水漱口,先自行咳痰,若无痰,予0.9%氯化钠溶液雾化吸入排痰,若仍无痰,再逐步予3%、4%、5%氯化钠溶液雾化吸入排痰,每次间隔7 min,直至留取痰液约10 ml。取痰过程中若出现不适如喘憋、气短、呼吸困难等,立即停止雾化吸入,休息、吸氧,吸入β2受体激动剂 (沙丁胺醇)[5]。将诱导的痰液置于无菌的痰盒中,镜下观察痰液标本是否合格。
1.2.2 痰液处理 获取痰液后1 h内立即进行培养。首先在痰液中加入稀释的Sputosol液,作用20 min使痰液均质化。Sputoso液与痰液的比例为1∶1,此1∶1悬液视为原液 (定量计算时加以校正)。预先准备好4个无菌试管 (A、B、C、D管),每管含0.9氯化钠溶液4.5 ml。取原液0.5 ml置于A管中 (相当于是10-1浓度),再从A稀释管中吸取0.5 ml置于B管中 (相当于是10-2浓度),如此依次稀释,直到D管稀释完毕。管内痰液浓度依次为10-1~10-4。用10 μl接种环取各个浓度的痰液,分别密涂接种于血琼脂平皿、麦康凯琼脂平皿和巧克力琼脂平皿。置于5%二氧化碳培养箱中,37℃培养24 h。
1.2.3 检测痰细胞因子 将原液痰标本 (≥5 ml)用微量称称重,加4倍体积的新鲜配制的0.11%二硫苏糖醇 (dithiothreitol,DDT)用吹管反复吹打,用振荡器震荡旋转15 min,使之成为均匀的混悬液,将混悬液以48 μm的滤网过滤,再将过滤的混悬液放入离心机以790 g离心10 min,上清液分装-80℃保存。采用双抗体夹心法检测痰液肿瘤坏死因子-α(TNF-α)、白细胞介素-8(IL-8)、中性粒细胞弹性蛋白酶(NE)。
1.2.4 肺功能测定 采用德国JAEGER公司的肺功能仪进行常规通气测定,记录 FEV1、FEV1/预计值及 FEV1/FVC值。肺功能分级[4]:FEV1/预计值≥80%为Ⅰ级,80% >FEV1/预计值≥50%为Ⅱ级,FEV1/预计值<50%为Ⅲ级。
1.2.5 随访 嘱患者6个月后门诊复诊,同样留取痰液,进行细菌培养,痰细胞因子测定及肺功能检测。
1.3 统计学方法 采用SPSS 11.0统计软件包进行统计学处理。LABC阳性组及LABC阴性组两组的痰细胞因子,肺功能检测值进行比较,计量资料为正态分布,采用独立样本t检验的方法,以P<0.05为差异有统计学意义。
2 结果
2.1 患者基本状况 共有入选患者34例,其中男31例,女3例,年龄 (64.71±9.48)岁,共完成68次测试。第1次FEV1为 (1.51±0.73)L,6个月后为 (1.44±0.69)L;FEV1/预计值 (%)第1次为 (65.80±30.37),6个月后为(61.90±31.34);FEV1/FVC(%)第1次为(46.84±14.89),第2次为 (47.71±13.24)。根据肺功能情况分级:第1次测试:Ⅰ级10例,占29.4%,Ⅱ级14例,占41.1%,Ⅲ级10例,占29.4%;6个月后第2次测试:Ⅰ级10例,占29.4%,Ⅱ级11例,占32.4%,Ⅲ级13例,占38.2%。
2.2 下呼吸道细菌定植的动态变化 第1次LABC阳性者10例,其中女2例,男8例,平均年龄 (60.90±9.81)岁;阴性者24例,其中男23例,女1例,平均年龄 (66.29±9.06)岁。第2次LABC阳性者10例,其中女1例,男9例,平均年龄 (62.17±10.42)岁;阴性者24例,其中男22例,女2例,平均年龄 (65.01±4.22)岁。有4例持续LABC阳性,有18例持续LABC阴性,有6例第1次LABC阳性而第2次LABC阴性,有6例第1次LABC阴性而第2次LABC阳性。
2.3 LABC与痰细胞因子浓度及肺功能变化的关系 将初始LABC阳性和由阴性转为阳性的患者作为阳性组,持续阴性的患者作为阴性组。阳性组与阴性组的第1次和第2次的痰细胞因子TNF-α、IL-8、NE浓度相比较,阳性组较阴性组水平偏高,TNF-α、IL-8差异有统计学意义 (P<0.05)。肺功能阳性组较阴性组数值偏低,但差异无统计学意义 (P>0.05,见表1)。
表1 两组患者痰细胞因子、肺功能检测结果比较 ()Table 1 Comparison the phlegm cytokines,pulmonary function testing results in the two groups
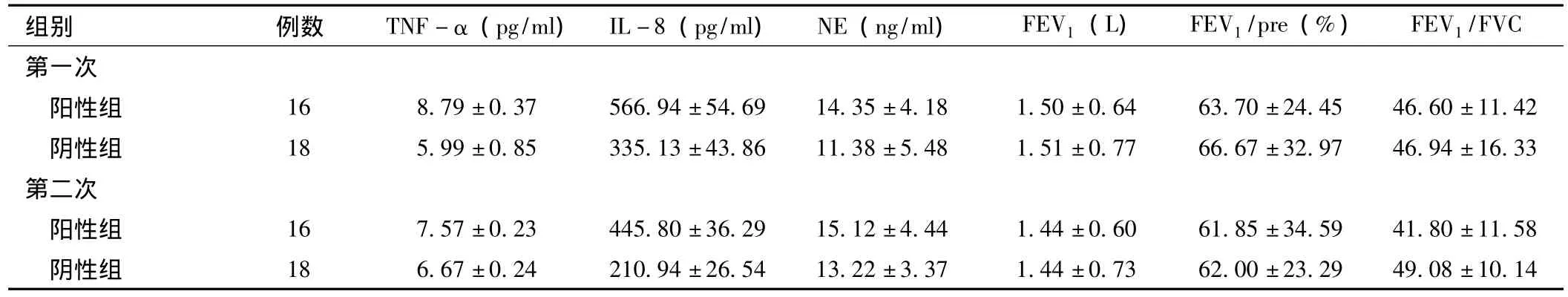
表1 两组患者痰细胞因子、肺功能检测结果比较 ()Table 1 Comparison the phlegm cytokines,pulmonary function testing results in the two groups
组别 例数 TNF-α(pg/ml) IL-8(pg/ml) NE(ng/ml) FEV1(L) FEV1/pre(%) FEV1/FVC第一次阳性组 16 8.79±0.37 566.94±54.69 14.35±4.18 1.50±0.64 63.70±24.45 46.60±11.42阴性组 18 5.99±0.85 335.13±43.86 11.38±5.48 1.51±0.77 66.67±32.97 46.94±16.33第二次阳性组 16 7.57±0.23 445.80±36.29 15.12±4.44 1.44±0.60 61.85±34.59 41.80±11.58阴性组 18 6.67±0.24 210.94±26.54 13.22±3.37 1.44±0.73 62.00±23.29 49.08±10.14
3 讨论
本研究结果证实,部分稳定期COPD患者存在LABC,这与国内外的研究结果相同[1,3]。LABC可能与COPD的发病密切相关。健康人下呼吸道无菌有赖于正常完善的机体防御系统。而COPD患者的气道解剖结构及基本反射减弱或消失,患者肺组织病理切片上可以发现气道上皮细胞的纤毛发生粘连、倒伏、脱失,气管壁黏液腺及杯状细胞增生,纤毛上皮破坏等[6]。防御系统的减弱,使上呼吸道定植的细菌移行而来,也可能由外界环境中的致病菌直接感染而成,这可能是细菌定植的病理基础。我们的研究证实下呼吸道细菌定植存在动态变化,认为是机体与细菌处于不同优势状态的结果,也可能与细菌繁殖的周期有关。国外学者认为,COPD稳定期下呼吸道存在的细菌处于持续的周转状态,动态释放出不同浓度的多种产物[7]。
本研究通过对诱导痰液中细胞因子的测定来了解下呼吸道的炎症情况。TNF-α、IL-8、NE是近年来研究较多的细胞因子,反应了气道炎症的程度[8]。而COPD的本质是气道的慢性非特异性炎症,细胞因子的水平与气道的炎症程度相关。研究提示了LABC组较非LABC组痰中TNF-α、IL-8浓度增高,即LABC加重了气道炎症。有研究表明,细菌及其代谢产物使呼吸道上皮细胞产生细胞因子,并因正反馈作用使炎症效应放大[9]。细菌破坏气道上皮,干扰上皮来源的舒张因子的释放,增加气道周围平滑肌的反应性,同时气道黏膜下腺由于受到细菌的侵袭分泌大量黏液。国外学者研究了咳痰与气道炎症,疾病进展和细菌定植之间的关系,发现咳痰组每天的IL-8水平、流感嗜血杆菌和铜绿假单胞菌的定植显著高于无规律咳痰组[10]。这表明细菌定植与气道炎症存在相关性。气道黏液增多及气道平滑肌易于收缩,气道阻力增加是肺功能水平低下的病理基础。存在混合细菌感染,既往多次住院治疗及口服激素的患者肺功能水平最差已得到证实[11]。但我们的研究随访时间短,LABC与肺功能的关系未取得阳性结果。
COPD病因及发病机制极为复杂,LABC是其中重要因素之一。Monso等[1]发现COPD患者稳定期和急性发作期的主要致病菌相同。因此,LABC的研究对于COPD的治疗和预防均有重要意义。
1 Monso E,Ruiz J,Rosell A.Bacterial infection in chronic obstructive airways disease:a study of stable and exacerbated outpatients using the protected specimen brush [J].Am J Respir Crit Care Med,1995,152:1316-1320.
2 Murphy TF.Haemophilus influenzae in chronic bronchitis[J].Semin Respir Infect,2000,15:41 -51.
3 刘建坤,王浩彦,杜晓玲,等.稳定期慢性阻塞性肺疾病下呼吸道细菌定植与气道炎症关系的研究[J].心肺血管病杂志,2007,26(2):11-13.
4 中华医学会呼吸系病学分会慢性阻塞性肺疾病学组.慢性阻塞性肺疾病诊治指南 (2007年修订版) [J].中华结核和呼吸杂志,2007,30(1):7-16.
5 王曾礼.诱导痰在评估气道炎症中的作用 [J].中华结核和呼吸杂志,2000,12:765-768.
6 杨光华.病理学[M].人民卫生出版社,2002:154-156.
7 Sethi S.Bacterial infection in chronic obstructive pulmonary disease in 2000:a state of the Art Review [J].Clin Microbiol Rev,2001,14:336-363.
8 Anthonison NR.The British hypothesis revisited [J].Eur Respir J,2004,23:657-658.
9 Noguesa A,Battles S,Miralles C.Enhanced neutrophil response in chronic obstructive pulmonary disease [J].Thorax,2001,56:432-437.
10 Powile DJ,Wilkinso TM,Donaldsen GC,et al.Chronic sputum production in COPD is a marker for airway inflammation and colonization[J].Eur Respir J,2004,24:306 -307.
11 Lapteva IM.Lung function and bacterial pathogens in sputum of patients with acute exacerbation of COPD [J].Eur Respir J,2004,24:408.

