新疆石榴皮多酚对实验性结肠炎的药效学研究
张 燕 张 红 迪丽胡玛尔 张䶮之*
1.兰州军区乌鲁木齐总医院,新疆乌鲁木齐830000;2.新疆维吾尔自治区中医院,新疆乌鲁木齐830000; 3.新疆医科大学药理教研室,新疆乌鲁木齐830011
石榴 (Punica granatum L.),维吾尔语称“阿娜尔”,是新疆和田、喀什等地特色果品,《本草纲目》记载具有止血解毒功效[1]。近年来因其抗氧化、抗菌抗炎、抗肿瘤、抗粘膜损伤、降糖降脂[2-5]等多种药理学活性成为国内外研究热点。溃疡性结肠炎 (UC)在我国呈逐年上升趋势,是结肠癌的高危因素,被WHO列为现代疑难病之一[6]。本实验观察了PPPE对UC小鼠的抗炎作用并探讨其免疫相关机制,为石榴皮的深入开发提供一定理论依据。
1 材料
1.1 试药 TNBS,50g·L-1,美国Sigma;柳氮磺胺吡啶,上海三维制药;IL-17、IL-4试剂盒,北京福瑞生物公司;豚鼠血清,新疆医科大学实验动物中心提供。
1.2 仪器 赛多利斯电子分析天平、Hair超低温冰箱、山东新华组织匀浆机、UV-2000分光光度计、BIO-RAD酶标仪等。
1.3 动物 健康昆明种 (KM)小鼠,雌雄各半,体重18~22g,新疆医科大学实验动物中心提供。
2 实验方法
2.1 PPPE提取及总多酚含量测定 将新疆叶城县石榴剥皮晒干粉碎、过20目筛,粗粉按料液比1∶20(g∶mL)用体积分数20%乙醇提取,滤液50℃真空浓缩冷冻干燥,得石榴皮多酚黄色粉末。Folin-Ciocalteu法测定,以没食子酸表示的总多酚含量为32.7%。
2.2 动物分组给药 KM小鼠随机分4组,禁食12 h,分别i.g PPPE(500 mg·kg-1·d-1)、阳性对照柳氮磺胺吡啶 (SASP,0.5 g·kg-1·d-1)或等体积去离子水 (空白对照组和TNBS模型组)15 d.在连续给药的第10 d,除空白对照其余各组小鼠乙醚轻度麻醉,用直径2 mm的灌肠器从肛门处插入结肠约4 cm处,注入25 g·L-1TNBS50%乙醇溶液 0.1 m L·10 g-1(分两次间隔12 h),造成结肠炎模型[7]。在连续给药的第11 d,除空白对照组外,每只小鼠腹腔注射5%鸡红细胞悬液0.2 m L进行免疫,各组小鼠在末次给药24 h后取血处死。
2.3 一般情况观察 每隔三日测大鼠体质量、观察粪便性状和隐血情况,参照文献[8]行疾病活动指数评分。
2.4 结肠粘膜损伤指数评分 截取肛门至盲端肠段,沿肠系膜纵行剖开,用预冷的生理盐水迅速冲净,参照文献[9]进行改进见下表,按该表计评各组总分值。

结肠粘膜状况 分值腹腔粘连:无、轻度、中度、重度 分别记0、1、2、3分充血:无、轻度、中度、高度 同上水肿:无、轻度、中度或粘膜粗糙呈颗粒感、高度同上溃疡糜烂:无、轻度、中度、严重糜烂、坏死及溃疡1处最大纵径﹤1cm 分别记0、1、2、3、4分溃疡>1处、溃疡最大纵径每超过1cm、肠壁增厚、穿孔,全段肠壁坏死、中毒性巨结肠、死亡加1分粘连+充血+水肿+溃疡+加分项分值=总分值
2.5 血清溶血素 (SH)测定 取血,1500 r·min-1离心10 min得血清,用生理盐水按1∶100稀释,取稀释血清1 m L,分别加入体积分数5%的鸡红细胞悬液0.5 mL,体积分数10%的豚鼠血清0.5 mL混匀,37℃温育30 min后,0℃冰水中终止反应,1 500 r·min-1离心10min,取上清液于540nm测吸光度值。
2.6 取脾脏、胸腺、结肠称重,计算脏器指数。取部分结肠、脾脏组织10%甲醛固定,石蜡包埋切片HE染色观察组织病理学变化,剩余部分-80℃冷冻备用。
2.7 制备10%结肠组织匀浆,按试剂盒说明书酶联免疫法(ELISA)检测细胞因子IL-4,IL-17水平。
3 结果
3.1 PPPE对疾病活动指数、结肠粘膜损伤指数的影响
模型组小鼠体重下降,大便稀且有粘液便、血便,结肠黏膜出现不同程度的充血、水肿、增厚、糜烂溃疡等,DAI值及CMDI评分显著高于正常组,经PPPE干预后DAI及CMDI明显改善,部分小鼠肠道可见溃疡愈合疤点。结果见表1。
表1 各组DAI及CMDI比较±s,n=8)
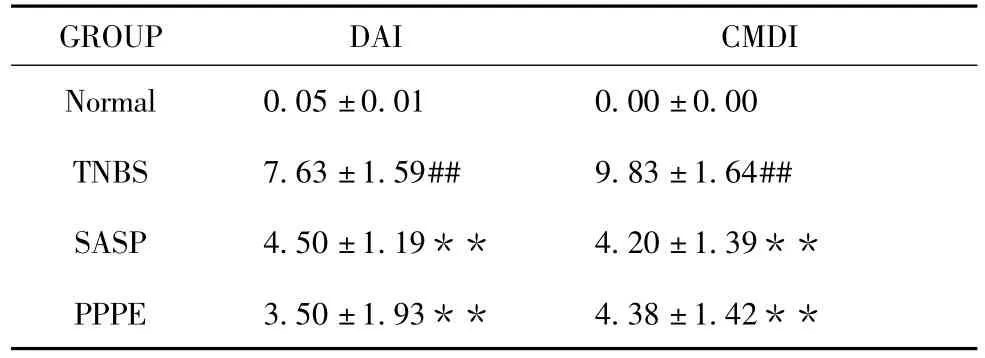
表1 各组DAI及CMDI比较±s,n=8)
与正常对照组比:#;与模型组比较*P<0.05,**P<0.01 (下同)
GROUP DAI CMDI**Normal 0.05±0.01 0.00±0.00 TNBS 7.63±1.59## 9.83±1.64## SASP 4.50±1.19** 4.20±1.39**PPPE 3.50±1.93** 4.38±1.42
3.2 PPPE对脏器指数的影响
模型组肠重指数提高、胸腺指数降低,这与肉眼观察到的模型组有结肠肿大增厚及胸腺明显萎缩相一致。PPPE能降低肠重指数 (P﹤0.05),显著提高脾脏指数但与模型组比较没有统计学差异,这可能与取样时间有关,该时模型组脾脏可能也有代偿性增生。结果见表2。
表2 各组IWI、SI、THI比较±s,n=8)
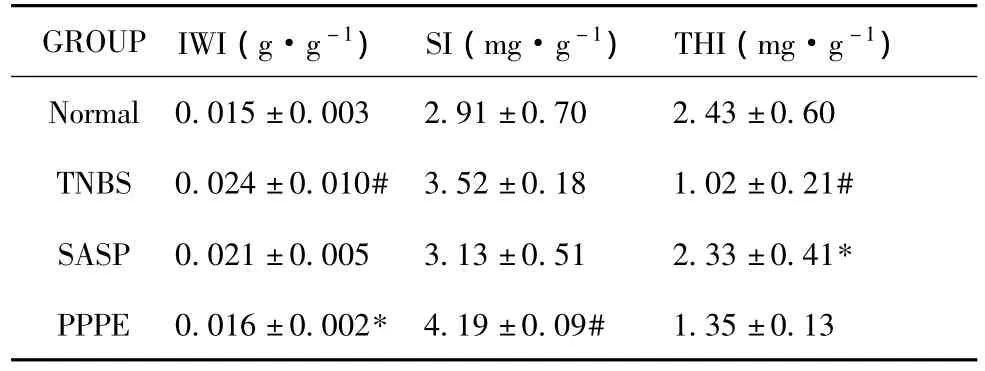
表2 各组IWI、SI、THI比较±s,n=8)
GROUP IWI(g·g-1) SI(mg·g-1) THI(mg·g-1) Normal 0.015±0.003 2.91±0.70 2.43±0.60 TNBS 0.024±0.010# 3.52±0.18 1.02±0.21# SASP 0.021±0.005 3.13±0.51 2.33±0.41* PPPE 0.016±0.002*4.19±0.09# 1.35±0.13
3.3 PPPE对血清溶血素及结肠组织细胞因子的影响
脾细胞生成的抗体在补体存在条件下与抗原结合发生溶血反应,模型组血清溶血素明显降低,IL-17水平增高,SASP组、PPPE组显著升高血清溶血素水平,降低IL-17水平,说明PPPE能提高小鼠体液免疫功能,降低炎性细胞因子水平,结果见表3。
表3 各组血清溶血素及结肠组织细胞IL-17 IL-4含量比较 ±,n=8)
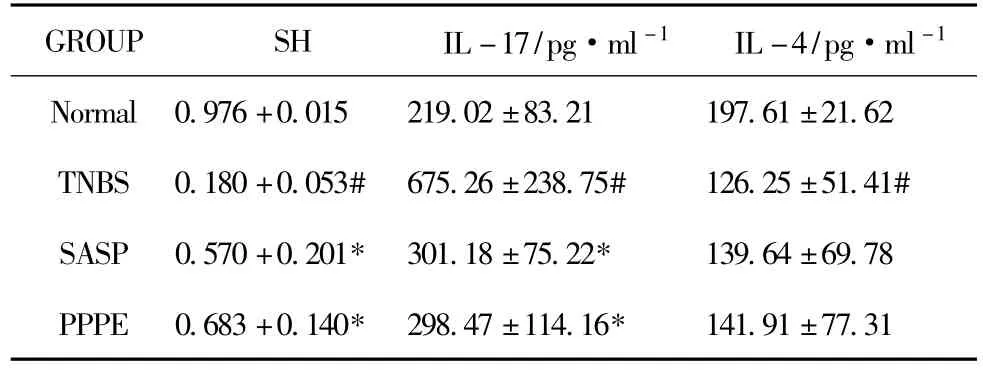
表3 各组血清溶血素及结肠组织细胞IL-17 IL-4含量比较 ±,n=8)
GROUP SH IL-17/pg·ml-1 IL-4/pg·ml -1 Normal 0.976+0.015 219.02±83.21 197.61±21.62 TNBS 0.180+0.053# 675.26±238.75# 126.25±51.41# SASP 0.570+0.201* 301.18±75.22* 139.64±69.78 PPPE 0.683+0.140* 298.47±114.16*141.91±77.31
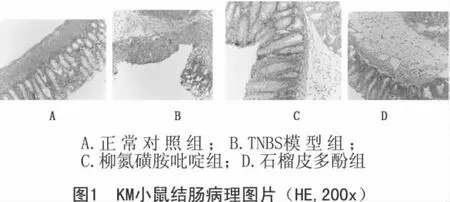
3.4 结肠粘膜组织病理学变化 光学显微镜下可见正常组结肠结构清晰,上皮完整,粘膜层连续、层次明显,杯状细胞丰富,各细胞排列的紧密,腺管结构正常,无炎细胞浸润;模型组上皮细胞严重损坏,黏膜脱落或坏死,黏膜和黏膜下层大量炎症细胞浸润,粘膜下水肿,溃疡形成,腺体坏死;SASP组粘膜连续,粘膜下层少量炎症细胞浸润;PPP组粘膜完整,有水肿,少量炎症细胞浸润,结肠病理状态明显改善。见图1。
3.5 脾脏组织病理学变化 正常对照组结构清楚,白髓中淋巴细胞密集;模型组白髓明显减少,淋巴细胞密集度明显下降;SASP阳性对照组有些区域白髓萎缩,淋巴细胞有减少;PPPE治疗组接近正常。见图2。

4 讨论
本实验对结肠粘膜损伤指数评分方法进行了优化改进,使各项指标清晰明确,每项指标又按程度给予不同层次评分,可操作性增强。研究发现石榴皮多酚对结肠炎症损伤有明显改善作用,其药效可能与下调炎性细胞因子IL-17水平、提高脾脏抗体生成能力有一定关系。阳性对照柳氮磺胺吡啶组一只小鼠出现结肠膨大肿粗现象,有待研究。
目前结肠炎的发病机制尚不完全清楚,但大量研究表明免疫系统异常起着至关重要的作用[10]。近年研究发现辅助型Th17细胞产生的IL-17,很可能在自身免疫性疾病如类风湿关节炎、炎症性肠病中发挥关键性免疫调节作用[11-12],细胞因子IL-17与受体结合后,可通过活化MAP激酶和激活转录因子NF-κB,强大地募集和激活嗜中性粒细胞,诱导活化T细胞和刺激成纤维细胞、上皮细胞、巨噬细胞产生多种促炎介质:IL-1、6、8,TNF-α,NOS-2,单核细胞趋化蛋白-1 (MCP-1)、CAM-1、金属蛋白酶和化学增活素而诱导炎症反应局部化和扩大化,导致自身免疫性损伤甚至促进肿瘤发生和发展[13]。学者推测对抗IL-17可能成为治疗UC的一个新手段,因此按现代作用靶点思路从传统中药中进一步寻找其有效成分对中药现代化开发有重大前景。
[1]本草纲目通释编辑委员会.本草纲目通释[M].下册.北京:学苑出版社,1992,186-188.
[2]Zhang Q,Jia D,Yao K.Anti liperoxidant activity of pomegranate peel extracts on lard[J].Nat Prod Res,2007 Mar,21(3):211-6.
[3]张杰,詹炳炎,姚学军,等.石榴皮对乙型肝炎病毒 (HBV)的体外灭活作用及其临床意义[J].中国民族民间医药,1997,04:29-31.
[4]赖舒,周岐新,张颖,等.石榴皮鞣质对实验性胃损伤的作用[J].中国中药杂志,2009,34(10):1290.
[5]邝宁子,何银,徐真真.石榴皮提取物对大鼠实验性前列腺炎的影响[J].中药材,2009,2:235-237.
[6]陈绍,张晓刚,徐勇,等.溃疡性结肠炎的中西医药物治疗[J].北华大学学报,2004,5(1):34-37.
[7]刘保林,戴媛媛,唐宁,等.吴茱萸氯仿提取物对小鼠溃疡性结肠炎的药效学研究[J].中药药理与临床,2003,19(6):16-17.
[8]RachmilewitzD,KarmeliF,TakabayashiKetal.Immunostimulatory DNA ameliorates experimental and spontaneousmurine colitis[J].Gastroenterology,2002,122:1428-41.
[9]Butzner JD,Parmar R,Bell CJ,etal.Butyrate enema therapy stimulatesmucosal repair in experimental colitis in the rats[J].Gut,1996,38∶568~73.
[10]Xavier R J,Podolsky D K.Unravelling the pat hogenesis of inflammatory bowel disease[J].Nature,2007,448(7 152):427-34.
[11]IwakuraY,IshigameH.TheIL-23/Il-17axisin inflammation[J].Clin Invest,2006,116:1218-1222.
[12]McGovern,DoPowrie F.The IL-23 axis plays a key role in the pathogenesis of IBD[J].Gut,2007,56:1333-1336.
[13]Zhang Z,Zheng M,Bindas J,Schwarzenberger P,Kolls JK.Critical role of IL-17 receptor signaling in acute TNBS-induced colitis[J].Inflamm Bowel Dis,2006,12:382-388.

