摄食水平对泥鳅生长、饲料利用率和体成分的影响
刘姚 王永军 田秀娥 黄雪
泥鳅(Misgurnus anguillicaudatu)原产亚洲,是一种分布很广的温水型底层小型鱼类,具有适温范围广、耐氧低和杂食性等特点[1],其肉质细嫩,味道鲜美,有相当高的营养及药用价值,国际市场称泥鳅为“水中人参”[2]。随着人们生活水平的日益提高和饮食的多元化、健康化,泥鳅在国内外市场上广受欢迎,已出口韩国和日本等国家。市场缺口越来越大,价格持续攀升。
投饵量在鱼类饲养过程中具有双重作用[3],投饵量过低,鱼处于半饥饿状态,生长发育缓慢;投饵量过高,饲料转化效率低,不仅造成浪费,残余饲料会污染水质。在生产实践中,投饵量受各种因素和条件影响,只有正确把握投饵量,才能提高饵料利用率,保证增产增效[4]。其中,摄食水平是确定投饵量的前提,投饵量应与鱼的摄食量相适应[5],在鱼类生物学研究中,许多因素都对鱼类的生长产生影响,其中摄食水平是一个关键变量。为了尽快解决制约安康地区泥鳅规模化、集约化养殖的关键技术问题,我们在前期适度养殖的基础上,进行泥鳅摄食水平的研究,旨在为安康地区泥鳅集约化养殖过程中饵料投喂策略的制定提供基础研究资料,以推动安康泥鳅规模化生产进程。
1 材料与方法
1.1 材料鱼的获得与驯养
试验泥鳅平均体重为(4.81±0.68)g,由陕西省兴平县某渔场购回,经浓度为2~4 mg/l氯霉素溶液处理后,置于室外小型水泥池中暂养15~20 d进行人工驯养,人工驯养采用自制颗粒饲料,其饲料配方及主要营养成分见表1。待泥鳅摄食正常后,再置于水族箱(40 cm×40 cm×50 cm)中驯养7 d,待摄食再一次趋于正常后开始试验。

表1 供试日粮配方及营养成分(%)
1.2 试验设计与试验泥鳅的饲养管理
将180尾供试泥鳅随机分为A、B和C三个不同的摄食水平处理组,每组设3个重复,每个重复20尾泥鳅,三个处理组分别按泥鳅体重的3%、4%和5%投喂供试日粮(见表1)。试验期35 d。试验期内第18 d测定各组鱼体重,相应调整其投喂量,测量当天停食1 d。
试验采用自然光照周期,水族箱遮光处理,水温由加热棒加至试验设定的26℃并控制在(26±2)℃范围内,溶氧>5 mg/l,氨氮浓度<0.05 mg/l,pH值7.0~7.3。试验期间投喂频率为4次/d,投喂时间分别为08:30、14:30、17:30和20:30。
1.3 测定指标与方法
1.3.1 体成分测定
从每一处理组中随机选取30尾(每一重复10尾)泥鳅,养殖试验结束后置于-20℃冰箱保存备用,上述样品分成两份,分别用于试验结束后泥鳅肌肉和全鱼中常规营养成分(干物质、粗蛋白质、粗脂肪和粗灰分)分析测定。样品分析采用国际标准方法[6]。
1.3.2 生长指标计算
特定生长率(%/d)=100×(lnW2-lnW1)/t;
增重率(%)=100×(W2-W1)/W1;
日增重(g/d)=(W2-W1)/t;
饲料转化率(%)=100×n(W2-W1)/F;
肥满度(g/cm3)=100×(W2/L3);
肝体比(%)=100×Wv/W2。
式中:W1——泥鳅初始重(g);
W2——泥鳅末重(g);
t——试验时间(d);
F——摄入饲料的总量(g);
Wv——肝胰脏重(g);
L——体长(cm)。
1.4 数据处理和统计分析
数据均以平均值±标准差表示,用SPSS18.0统计软件One-way ANOVA进行方差分析,并用LSD法及Duncan's法多重比较,P<0.05为差异显著。
2 结果
2.1 摄食水平对泥鳅生长和饲料利用率的影响(见表2)
由表2可知,随着摄食水平的增加,泥鳅的末重、增重率、日增重和特定生长率呈递增的趋势,C组显著高于A组和B组(P<0.05),B组显著高于A组(P<0.05);肥满度各组间无显著差异(P>0.05);肝体比呈递增趋势,C组显著高于A组和B组(P<0.05),A组和B组无显著差异(P>0.05);饲料转化率随摄食水平的增加呈先增后减的趋势(见图1),B组显著高于A组和C组(P<0.05),C组显著高于A组(P<0.05)。特定生长率—摄食水平回归曲线见图2,其方程为y=0.293 3x-0.133 6(R2=0.998 8)。维持摄食率(maintenance ration)是鱼类用于维持基本生理生化活动的最低摄食率,即鱼体重既不增加也不减少(SGR=0)的摄食水平,由上式可计算得出泥鳅的维持摄食率0.46%。

表2 摄食水平对泥鳅的生长状态的影响

图1 饲料转化效率与摄食水平变化的关系

图2 特定生长率与摄食水平变化的关系
2.2 摄食水平对泥鳅体成分的影响
2.2.1 摄食水平对泥鳅肌肉生化成分的影响(见表3)

表3 摄食水平对泥鳅的肌肉生化组成影响(%)
表3结果显示,肌肉水分和灰分含量随着摄食水平的增加而减少,且灰分含量B和C组显著低于A组(P<0.05),但水分含量各组无显著性差异(P>0.05);粗蛋白和粗脂肪含量随着摄食水平的增加而增加,且粗脂肪含量B组和C组显著高于A组(P<0.05),但粗蛋白含量各组无显著性差异(P>0.05)。
2.2.2 摄食水平对泥鳅全鱼生化成分的影响(见表4)表4结果显示,全鱼水分和灰分含量随着摄食水平的增加而减少,粗蛋白和粗脂肪含量随着摄食水平的增加而增加,但各组间无显著性差异(P>0.05)。
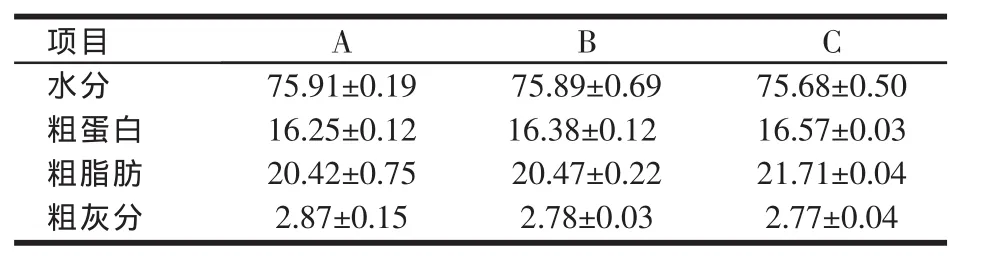
表4 摄食水平对泥鳅的全鱼生化组成的影响(%)
3 讨论
3.1 摄食水平对泥鳅生长的影响
在很多肉食性和杂食性鱼类研究中,生长率与摄食水平关系主要有两种类型:一是减速增长曲线[7],另一种为线性关系[8]。有研究表明,真鲷[9]、黑鲪[10]的生长—摄食关系为曲线增长;异育银鲫[11]、军曹鱼[12]、杂交鲟[13]生长—摄食关系为线性增长。Cui等[14]指出,较多的鱼类湿重生长—摄食关系为曲线关系。因此,提出了鱼类湿重生长—摄食关系为直线的最大摄食率限制假设:在最大摄食水平条件下,由于环境条件限制或食物能量密度较低,使鱼类的摄食率或吸收率比较低,但鱼类仍然可维持较高的转化效率。本试验的研究表明,泥鳅的特定生长率与摄食水平之间为显著的线性关系,摄食水平与特定生长率的方差分析表明,摄食水平对特定生长率的影响显著(P<0.05)。这说明泥鳅随摄食水平的增加,其特定生长率增加更明显,生长更迅速。
3.2 摄食水平对泥鳅饲料转化效率的影响
有研究表明,鱼类在中间摄食水平时饲料转化效率最大[15-16],也有研究表明,罗非鱼饲料转化效率随摄食水平上升而下降[17];另一研究发现,随着摄食水平的上升,草鱼[18]、黄颡鱼[19]的饲料转化效率呈增加趋势。研究结果不同,可能与鱼种差异和饲料品质有关,也可能与摄食范围较窄、未达到最低或最高转化效率有关[20]。本试验结果表明,泥鳅的饲料转化效率在摄食水平为4%时达到最高值,即在中间摄食水平时转化效率最大(39.16%)。与其他鱼类相比,其转化效率相对较低,这可能与泥鳅本身习性有一定关系。泥鳅是无胃鱼,排空速度很快,其肠道通常前半段用来消化食物,后半段用来呼吸,饵料在肠道中消化时间很短;再加上泥鳅为舔食性鱼类,投饵时不能立即吃掉,因此使一部分饵料在水中溶失。这些可能是泥鳅饵料转化效率低的原因,当然得到这种结果可能还与试验条件、鱼体大小、饵料选择等其他因素有关,有待进一步考查。
3.3 摄食水平对泥鳅肌肉、全鱼生化组成的影响
泥鳅的肌肉、全鱼中水分和灰分含量随着摄食水平的增加而减少,且肌肉中灰分含量B和C组显著低于A组(P<0.05),其他各组间无显著性差异(P>0.05);粗蛋白和粗脂肪含量随着摄食水平的增加而增加,且肌肉中粗脂肪含量B和C组显著高于A组(P<0.05),其他各组间无显著性差异(P>0.05)。
[1] 王伟伟.泥鳅的生物学特性和人工繁殖及苗种培育[J].北京农业,2009(02):44-46.
[2] 刘孝华.泥鳅的生物学特性及养殖技术[J].湖北农业科学,2008(47):93-95.
[3] 王吉桥,隋晓楠,顾公明,等.不同饲料搭配及投喂量对仿刺参稚、幼参生长和成活的影响[J].水产科学,2008,27(02):55-58.
[4] 韩道富,谢遵华,赵秀贞.养鱼应准确把握投饵量[J].齐鲁渔业,2003,20(08):18.
[5] 潘华东.浅谈如何正确掌握家鱼的投饵量[J].科学养鱼,2003(8):53.
[6] 张丽英.饲料分析及饲料质量检测技术[M].第2版.北京:中国农业出版社,2003.
[7] Allen J R,Wootton R J.The effects of ration and temperature on thegrowthofthethreespinedstickleback,gasterosteus aculeatus L[J].J.Fish Bio.,1982,20:409-422.
[8] Boehlert G W,Yoklavich M.Effects of temperature,ration and fish size in growth of juvenile black rock fish[J].Environmental Biology Fish,1983,8:17-28.
[9] 孙耀,张波,郭学武,等.日粮水平和饵料种类对真鲷能量收支的影响[J].海洋水产研究,1999,20(02):60-65.
[10] 孙耀,张波,唐启升.摄食水平和饵料种类对黑鲪能量收支的影响[J].海洋水产研究,2001,22(02):32-37.
[11] 朱晓鸣,解绶启,崔奕波.摄食水平对异育银鲫生长及能量收支的影响[J].海洋与湖沼,2000,31(5):471-479.
[12] 孙丽华,陈浩如,黄洪辉,等.摄食水平和饵料种类对军曹鱼幼鱼生长及氮收支的影响[J].热带海洋学报,2010,29(4):94-101.
[13] 郝世超,黄璞祎,于洪贤.摄食水平对杂交鲟生长的影响[J].东北林业大学学报,2008,36(12):43-45.
[14] Cui Y B,Hung S S D,Zhu X M.Effect of ration and body size on the energy budget of juvenile white sturgeon[J].J.Fish Bio.,1996(49):863-876.
[15] Brett J R,Groves T D D.Physiological energetic[A]//Hoar W S,Randall D J,Brett J R.Fish Physiology(Vol.V)[C].New York:Academic Press,1979:279-352.
[16] Jobling M.Fish Bioenergetics[M].London:Chapman and Hall,1994:309.
[17] Meyer-Burg dorff K H,Osman M F,Gunther K D.Energy metabolism in oreochromis niloticus[J].Aquaculture,1989,79:283-291.
[18] Cui Y,Chen S,Wang S.Effect of ration size on the growth and energy budget of the grass carp,ctenopharyngodon idella Val[J].Aquaculture,1994,123:95-107.
[19] 杨严鸥,姚峰,郑建忠,等.摄食水平对黄颡鱼生长和饲料利用效率的影响[J].饲料工业,2006,27(12):30-32.
[20] 杨严鸥.摄食水平对淡水白鲳生长和饲料利用效率影响的研究[J].湖北农学院学报,2001,21(03):229-231.

