热休克蛋白HSP60基因在耐药白血病中的表达研究
雷博
多药耐药(MDR)[1]是白血病化疗失败的主要原因,目前已知的多药耐药机制还不能完全解释白血病的MDR现象,因此发现新的耐药相关且共表达的基因是揭示白血病MDR机理、改善化疗效果和预后的迫切需要。我们实验室应用改良的消减杂交技术以急性白血病耐药细胞系(HL60/VCR)和敏感细胞系(HL60)为研究对象建立了急性白血病多药耐药相关消减cDNA文库[2],筛选出23条表达有差异的基因,经查阅文献和生物信息学分析,本实验从中选取热休克蛋白HSP60基因作为进一步的研究对象,应用荧光定量RT-PCR的方法在临床病例中进行检测,以分离和确认新的白血病耐药相关基因。
1 材料和方法
1.1 临床资料
白血病患者39例,选自2008年11月~2009年11月西安交通大学第二附属医院血液科住院病人,均在本院血液实验室经FAB形态学、免疫学、细胞遗传学的MIC分型确诊,符合造血组织肿瘤新WHO分类标准。其中非淋巴细胞白血病23例(化疗敏感者17例,耐药者6例),淋巴细胞白血病13例(化疗敏感者7例;耐药者6例),急性混合细胞白血病1例(为耐药者),多发性骨髓瘤2例(化疗敏感者1例,耐药者1例)。男性20例,女性19例,中位年龄35岁(5~75岁)。同时以6名健康人为对照组,男4例,女2例,中位年龄28岁。(临床耐药诊断标准参阅1997年全国难治性白血病研讨会所制定的诊断标准。)
1.2 骨髓和外周血细胞HSP60mRNA表达的实时荧光定量RT-PCR检测抽取样本骨髓(临床患者)或外周血(正常健康人),用淋巴细胞分离液(天津灏洋生物制品公司产品)分离单个核细胞,抽提细胞总RNA,用紫外吸收测定法检测 RNA浓度和纯度,变性琼脂糖凝胶电泳,紫外透射光下观察并拍照。5μg总RNA经逆转录合成cDNA(MBI公司产品),逆转录反应为70℃5分钟,42℃1小时、70℃10分钟,cDNA溶液储存于-80℃备用。HSP60及内参β-actin的扩增引物见表1,引物由上海生工生物技术有限公司合成。
按照SYBR Premix real time PCR Mix(AmpliQ公司)试剂说明检测HSP60和内参β-actin的mRNA表达水平,使用 AB I GeneAmp5700 real time PCR仪完成real time PCR反应。PCR反应条件为:94℃预变性5分钟,然后按94℃30秒,62℃1分钟,72℃1分钟,35个循环,最后72℃延伸10分钟。对每一样本同时进行3个PCR反应检测,PCR产物在1.2%琼脂糖凝胶电泳,GoldViewTM染色,以检测PCR产物是否为单一特异性扩增条带。
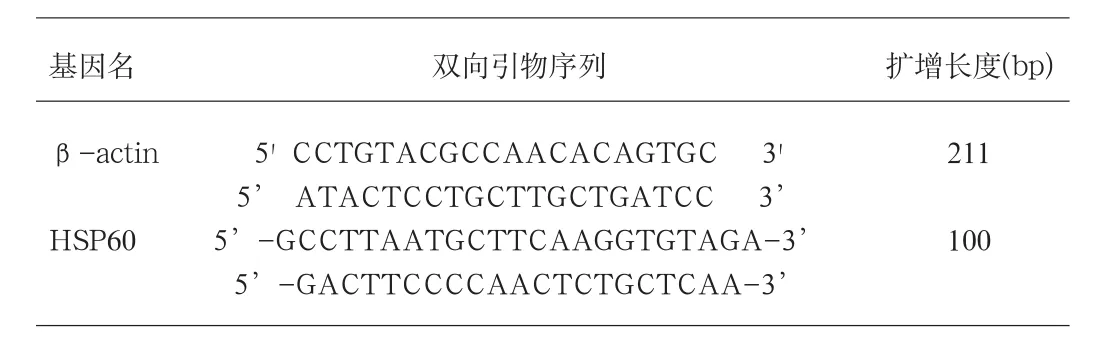
表1 引物列表
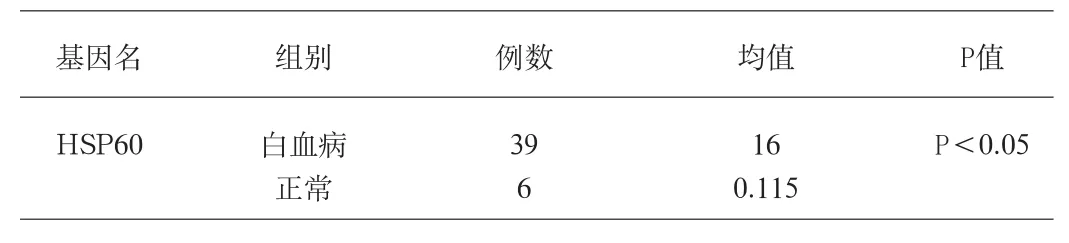
表2 白血病组与正常对照组HSP60基因表达的比较

表3 耐药与敏感组HSP60基因表达的比较

表4 HSP60基因在AML与ALL中表达的比较
本研究用比较Ct值相对定量法检测mRNA表达水平,应用公式为:①根据靶基因和内参照基因的标准曲线用公式Y=101 /△Ct(△Ct等于靶基因每稀释10倍时,平均增加的Ct数)分别计算两者Ct值每减少1个循环时对应的模板DNA的增加倍数,求出Y值;②靶基因的相对含量,公式为:Y靶Ct靶基因均值-Ct靶基因(Ct靶基因平均值表示所有样本中靶基因的Ct值的均数,Ct靶基因表示不同个体样本的靶基因Ct值);③用同一个体的内参β-actin对其HSP60的mRNA表达水平做标准化处理,代表这1个个体白血病细胞中靶基因的表达水平,公式为:Y靶标准化=Y靶/Yβ-actin。比较标准化后各组HSP60mRNA的相对表达水平。
1.3 统计学方法
荧光定量PCR结果采用SPSS13.0统计软件分析,原始数据用Excel录入,用Kruskal-wallis H检验,组间比较用Mannwhitney U检验,检验水准α=0.05。
2 结果
实时荧光定量RT-PCR结果对所提取总RNA经分光光度计检测,其A260/A280比值均在1.8..2.1之间,经2%琼脂糖凝胶电泳鉴定,溴化乙锭染色,28S、18S、5S带清晰可见,无明显降解。根据靶基因和内参照基因β-actin的标准曲线用公式Y=101/△Ct,计算β-actin和HSP60的Y值近似相同约为2.15。表示各基因Ct值减少1个循环对应的模板DNA的增加倍数为2.15倍。既然Y值近似相等,那么可以应用简化公式2.15Ct内参照基因-Ct靶基因来计算每一样品每一基因的相对含量,最终得到的值即为此样品此基因的校正后的相对含量。
从表2可以看出HSP60基因在AL和正常组中的表达量有显著性差异,白血病组mRNA的表达明显高于正常组;从表3可以看出HSP60基因在耐药和敏感组中的表达量有统计学意义,耐药组明显高于敏感组;从表4可以看出HSP60基因在ALL和AML患者中的表达,没有明显差异。
3 讨论
在白血病的治疗中MDR已成为阻碍其疗效的一个重要问题,对各种耐药机制作用的深入研究必将有利于提高化疗疗效。既往研究已发现了很多耐药机制,但以这些分子作为靶点的耐药逆转研究目前仍存在许多难以克服的问题,继续寻找新的耐药分子靶点仍是当前研究的重点。
热休克蛋白HSP是普遍存在于生物体细胞中的一组高度保守的蛋白质,平时表达量很低,在理化因素、病原体及细胞恶变等应激状态下合成量增加。热休克蛋白的生物学功能广泛,主要通过在应激状态下保护细胞生命活动必需的蛋白质以维持细胞生存,增加细胞耐受性和抗凋亡能力。在肿瘤细胞内,热休克蛋白的大量表达可能由于肿瘤细胞的不断增殖需要HSP作为分子伴侣来调节和稳定这一增殖过程[3]。一方面HSP可与多种原癌基因相互作用,影响细胞周期,调节细胞增殖;另一方面介导错配蛋白的降解,协调肿瘤细胞的蛋白质快速代谢平衡,使肿瘤细胞得以无限增殖。此外,HSP在肿瘤细胞的抗凋亡过程中发挥着重要作用[4]。正常细胞中仅表达少量HSP参与细胞生长代谢,并受细胞周期的严格调控,而肿瘤细胞即使在无应激条件下,也能独立于细胞周期持续高表达HSP,在维持细胞的永生性上起作用。HSP作为分子伴侣在正常细胞中发挥抵抗应激的保护作用,在肿瘤细胞中则表现为对化疗的耐受性增强,可能与白血病细胞的多药耐药有关。HSP70、HSP27[5]已有研究证明与AL耐药相关,而HSP60[6]作为热休克蛋白的主要成员其与肿瘤耐药的研究报道很少。本实验检测结果表明:HSP60基因在AL耐药组、敏感组和正常对照组间有显著性差异;白血病组高于正常对照组,与研究报道一致;耐药组高于敏感组,P<0.05。ALL患者HSP60mRNA的表达水平高于AML患者,但结果不具有统计学意义。
总之,本实验从cDNA文库中选取热休克蛋白HSP60,研究其在临床病例中的表达情况,在临床上对AL患者提供化疗效果、评判预后和指导个体化治疗的实验室和理论依据,同时筛选出新的MDR相关基因,为发现白血病MDR发生的新机制和逆转耐药治疗提供新的途径和靶点。
[1]Norgaard JM,Olesen LH,Hokland P.Changing picture of cellular drug resistance in human leukemia[J].Crit Rev Oncol Hematol,2004,50(1):39-49.
[2]吉蕾,张王刚,药立波,等.急性白血病多药耐药相关消减cDNA文库的构建与鉴定[J].中国实验血液学,2004;12(4):431-435.
[3]Cha Cardoso F,Di Leo A,Larsimont D,et al.Evaluation of HER2,p53,bcl-2,topoiso- merase II-alpha,heat shock proteins 27and 70 in primary breast cancer and metastatic ipsilateral axillary lymph nodes[J].Ann Oncol,2001,12(5):615-620.
[4]Xavier Thomas.Expression of heat-shock proteins is associ-ated with major adverse prognostic factors in acute myeloid leukemia[J].Leukemia Res,2005(29):1049-1058.
[5]uhan D,Saxena S,Anderson K C,et al.Hsp27 inhibits release of mitochondrial protein Smac in multiple myeloma cells and confers dexamethasone resistance[J].Blood,2003,102(9):3379-3386.
[6]Cappello F,David S,Rappa F,et al.The expression of HSP60 and HSP10 in large bowel carcinomas with lymph node metastase[J].BMC Cancer,2005,5-39.
——过敏性休克和肺水肿的抢救流程

