层状固体酸H2Ti6O13的制备与性能研究
刘义章
(1.安徽理工大学 化工学院,安徽 淮南232001;2.滁州职业技术学院,安徽 滁州 239001)
层状纳米光催化剂是由某种特定的结构单元通过共用角、边、面堆积而成的空间网状结构[1]。层状化合物可应用在催化、固相质子或电子导体、特异性吸附剂、高性能工程材料、环境保护等许多领域[2]。层间存在可移动的离子或中性分子,可通过离子交换、预撑和柱撑对其进行改性。本次实验研究层状固体酸的结构与酸性特征。
1 实验部分
1.1 药品及仪器
TiO2(A.R.汕头市西陇化工有限公司);K2CO3(A.R.天津市福晨化学试剂厂);2.0mol·L-1的硝酸(A.R.上海中试化工总公司);H2SO4(A.R.上海苏燃化学试剂有限公司)。
KQ-200KDB超声波清洗器(昆山市超声仪器有限公司);KS6-63-160程序控制箱式电炉(上海意丰电炉有限公司);202A-1烘箱(电热恒温干燥箱,上海意丰电炉有限公司);D/max-3BX射线衍射仪(日本理学制造);TU-1901型双光束紫外-可见分光光度计(带IS19-l积分球,BaSO4为参比标准白板)(北京普析通用仪器有限公司);TP-5080全自动吸附仪(天津先权工贸发展有限公司)。
1.2 固体酸的制备
采用高温固相法合成层状K2Ti6O13,通过与无机酸交换,制备得到柱撑H2Ti6O13。
将TiO2和K2CO3按照6∶1的计量比混合研磨1h后,用水调成糊状后于超声波清洗器中以80%的功率超声30min,在373K下干燥10h,再研细后送入程序控制箱式电炉中,以5K·min-1的升温速度升到1353K,恒温24h,冷却到室温后研磨30min,用去离子水洗至中性,放入烘箱中干燥后,制得K2Ti6O13。
取 K2Ti6O132.0g 加入到 60mL 2.0mol·L-1中,与333K下连续搅拌12h,抽滤分离后在同样的条件下用H2SO4溶液交换3次。抽滤后于353K下干燥5h,得到H2Ti6O13固体酸。
1.2 样品的表征
X-射线粉末衍射(XRD):射线衍射仪上进行;Cu 靶,Ka 0.15406nm,Ni滤波片,管压 36kV,管电流30mA,步宽=0.02度。紫外-可见漫反射光谱(UV-vis-DRS):采用TU-1901型双光束紫外-可见分光光度计上进行。程序升温脱附(NH3-TPD):使用TP-5080全自动吸附仪,从10℃·min-1升温到160℃,然后恒温活化60min,降温到60℃,最后以10℃·min-1的升温速度升到800℃进行脱附,通惰性气体的速率为80mL·min-1。
2 结果与讨论
2.1 X-射线粉末衍射(XRD)谱图分析
样品K2Ti6O13的XRD谱图见图1。

图1 K2Ti6O13的X射线衍射图Fig.1 XRD patterns of K2Ti6O13
对照JCP-DS标准卡片可以确定样品为单斜晶型(No.74-0275)。图 1 中 2θ=9.80、19.76、29.34°分别对应于 K2Ti6O13的(001)、(002)、(003)的晶面衍射花样,结果表明所制备的样品具有典型的层状结构。2θ=13.78、21.04、30.00、43.02°分别对应于催化剂的(201)、(202)、(203)、(404)晶面衍射峰。XRD谱图具有尖锐的衍射峰,表明所指的样品K2Ti6O13结晶度高。
根据布拉格公式λ=2dsinθ来计算出K2Ti6O13的(203)晶面2θ=30.00°对应的晶面间距为0.298nm。
固体酸H2Ti6O13的XRD谱图见图2。
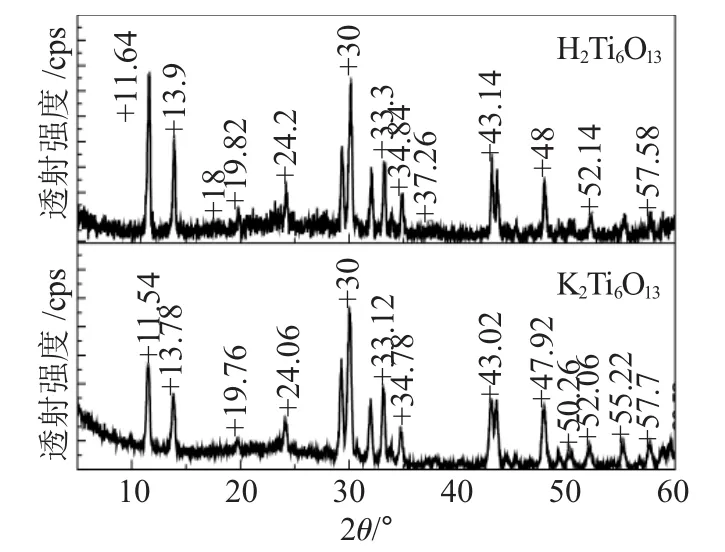
图2 H2Ti6O13的X射线衍射图Fig.2 XRD patterns of H2Ti6O13
由图 2 知,H2Ti6O13在 2θ=9.94°和 2θ=11.64°出峰,而 K2Ti6O13在 2θ=9.8°和 2θ=11.54°出峰。比较两个样品,H2Ti6O13的峰形与K2Ti6O13的基本相同,只是出峰的度数往后移了0.1°左右。出现这种结果原因是:K2Ti6O13呈隧道式结构,K+完全被以Ti为中心的TiO6八面体包围住,固定在八面体组成的隧道中间,无法突破这种特殊的隧道结构而溶出,致使H+不能把它交换出来[5]。
2.2 样品对光谱的响应特征
通过紫外-可见漫反射(UV-vis-DRS)测定其对光谱的响应特征。结果见图3。
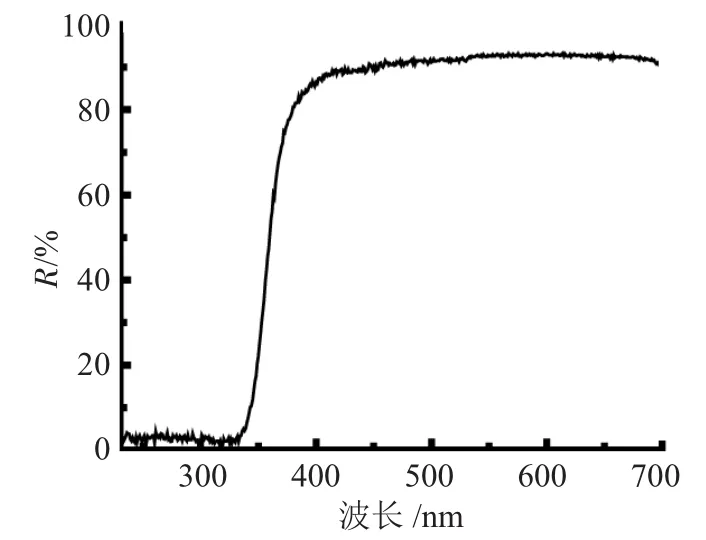
图3 样品K2Ti6O13的紫外-可见漫反射图谱Fig.3 Diffuse reflectance UV-Vis spectra of K2Ti6O13
图3中显示K2Ti6O13在紫外区域存在着连续的宽紫外带吸收,其吸收带边出现在355nm。
2.3 催化剂的酸性表征
利用程序升温脱附法(NH3-TPD)对催化剂H2Ti6O13的酸性进行表征,测出催化剂的总酸量。
催化剂利用程序升温脱附法(NH3-TPD)对催化剂H2Ti6O13的酸性进行表征,通过NH3-TPD的测试可得出催化剂的总酸量。催化剂H2Ti6O13先从室温以10℃·min-1的升温速率升温到160℃,然后恒温活化60min,降温到60℃,最后以10℃·min-1的升温速率升到800℃进行升温脱附,通惰性气体的速率为80mL·min-1。催化剂H2Ti6O13的NH3-TPD吸附曲线见图4。
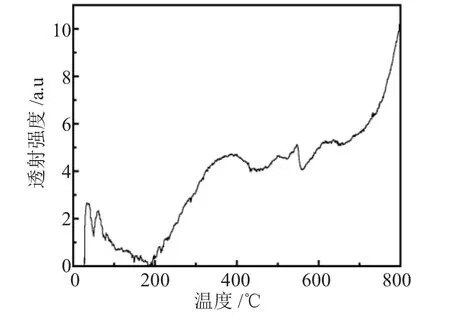
图4 催化剂H2Ti6O13的NH3-TPD曲线图Fig.4 NH3-TPD patterns of H2Ti6O13
在图4中H2Ti6O13有两个NH3脱附峰,而且峰强度很弱,说明了催化剂表面酸量少;催化剂的出峰分别在386℃和546℃,从而表明H2Ti6O13的表面酸强度是中等强度。造成这种结果的原因跟催化剂的前驱物K2Ti6O13的结构特征有关,如上图XRD分析的一样,H+不能进入TiO6把K+交换出来,导致H2Ti6O13的表面酸量少。
3 结论
通过催化剂的表征对层状固体酸的结构、光谱特性和酸性分析研究。得出以下结论:
(1)由高温固相法合成的K2Ti6O13是典型的纳米级层状化合物,其(203)晶面2θ=30.00°对应的晶面间距为0.298nm。
(2)催化剂H2Ti6O13的XRD图与K2Ti6O13的峰形基本相同。
(3)样品的漫反射光谱图显示K2Ti6O13的吸收边带出现在355nm左右。
(4)催化剂H2Ti6O13的表面酸量少,表面酸强度是中等强度。
[1]赵娟,刘士军,李洁,陈启元.钇掺杂WO3的制备及光催化分解水析氧活性[J].中国有色金属学报,2008,18(2):330-335.
[2]刘亚琴,徐耀,李志杰,等.CO2在纳米SiO2/TiO2悬浮体系中的光催化还原[J].化学学报,2006,64(6):11-15.
[3]何杰,范以宁,邱金恒.负载型Nb2O5对异丁烯/异丁醛缩合生成2,5-二甲基-2,4-己二烯的催化性能[J].石油学报(石油加工),2006,22(4):18-24.
[4]刘守新,孙承林.金属离子的光催化去除研究进展[J].化学通报,2004,(12):32-37.
[5]徐艳姬.K2Ti6O13晶须的制备、生长机理及微结构研究[D].2005,(10):4-5.

