变异链球菌的 htr A和 clpP基因对其生长和饥饿耐受的影响
王 拓,于丹妮,季晓黎,任志明,李 娜,韩育植
(天津:1.天津医科大学第二附属医院,300211;2.天津医科大学研究生学院 2009级,300070)
变异链球菌 (Streptococcusmutans,变链菌)目前被认为是人类最重要的龋病病原菌之一,在龋病病人口腔中检出率较高[1]。其形成生物膜和耐受环境刺激的能力被认为是其主要的致病因素,如何抑制变链菌的致病因子,减少其致病性,是龋病研究中的课题之一。变异链球菌的强致龋力与其糖代谢的特点和对牙面的粘附能力有关,而且牢固的粘附于牙面并形成生物膜是产生龋蚀的关键步骤,阻断或干扰该菌对牙面的粘附及代谢糖分产酸的任何一方面都能对龋病的减少和预防起到一定的作用。近年有研究发现,htrA基因和 clpP基因是细菌的两种非常重要的基因,它们分别编码的Htr A(High temperature requirement A,高温需要 A蛋白酶)和 ClpP(caseinolytic protease P,酪蛋白裂解酶)都是丝氨酸蛋白酶家族的重要成员,可通过对蛋白酶原的激活或抑制起调节因子的作用,在生物有机体中起着重要的生理作用[2-3]。本实验通过观察变链菌的标准株和 htr A-clpP双基因缺陷株在不同营养环境中的生长变化情况,并比较两种菌株生长特征的差异,以探讨 HtrA和 ClpP这两种蛋白酶在变链菌的生长能力方面所起的作用,为防龋研究提供一定的实验依据。
1 材料和方法
1.1 主要材料和仪器
变链菌 Ingbritt C(血清 c型)国际标准株 (以下简称标准株,四川大学口腔医学研究所);htr A-clpP双基因缺陷株 (以下称ΔhtrA-clpP,由本实验室成功构建并保存)[4];隔水式电热恒温厌氧箱(WGP-600,上海);离心机 (上海安亭科学仪器厂);微量加样器(Eppendod公司,德国);酶联免疫检测仪(sunrise tecan,奥地利);标准 96孔板(Costor,美国);TPY培养基(OXO ID,英国)。
1.2 方法
1.2.1 两种菌株在含糖和无碳源环境下生长情况检测
将 -20℃条件下甘油保存的变链菌的标准株和ΔhtrA-clpP两种菌株从冰箱中取出,各取400μL分别接种于 10 mL TPY培养基中,置 37℃微需氧条件下过夜培养,进行复苏及增菌。次日取各菌株的菌液以 5 000 r/min的转速离心 10 min,弃上清,沉淀部分用 500μL生理盐水稀释,混匀后,各取 100μL接种于 96孔板(一式 3份),用酶联免疫检测仪于 600 nm下测定初始吸光度值(A)。然后,再将上述两菌株稀释液分别用 10 mL已灭菌的含有 10 g/L葡萄糖及无碳源的 TPY培养液配制成 600 nm条件下吸光度值为 0.01的菌悬液,置37℃温箱中微需氧条件下培养。然后以 2 h为间隔,分别取两菌株不同培养基培养的菌各 500 μL加入 1.5mL EP管中(剩余菌液仍放入温箱中继续培养)混匀后,再从中各取 100μL接种于 96孔板,各菌株各营养环境菌液均一式 3份,另外,将管中剩余的菌液离心 5 min(5 000 r/min),取 100 μL上清液接种于 96孔板分别作为各菌株的空白对照,用酶联仪于 600 nm下测定各菌液的吸光度值,并绘制各菌株在各生长条件下的生长曲线[5]。
1.2.2 两菌株对葡萄糖消耗量的测定
在各时间点测定 A值 (600 nm)的同时,取10 g/L葡萄糖条件下培养的两菌株培养液, 5 000 r/min离心 5min,取上清液用于葡萄糖氧化酶试剂盒测定各菌株葡萄糖消耗情况。
1.3 统计分析
采用 SPSS 13.0软件对不同营养条件下生长的两种菌株生长情况 (A值)以及培养液中的葡萄糖剩余量进行单因素方差分析,两两比较用S-N-K检验,检验水准α=0.05。
2 结果
2.1 两菌株在含糖和无碳源环境生长情况比较
标准株和ΔhtrA-clpP两种菌株分别在含葡萄糖培养基及无碳源培养基中生长周期大致分为对数期和平台期(图 1,表 1)。在含葡萄糖的培养基中ΔhtrA-clpP生长的对数期时间缩短,在 6 h左右结束,标准株的对数期在 8~9 h结束,且ΔhtrA-clpP在对数期前期(6 h之前)的生长较标准株快,差异有统计学意义 (P<0.05),而标准株的峰值以及平台期的 A值均明显高于缺陷株高(P<0.05)。在无碳源培养基中培养时,缺陷株和标准株的对数期分别持续了 8 h和 10 h,在 4 h之前两种菌株生长情况无差异 (P>0.05),4~8 h期间缺陷株生长较标准株快,差异有统计学意义(P<0.05),标准株在平台期的 A值及峰值都较缺陷株高(P<0.05)。并且经单因素方差分析可知两种菌株在葡萄糖条件下生长各个时期A值均明显高于该株在无碳源条件下的 A值,差异均有统计学意义(P<0.05)。
2.2 两菌株葡萄糖消耗量比较
标准株和ΔhtrA-clpP两种菌株在含 10 g/L葡萄糖的培养基中生长时各个时间点葡萄糖剩余量比较(图 2,表 2),在整个生长期间标准株对葡萄糖的消耗量均明显低于缺陷株 (P<0.05),缺陷株在 16 h即将葡萄糖完全耗尽,而此时标准株所在的培养基中仍有少量葡萄糖剩余。
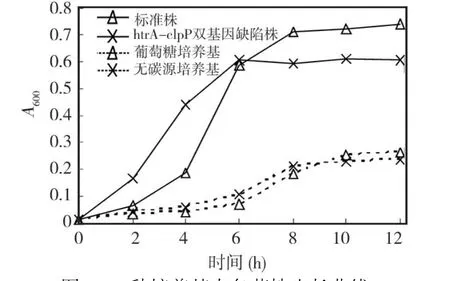
图1 2种培养基中各菌株生长曲线
表1 标准株和ΔhtrA-clpP在两种培养基中的生长情况 (A600,±s)
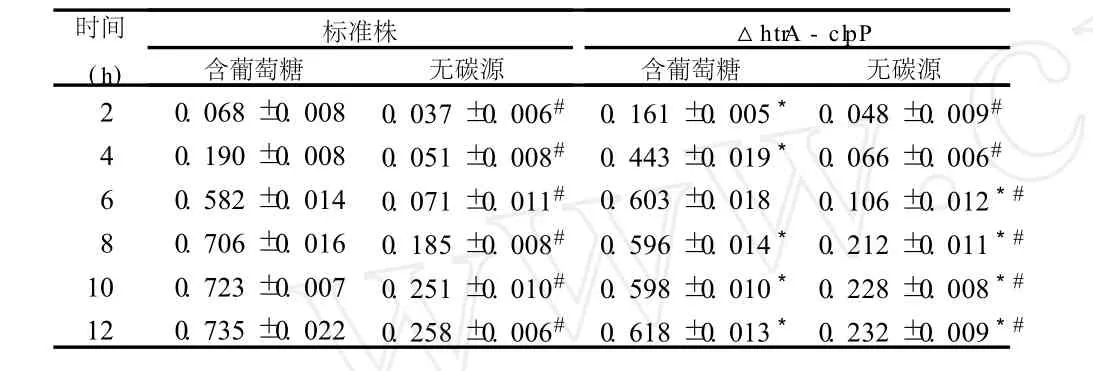
表1 标准株和ΔhtrA-clpP在两种培养基中的生长情况 (A600,±s)
*与同等条件下培养的标准株相比 P<0.05;#与葡萄糖条件下生长的相同菌株相比 P<0.05
时间(h)标准株含葡萄糖 无碳源△htr A-clpP含葡萄糖 无碳源2 0.068±0.008 0.037±0.006# 0.161±0.005* 0.048±0.009# 4 0.190±0.008 0.051±0.008# 0.443±0.019* 0.066±0.006# 6 0.582±0.014 0.071±0.011# 0.603±0.018 0.106±0.012*# 8 0.706±0.016 0.185±0.008# 0.596±0.014* 0.212±0.011*# 10 0.723±0.007 0.251±0.010# 0.598±0.010* 0.228±0.008*# 12 0.735±0.022 0.258±0.006# 0.618±0.013* 0.232±0.009*#
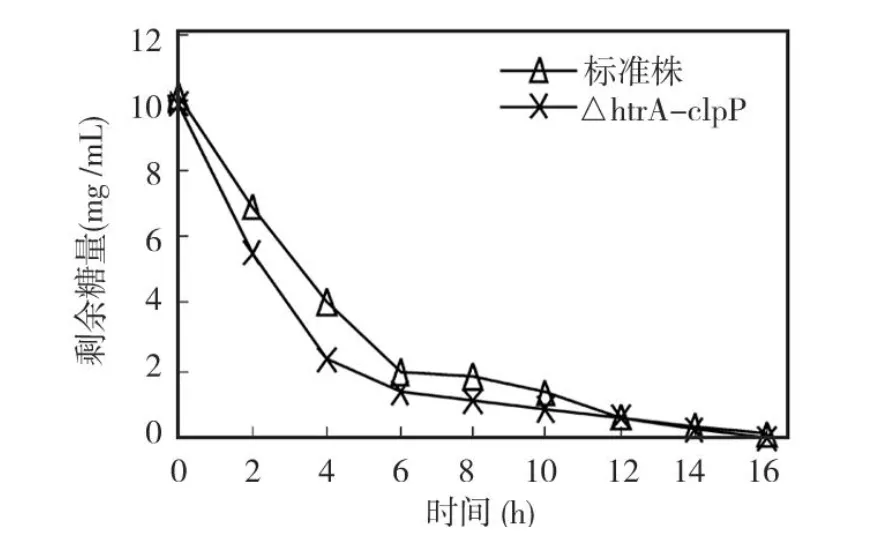
图2 各菌株培养液中葡萄糖剩余量
表2 标准株和Δhtr A-clpP生长过程中培养基中葡萄糖的剩余量比较 (mg/mL-1,±s)
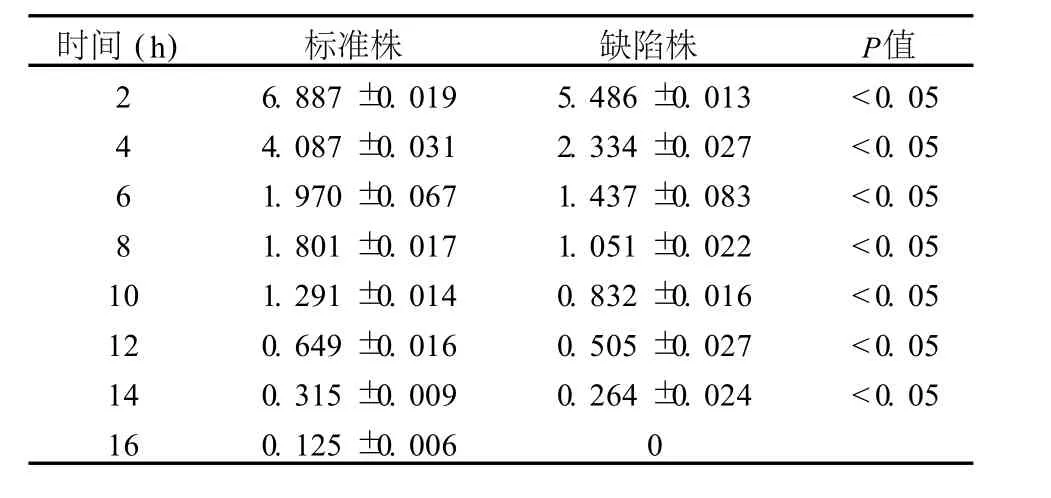
表2 标准株和Δhtr A-clpP生长过程中培养基中葡萄糖的剩余量比较 (mg/mL-1,±s)
时间(h) 标准株 缺陷株 P值2 6.887±0.019 5.486±0.013 <0.05 4 4.087±0.031 2.334±0.027 <0.05 6 1.970±0.067 1.437±0.083 <0.05 8 1.801±0.017 1.051±0.022 <0.05 10 1.291±0.014 0.832±0.016 <0.05 12 0.649±0.016 0.505±0.027 <0.05 14 0.315±0.009 0.264±0.024 <0.05 16 0.125±0.006 0
3 讨论
HtrA和 ClpP蛋白酶都是丝氨酸蛋白酶家族的重要成员。ClpP蛋白酶是细胞蛋白质质量监控的必需酶,可通过降解应激状态和非应激状态下细胞中的变性蛋白来发挥作用,ClpP基因的失活或缺陷会导致细胞的生物学改变,如应激敏感性、异常细胞形态、发育缺陷以及致病性等[6]。HtrA蛋白酶是一种多功能的分子伴侣,是细菌细胞间隙蛋白质量控制系统的一部分[7],与 ClpP蛋白酶的功能相似。Htr A所具有的蛋白酶和分子伴侣功能对于维持生长、应激耐受、输送、分泌、信号转导等生理学稳态的维持具有核心作用,可以调整生物体的性能使其适应环境压力[3]。在本实验中缺陷株由于 htrA基因和 clpP基因同时缺失,在菌株的生长过程中细胞的蛋白产生及周转都受到了一定程度的影响,错误蛋白的产生及降解机制的障碍导致细胞的生理稳态失衡,从而在含有 10 g/L葡萄糖的普通 TPY培养基中生长时表现出生长周期的紊乱,如对数期时间缩短以及细胞增长的峰值降低。在对数前期的生长速度较标准株快可能是由缺陷株对生长环境的敏感性提高而导致的,htrA和 clpP基因缺陷的菌株细胞置培养基中时,细胞内部的调控网络迅速反应并调节各方面机制以尽快适应生长环境,因此可能造成对数前期生长速度的提高以及生长过程中葡萄糖的快速消耗。随着生长逐渐进入平稳期,htrA和 clpP的缺陷导致变性蛋白质的累积也达到了一定程度,限制了细胞生存能力,表现为生长后期A值峰值明显降低。
碳水化合物是牙菌斑代谢的主要物质基础,细菌利用碳水化合物产生酸,酸的堆积部位就是菌斑中耐酸菌的生态优势区。碳水化合物变化也可能破坏牙菌斑的生态平衡,影响其生态组成[1]。变链菌作为最主要的致龋菌,碳源是其致龋过程所必需的。本结果显示标准株和缺陷株在含葡萄糖培养基中的生长趋势和耗糖有密切关系,随着菌株光密度值的增长,培养基中的葡萄糖量逐渐减少,并且菌株生长速度较快时葡萄糖消耗的速度也较快。无碳源条件下各菌株的生长速度和峰值与该菌株在有葡萄糖条件下相比均明显降低,表明碳源是变链菌生长过程中非常重要的能量来源。当变链菌在无碳源环境生长时,细胞处于饥饿应激状态,在生长过程中细菌为了能在不利的环境中生存,细菌可暂时诱发出一种亚型基因的表达,用以编码可保护细胞免受各种环境压力破坏的蛋白质,其中绝大部分蛋白质为分子伴侣或蛋白酶,它们对无折叠或错折叠蛋白质的重折叠或降解过程起着关键作用,而 ClpP和 Htr A蛋白的缺失削弱了这种调节作用。有研究表明 ClpP在若干种转录调节器的稳定和活性保持方面也很重要,在微生物细胞中 ClpP介导的蛋白水解作用的靶物质,包括几种调节器如Spx,Rs iW,ComK,Sda等分别与细胞的应激调节和发育有关[3]。并且HtrA蛋白酶的主要功能是帮助生物体在不利环境中生存的,htr A和 clpP基因的缺失限制了变链菌细胞在饥饿应激条件下的生存能力。因此,即使由于缺陷株对环境的敏感性导致对数期缺陷株的细胞增长速度高于标准株,最终由于细胞内部变性蛋白质的堆积及周转障碍而表现为生长过程中峰值降低,细胞增殖障碍。另外,在整个生长期间标准株对葡萄糖的消耗量均低于缺陷株,可能是由于 htr A和 clpP基因的缺失导致缺陷株在利用葡萄糖方面有所障碍,然而,是两种基因的共同作用还是其中一种的作用还有待进一步证实。
综上所述,htr A-clpP双基因缺陷株的细胞生长能力比标准株弱,在饥饿应激条件下,缺陷株的抗饥饿能力也比标准株低,htr A和 clpP基因在变链菌的生长能力和应激能力方面起着一定的作用,这两个基因的缺失会导致变链菌细胞的增殖障碍和生理稳态的失衡,其中的具体影响机制还有待进一步深入研究。
[1] 周学东,肖晓蓉.口腔微生物学[M].成都:四川大学出版社,2003:107-196.
[2] Robertson GT,Ng wl,Foley J,et al.Global transcriptional analysis of clpP mutations of type 2Streptococcus pneumoniaeand their effectson physiology and virulence[J].J Bacteriol,2002, 184(13):3508-3520.
[3] Ahn SJ,Lemos JAC,Burne RA.Role of HtrA in growth and competence ofStreptococcus mutansUA159[J].J Bacteriol, 2005,187(9):3028-3038.
[4] 于丹妮,张文娟,彭诚,等.应用 Cre-loxP*系统构建无标记的变异链球菌双基因缺陷株[J].中华口腔医学杂,2011,46 (2):102-106.
[5]王玮,胡楠,苏凌云,等.变异链球菌荧光报告株与野生菌株生长能力及生物膜形成能力的比较[J].牙体牙髓牙周病学杂志,2010,20(2):61-64.
[6] Zhang J,Banerjee A,Biswas I.Transcription of clpP is enhanced by a unique tandem repeat sequence inStreptococcusmutans[J].J Bacteriol,2009,191(3):1056-1065.
[7] Kang KH,Lee JS,YooM,et al.The influence of HtrA expression on the growth ofStreptococcusmutansduring acid stress[J]. Mol Cells,2010,29(3):297-304.
- 牙体牙髓牙周病学杂志的其它文章
- 八年制口腔正畸学实训课教学改革与探索
- 关于撤销已发表论文的公告

