小型猪腹壁拉链模型的建立
马 雷,汤 球,刘志学,余琛琳,崔淑芳
(第二军医大学训练部实验动物中心,上海 200433)
小型猪作为一种新型实验动物,在医学教学和科学研究中的应用越来越受到重视。小型猪在解剖学、生理学等方面同人类极其相似[1-3],广泛应用于皮肤致敏试验[4-6]、心血管系统[7-11]、消化系统[12-14]、泌尿系统[15]、免疫系统等的研究,在药物毒理学和异种脏器移植领域[16-20]的应用也在迅速增长。与其他实验动物相比,小型猪诸多生理指标均与人类相似,是进行人类疾病研究的一种良好的模型动物。本试验建立了小型猪腹壁拉链模型,并对其基础生物学特性进行研究,拟为连续治疗和某些医学科研及教学中需要进行反复开腔手术提供理想的解决方案,并为以小型猪为实验动物进行人类脏器相关研究创造更为广阔的前景。
小型猪腹壁拉链模型是结合小型猪的生活习性和体型特点,通过外科手术将生物拉链安装在小型猪的腹侧建立的动物模型,该模型的应用可以有效地节省反复开腔手术操作和术后观察的时间,减轻动物痛苦,提高动物的利用率,确保实验动物的福利,降低疼痛导致的实验结果偏差。从外科教学和外科研究实验实际应用来看,该模型具有良好的稳定性、实用性和通用性,同时操作的便利性在越复杂的手术上体现的愈加突出。
1 材料和方法
1.1 一般材料
1.1.1 实验动物;广西巴马小型猪12头,雌雄各半,购自上海妙迪生物科技有限公司[合格证号:SCXK(沪)2005-0002]提供,体重(10~15)kg,2~3月龄。动物单笼饲养,室温(20~25)℃,相对湿度为60%~80%,每天定时、限量饲喂,自由饮水。实验设施环境合格证号:SYXK(沪)2007-0003。
1.1.2 生物拉链
根据本实验需要,由本课题小组选择合适的医用材料,通过合理的外形设计和一系列的功能测试、改进,制作的生物拉链,具有坚固耐用、无毒、透气性好,并具有一定的抑菌特性等特点。本课题所研制生物拉链已申请并获得国家实用新型授权(授权号:[200920207646.1])
1.2 方法
1.2.1 小型猪腹壁拉链模型的建立:小型猪麻醉后,利用外科手术方法,打开动物腹腔,将生物拉链外侧的下翼(22)(图1)固定于腹腔内壁;操作完毕后,进再将生物拉链外侧的上翼(21)(图1)固定于小型猪腹部外侧,最终使动物的手术切口两侧的腹壁结构完全独立分开,避免接触。手术结束后,通过拉合小型猪腹壁拉链关闭腹腔。
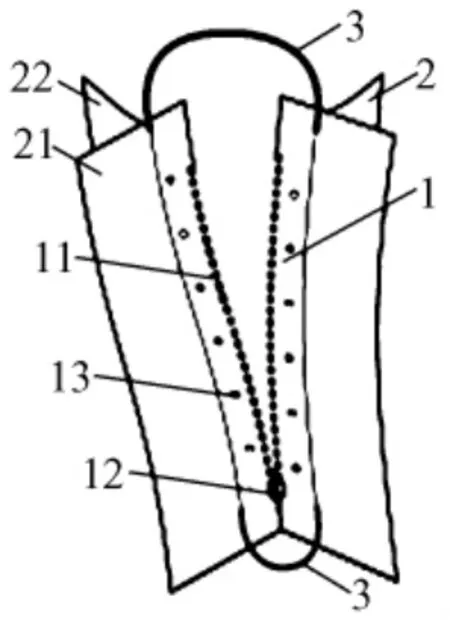
图1 生物拉链外形模式图Fig.1 A schematic diagram of the model of biological zipper
1.2.2 小型猪腹壁拉链模型体征生理数据测定:于小型猪腹壁拉链模型建立前(0 d)、建立后1、3、7、14、21、35、49、56 d将小型猪固定、待其安静后,测定其呼吸频率(respiratory rate,RR)、体温(temperature,T)和心率(heart rate,HR),并用动物血压仪测定其血压(blood pressure,BP)。
1.2.3 小型猪腹壁拉链模型血液生理生化指标和尿液常规指标的测定:按步骤1.2.2中相同的时间点采集小型猪的血液,用全自动血细胞分析仪和全自动血液生化仪对血液生理指标如红细胞计数(RBC)、白细胞计数(WBC)、血红蛋白(Hb)、血小板计数(PLT)等,以及血液生化指标如总蛋白(TP)、白蛋白(ALB)、总胆固醇(TC)、甘油三酯(TG)、钠离子浓度(Na+)、钾离子浓度(K+)、氯离子浓度(Cl-)进行测定。
按步骤1.2.2中相同的时间点采集小型猪的尿液,用尿液分析仪测定葡萄糖(Glu)、尿蛋白(Pro)、胆红素(BIL)、尿胆原(URO)、比重(SG)、酸碱度(pH)、白细胞(WBC)、红细胞(RBC)、亚硝酸盐(Nit)指标。
2 结果
2.1 小型猪腹壁拉链模型的构建
研究结果表明:利用自发研制的生物拉链和试验方法建立的小型猪腹壁拉链动物模型,制备效果好,成功率高,模型的可用时间较长,完全可以满足常规实验的应用;并且应用小型猪腹壁拉链模型进行研究可以显著的减少动物的使用数量,提高动物的利用率;该模型的常规体征指标、血液生理及生化指标及尿液常规指标(表1~4)在模型建立后7~49 d较为稳定;实验观察生物拉链在小型猪体表固定良好,具有较好的抗拉性,实验过程中拉链无脱落现象;此外,生物拉链的抗菌、抑菌效果良好,固定在小型猪体表和体内的部分试验期间未见明显的炎性反应,和由此而带来的动物不适感。
运用建立的模型制备效果评价体系,小型猪腹壁拉链模型的评分值为95.8,说明该模型制备成功,具有较高的推广应用价值。
为了进一步验证小型猪腹壁拉链模型的应用性,本校上学期的手术外科教学对小型猪腹壁拉链模型进行了应用,实践表明:小型猪腹壁拉链模型可以方便教员的手术示教和学员的手术操作,并且这种操作的便利性和优越性在越复杂的手术上体现的愈加突出,说明了该模型在教学应用方面的实用性。关于小型猪腹壁拉链动物模型的时效性,运用该模型可以顺利开展外科教学期间的所有手术实验,有效使用时间为45~49 d左右,完全可以满足常规外科教学和实验的要求。
2.2 小型猪腹壁拉链模型生理学数据的测定
小型猪在腹壁拉链模型建立后的1~3 d精神萎靡,摄食和饮水下降,之后逐渐恢复,至7 d后基本达到正常;模型建立后49 d,未见生物拉链固定处出现感染,但56 d时可以观察到固定生物拉链皮肤处出现轻微炎性症状,并有浅黄色的渗出性体液和炎性分泌物由生物拉链引流孔中流出。
实验生理指标检测方面,小型猪腹壁拉链模型的血压(BP)、心率(HR)、体温(T)和呼吸频率(RR)与模型建立前相比无显著性差异(表1)。
血液生理指标检测结果表明,红细胞计数(RBC)、血红蛋白(Hb)、血小板计数(PLT)和嗜酸性粒细胞(EOS)同实验前相比差异无显著性,而白细胞计数(WBC)在模型建立后1 d和3 d出现轻微升高,7 d恢复至正常。此外,模型建立后56 d,白细胞计数(WBC)再次轻微升高,较正常对照差异显著(表2),
实验显示,血液中的总蛋白、钠、钾、氯在试验前后无显著变化(表3),但模型建立后1 d和3 d血液中的总胆固醇、甘油三酯出现轻微浮动,随之7 d后又恢复至正常水平。尿液常规指标检测方面,模型建立前后尿液中葡萄糖(Glu)、尿蛋白(Pro)、胆红素(BIL)、白细胞(LEU)、红细胞(BLD)、亚硝酸盐(Nit)均为阴性,且尿液的酸碱度和比重也无显著变化(表4)。
试验结果表明:小型猪腹壁拉链模型建立后7 d~49 d,体征指标、血液生理生化指标和尿常规指标均正常,可以用于科研教学试验。
表1 小型猪腹壁拉链模型体征生理数据测定(n=12,±s)Tab.1 The values of physiological parameters in the mini-pig models of abdominal wall biological zipper(n=12,±s)
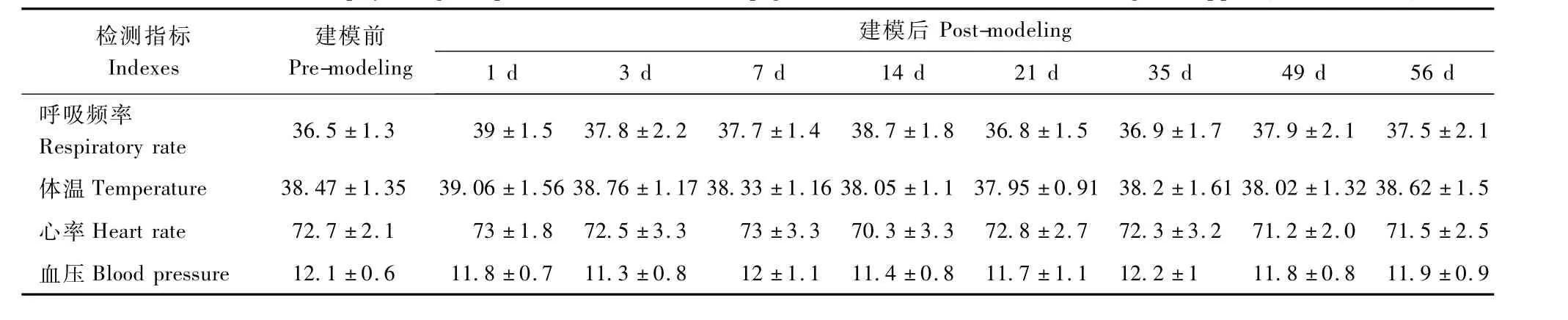
表1 小型猪腹壁拉链模型体征生理数据测定(n=12,±s)Tab.1 The values of physiological parameters in the mini-pig models of abdominal wall biological zipper(n=12,±s)
检测指标Indexes建模前Pre-modeling建模后Post-modeling 1 d 3 d 7 d 14 d 21 d 35 d 49 d 56 d呼吸频率Respiratory rate 36.5±1.3 39±1.5 37.8±2.2 37.7±1.4 38.7±1.8 36.8±1.5 36.9±1.7 37.9±2.1 37.5±2.1体温Temperature 38.47±1.35 39.06±1.56 38.76±1.17 38.33±1.16 38.05±1.1 37.95±0.91 38.2±1.61 38.02±1.32 38.62±1.5心率Heart rate 72.7±2.1 73±1.8 72.5±3.3 73±3.3 70.3±3.3 72.8±2.7 72.3±3.2 71.2±2.0 71.5±2.5血压Blood pressure 12.1±0.6 11.8±0.7 11.3±0.8 12±1.1 11.4±0.8 11.7±1.1 12.2±1 11.8±0.8 11.9±0.9
表2 小型猪腹壁拉链模型血液生理指标测定(n=12,±s) Tab.2 The blood physiological indexes in the mini-pig models of abdominal wall biological zipper(n=12,±s)
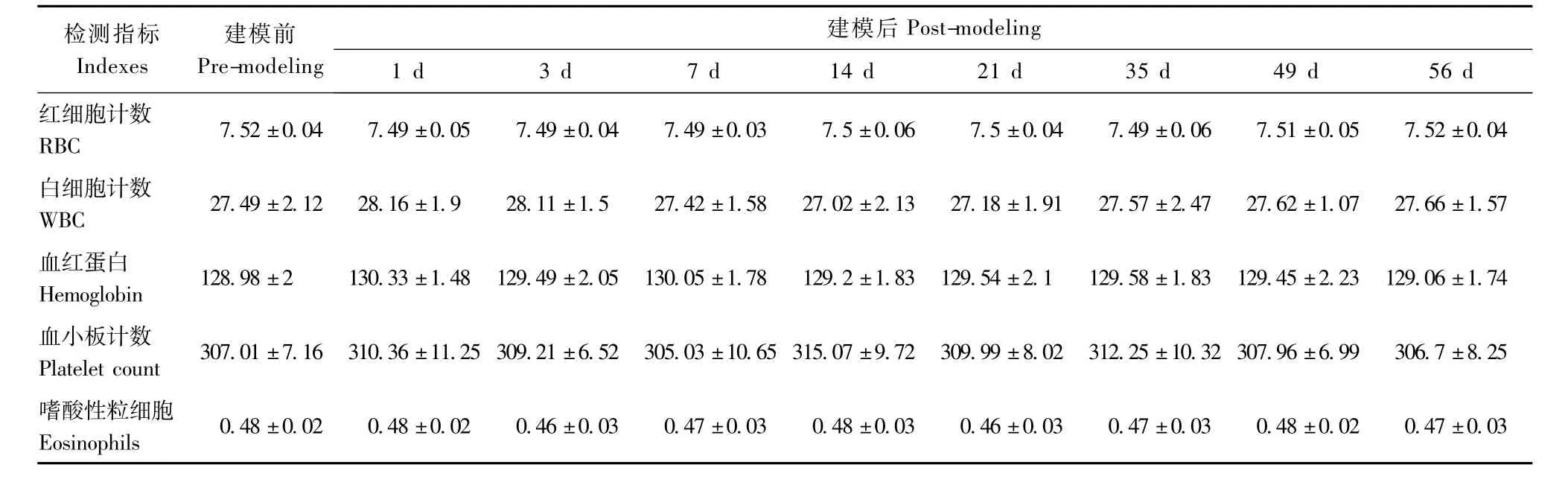
表2 小型猪腹壁拉链模型血液生理指标测定(n=12,±s) Tab.2 The blood physiological indexes in the mini-pig models of abdominal wall biological zipper(n=12,±s)
检测指标Indexes建模前Pre-modeling建模后Post-modeling 1 d 3 d 7 d 14 d 21 d 35 d 49 d 56 d红细胞计数RBC 7.52±0.04 7.49±0.05 7.49±0.04 7.49±0.03 7.5±0.06 7.5±0.04 7.49±0.06 7.51±0.05 7.52±0.04白细胞计数WBC 27.49±2.12 28.16±1.9 28.11±1.5 27.42±1.58 27.02±2.13 27.18±1.91 27.57±2.47 27.62±1.07 27.66±1.57血红蛋白Hemoglobin 128.98±2 130.33±1.48 129.49±2.05 130.05±1.78 129.2±1.83 129.54±2.1 129.58±1.83 129.45±2.23 129.06±1.74血小板计数Platelet count 307.01±7.16 310.36±11.25 309.21±6.52 305.03±10.65 315.07±9.72 309.99±8.02 312.25±10.32 307.96±6.99 306.7±8.25嗜酸性粒细胞Eosinophils 0.48±0.02 0.48±0.02 0.46±0.03 0.47±0.03 0.48±0.03 0.46±0.03 0.47±0.03 0.48±0.02 0.47±0.03
表3 小型猪腹壁拉链模型血液生化指标测定(n=12,±s) Tab.3 The values of blood biochem ical indexes in the mini-pig models of abdom inal wall biological zipper(n=12,±s)
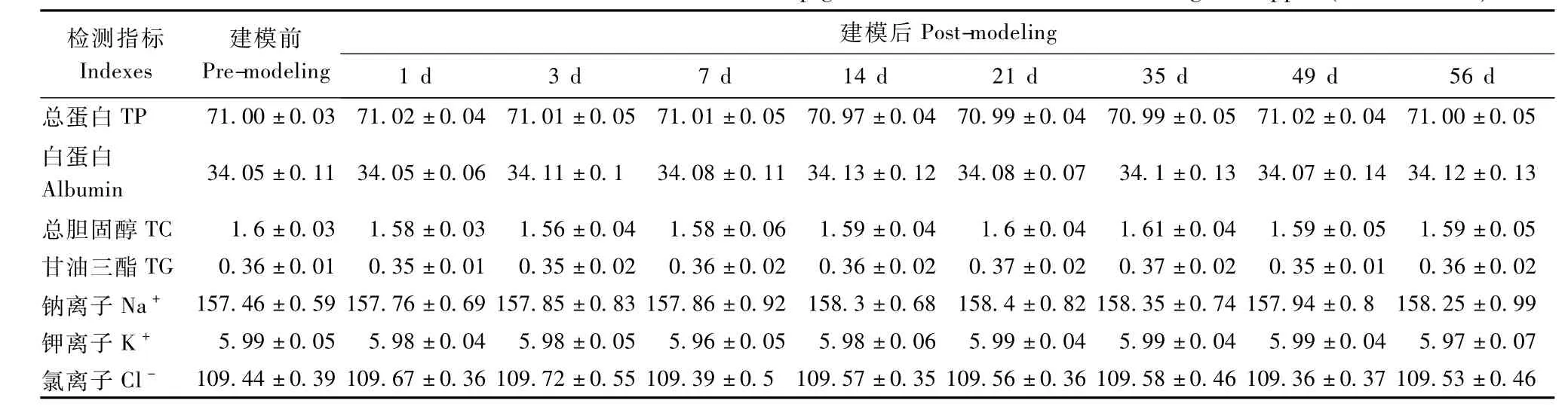
表3 小型猪腹壁拉链模型血液生化指标测定(n=12,±s) Tab.3 The values of blood biochem ical indexes in the mini-pig models of abdom inal wall biological zipper(n=12,±s)
检测指标Indexes建模前Pre-modeling建模后Post-modeling 1 d 3 d 7 d 14 d 21 d 35 d 49 d 56 d总蛋白TP 71.00±0.03 71.02±0.04 71.01±0.05 71.01±0.05 70.97±0.04 70.99±0.04 70.99±0.05 71.02±0.04 71.00±0.05白蛋白Albumin 34.05±0.11 34.05±0.06 34.11±0.1 34.08±0.11 34.13±0.12 34.08±0.07 34.1±0.13 34.07±0.14 34.12±0.13总胆固醇TC 1.6±0.03 1.58±0.03 1.56±0.04 1.58±0.06 1.59±0.04 1.6±0.04 1.61±0.04 1.59±0.05 1.59±0.05甘油三酯TG 0.36±0.01 0.35±0.01 0.35±0.02 0.36±0.02 0.36±0.02 0.37±0.02 0.37±0.02 0.35±0.01 0.36±0.02钠离子Na+ 157.46±0.59 157.76±0.69 157.85±0.83 157.86±0.92 158.3±0.68 158.4±0.82 158.35±0.74 157.94±0.8 158.25±0.99钾离子K+ 5.99±0.05 5.98±0.04 5.98±0.05 5.96±0.05 5.98±0.06 5.99±0.04 5.99±0.04 5.99±0.04 5.97±0.07氯离子Cl- 109.44±0.39 109.67±0.36 109.72±0.55 109.39±0.5 109.57±0.35 109.56±0.36 109.58±0.46 109.36±0.37 109.53±0.46
表4 小型猪腹壁拉链模型尿液常规指标(n=12,±s) Tab.4 The values of routine urine indexes in the mini-pig models of abdominal wall biological zipper(n=12,±s)
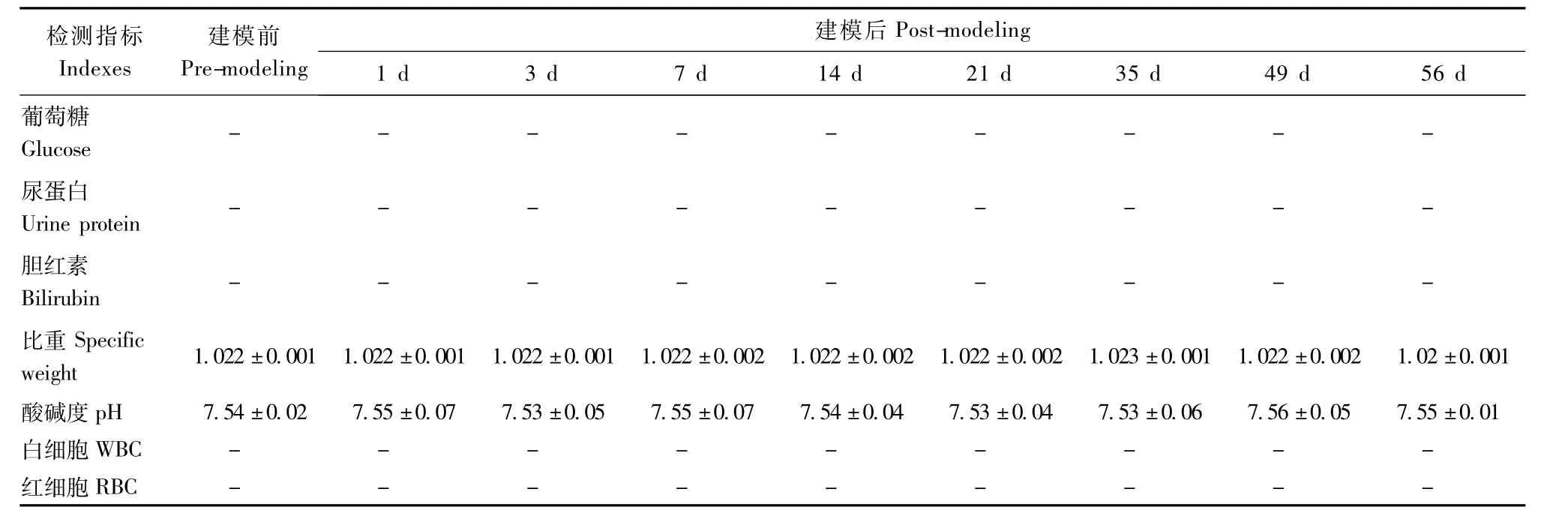
表4 小型猪腹壁拉链模型尿液常规指标(n=12,±s) Tab.4 The values of routine urine indexes in the mini-pig models of abdominal wall biological zipper(n=12,±s)
检测指标Indexes建模前Pre-modeling建模后Post-modeling 1 d 3 d 7 d 14 d 21 d 35 d 49 d 56 d葡萄糖Glucose ---------尿蛋白Urine protein - - - - - - - - -胆红素Bilirubin - - - - - - - - -比重Specific weight 1.022±0.001 1.022±0.001 1.022±0.001 1.022±0.002 1.022±0.002 1.022±0.002 1.023±0.001 1.022±0.002 1.02±0.001酸碱度pH 7.54±0.02 7.55±0.07 7.53±0.05 7.55±0.07 7.54±0.04 7.53±0.04 7.53±0.06 7.56±0.05 7.55±0.01白细胞WBC- - - - - - - - -红细胞RBC- - - - - - - - -
3 讨论
小型猪在解剖学、生理学等方面同人类极其相似[18,21-25],因此,在人体组织脏器功能研究和器官移植方面具有广阔的应用前景[18,26-29]。为了进一步推广小型猪的应用,为医学研究和教学提供一种新型的工具,本试验应用课题组自行研制的生物拉链建立小型猪腹壁拉链模型。
实验结果表明,小型猪腹壁拉链模型建立后7~49 d血液生理指标、血液生化指标、尿液生化指标与正常对照无显著变化,表现了该模型生物学的稳定性。此结果说明了两方面的问题,首先是,生物拉链的生物相容性较好,该生物拉链对于小型猪无显著的生物毒性,所以,小型猪的血液生理、生化指标和尿液生化指标在实验前后并未受到影响;其次,小型猪腹壁拉链模型的应用推广性好,诸多的体征、生理和生化指标均保持良好,同时小型猪模型在实验操作方面又具有高度的便利性、在实际应用方面还可以显著的简化实验操作环节、减少动物使用数量,极大地减少了实验的人力、物力成本,以上体征、生理指标和实际应用的优越性必然有利于小型猪在实际应用中的推广。对于小型猪腹壁拉链动物模型在建模后1~7 d和49 d后白细胞水平的异常变化的情况,课题组经过分析认为:①模型建立初期:由于建立模型需要实施较长时间的外科手术操作,该过程可能对小型猪体产生了一定的损伤作用;因此,此时白细胞水平轻微上升说明机体正处于自我修复过程,该现象与临床患者术后白细胞水平变化的报道相一致。②模型应用的后期(49 d后):小型猪模型白细胞的水平的再次升高,这可能是由于课题组为探索模型的应用性,故使用该批模型开展了部分外科教学相关的外科手术实验;而反复的外科手术实验和操作过程中卫生环境控制不良可能是最终导致小型猪模型建模后期白细胞的水平升高的原因。因此,课题组认为,加强应用小型猪动物模型开展相关实验的操作规范性并严格控制操作过程中的环境卫生,可能会有助于减少小型猪腹壁拉链动物模型的炎性感染,并有助于延长模型的使用时间。
课题组利用结合AHP法和Delphi法[30],依据专家调研意见建立的小型猪腹壁拉链模型制备效果评价体系对小型猪腹壁拉链模型进行了评价。与常规人类疾病动物模型不同的是,小型猪腹壁拉链模型是一种动物正常状态下的模型制备;而对这种情况下模型制备效果的评价,我们在专家调研建议体系中加引入了生物拉链安全性和模型制备过程中动物应激次数等多个参数,对于模型制备的效果进行综合性评价。同时利用计算机编程软件结合以上模型评估体系的原则建立了EISAMHD.SMMU 1.0人类疾病动物模型评价软件,利用该软件通过计算机运算对于模型的制备效果进行系统、科学、客观的评价,本模型制备效果的计算机评分为95.8分,说明该模型制备成功,具有较高的推广应用价值。
为研究小型猪腹壁拉链模型的通用性、稳定性和实用性,课题组将制备的模型推广于本单位外科教学和医院外科研究实验中。反馈结果显示,应用同一小型猪腹壁拉链模型可以完成外科教学手术中的几项甚至所有手术实验,证明了该模型在实际应用方面的通用性。通常,动物外科手术的教学周期为40 d,我们的实验结果表明,应用小型猪腹壁拉链模型可以完成教学期间的所有手术,证明了该模型的稳定性和实用性。
本课题组采用小型猪建立腹壁拉链动物模型,并对其生物学特性进行了研究,在所检国内外文献范围内未见与本课题相类似的文献报道,本课题的创新性在于:(1)首次建立小型猪腹壁拉链模型,并通过对模型生物学特性等的研究建立该模型效果评价体系;(2)以该模型为对象开展外科手术是对动物福利精神的具体实践,响应了我国动物福利政策法规,加速了我国动物实验标准与国际接轨。
[1]王桂花,尹晓敏,孙霞,等.国内外小型猪资源概况[J].中国比较医学杂志,2009,19(2):71-73.
[2]刘亚千,陈华.小型猪基本实验操作技术[J].中国实验动物学报,2008,16(5):381-384.
[3]张元跃.小型猪生长模型的研究[J].养猪,2008,(1):27 -28.
[4]程树军,巫玮.小型猪皮肤试验系统及其在化妆品皮肤毒性替代研究中的应用[C].第八届中国化妆品学术研讨会论文集.
[5]周梦云,宋为民,韩长元,等.紫外线对小型猪皮肤的影响以及积雪苷对紫外线所致光老化防护作用的研究[J].中华中医药学刊,(3):623-625.
[6]Lavker,R.,Dong,G.,Zheng,P,et al.Hairless micropig skin.A novelmodel for studies of cutaneous biology[J].Am J pathol.1991,138(3):687.
[7]陈华,谢忠忱,黄广勇,等.五指山小型猪动脉粥样硬化模型的建立[J].实验动物科学,2007,24(6):39-43.
[8]刘录山,杨永宗,冯大明,等.小型猪动脉粥样硬化斑块稳定性模型研究[J].生物化学与生物物理进展,2006,33 (2):196-200.
[9]陈华,李春海,谢忠忱,等.五指山小型猪动脉粥样硬化模型的病理学研究[J].实验动物科学,2007,24(6):44-48.
[10]陈华.小型猪动脉粥样硬化模型[J].中国实验动物学报,2008,16(5):376-380.
[11]Post,M.,Borst,C.,Kuntz,R.The relative importance of arterial remodeling compared with intimal hyperplasia in lumen renarrowing after balloon angiop lasty.A study in the normal rabbit and the hypercholesterolemic Yucatan micropig[J].Circulation.1994,89(6):2816.
[12]田维毅,王文佳,李海峰,等.贵州小型猪胃肠道正常菌群的初步检测[J].四川动物,2008,27(1):145-146,152.
[13]王文佳,田维毅,李海峰,等.贵州小型猪肠茵群失调模型的制备[J].四川动物,2008,27(4):552-553.
[14]靳二辉,单同领,张勇,等.近交系五指山小型猪消化器官的解剖学研究[J].中国畜牧兽医,2007,34(012):66-69.
[15]杨述林,靳二辉,单同领,等.近交系五指山小型猪泌尿系统的解剖学研究[J].中国畜牧兽医,2007,34(010):59 -62.
[16]陈华.小型猪在医学研究领域的应用进展[J].中国实验动物学报,2008,16(005):366-367.
[17]潘明新,李爱辉,高毅,等.中国小型猪原位肝移植的实验研究[J].南方医科大学学报,2006,26(7):1069-1069.
[18]孙建森,张伟,应大君,等.版纳小型猪近交系心脏的异种移植解剖学观察[J].中国实验动物学杂志,2002,12(6):333-335.
[19]詹纯列,徐本法,白朝晖.小型猪在医学实验中的应用[J].中国实验动物学杂志,2000,10(2):118-120.
[20]Vodicka,P,H lucilova,J,Klima,J,et al.The minipig as an animalmodel in biomedical stem cell research[M].Sourcebook of Models for Biomedical Research.2008:241-248.
[21]黄辉煌,杨列,陈卫军,等.中国版纳小型猪近交系肝脏的应用解剖[J].第三军医大学学报,2004,26(3):217-219.
[22]路广会,李谦正,陈耀星.小型猪脊髓动脉解剖[J].中国农业科学,1993,26(1):79-83.
[23]宋林,曾养志.版纳小型猪近交系内分泌器官的解剖观察[J].四川动物,2002,21(1):53-54.
[24]刘锋,管玉龙,董培青,等.实验用小型猪主动脉解剖学研究[J].中国体外循环杂志,2006,4(1)43-45.
[25]罗刚,张乐,刘连生,等.我国实验用小型猪的应用研究前景[J].实验动物科学与管理,2004,21(2):37-38.
[26]王文磊.1.小型猪骨髓间充质干细胞经心导管冠状动脉移植及其迁移和分化的实验研究2.骨髓间充质干细胞多向分化潜能的实验研究[D].重庆医科大学,2006:18-39.
[27]汪开.日本繁育可用于人类异种器官移植的小型猪[J].生物技术通报,2003,(4):52-52.
[28]戴琦,孙世铎,冯书堂.实验用小型猪胚胎移植技术研究进展[J].实验动物科学,2007,24(6):119-122.
[29]张德福,刘东.国内外小型猪实验动物化研究[J].生物学通报,2004,39(10):14-16.
[30]崔淑芳,余琛琳,蔡丽萍,等.大鼠硒性白内障动物模型制备效果评价指标体系的研究[J].实验动物与比较医学,2009,(3):185-191.

