APP695K595N/M596L突变转基因小鼠的建立和病理表型动态分析
王冬梅,李万波,袁树民,全雄志,张海涛,马春梅,曹兴水,张连峰
(中国医学科学院北京协和医学院医学实验动物研究所,卫生部人类疾病比较医学重点实验室,国家中医药管理局人类疾病动物模型三级实验室,北京 100021)
淀粉样前体蛋白(amyloid precursor protein,APP)是一种Ⅰ型跨膜糖蛋白,在人体多种组织中均有表达,研究发现生理状态下的APP参与神经发育、神经损伤后修复与再生、突触发生和学习记忆能力等,在神经系统发育发生及发展中发挥重要的生理作用[1]。而发生突变的APP与家族性阿尔茨海默症(Alzheimer's disease,AD)关系密切,突变的APP通过淀粉样加工途径产生过多的Aβ,而Aβ也是AD中老年斑的主要成份。本文通过转基因技术,将人的APP695K595N/M596L转入C57BL/6J小鼠体内,构建了神经特异性表达人APP695K595N/M596L转基因小鼠,并通过行为学及神经病理学方法对该动物模型进行评价。
1 材料和方法
1.1 APP表达载体的构建及转基因
本文所研究的PrP-hAPP695K595N/M596L突变转基因动物模型由本所遗传中心构建,利用点突变方法使人APP695cDNA在596碱基和597碱基两个位点产生G-C和A-C的突变,编码氨基酸由赖氨酸突变为天门冬酰胺,蛋氨酸突变为亮氨酸,称为瑞士突变。把APP基因克隆到小鼠阮蛋白启动子(PrP)的下游构建APP695K595N/M596L转基因表达载体。转基因载体用Xba I线性化(宝生物工程有限公司),调整浓度至5 ng/μL,用显微注射法将线性化的转基因载体注射到C57BL/6J小鼠的受精卵中(小鼠购自北京华阜康生物科技股份有限公司,SCXK京2009-0007),用ICR小鼠作假孕体,制备转基因小鼠。实验中涉及动物的操作程序已经得到中国医学科学院医学实验动物研究所实验动物使用与管理委员会的批准(GC-07-2055)。
1.2 PCR鉴定APP转基因动物的基因表型
转基因小鼠在出生9~14 d用剪趾法标记,收集剪下的组织,用碱裂解法提取基因组DNA,用PCR检测APP转基因小鼠。PCR上游引物为5’-GACTGACCACTCGACCAGGTTCTG-3’,下游引物为5’-CTTGTAAGTTGGATTCTCATATCCG-3’(上海生物工程技术有限公司),PCR试剂购自宝生物工程有限公司。PCR反应条件:94℃预变性5 m in,94℃变性30 s,54℃退火30s,72℃延伸30 s,35个循环。hAPP片段为344 bp。
1.3 Westernblotting鉴定APP基因在蛋白水平的表达
选用1月龄的转基因阳性和同窝阴性小鼠,颈椎脱臼法牺牲小鼠,迅速取出脑组织置匀浆器中,加入1 m L的RIPA蛋白裂解液(碧云天公司),蛋白浓度通过BCA法测定(Pierce公司Pierce BCA Kit试剂盒),取等量蛋白进行SDS-PAGE凝胶电泳,随后将蛋白电转至醋酸纤维素NC膜上。膜先用5%脱脂牛奶中室温封闭1 h,加入羊抗hAPP蛋白抗体(1:500稀释,Santa Crutz),4℃杂交过夜。将膜转移到HRP标记的兔抗山羊抗体(1∶15 000,Pierce Biotechnology)中,室温杂交1 h。将膜置于化学发光液中,曝光、显影及定影。
1.4 APP695K595N/M596L转基因小鼠模型的病理学动态观察
选用5、7、9、11、12月龄APP695K595N/M596L小鼠及同月龄野生小鼠,颈椎脱臼法处死小鼠,取脑后用中性甲醛溶液固定24 h,取材、脱水、包埋、切片、thioflavin-S(购自美国Sigma公司)荧光检测老年斑情况,光学显微镜(Nikon,日本)及荧光显微镜观察(Olympus,日本)。
1.5 Morris水迷宫检测APP695K595N/M596L转基因小鼠的行为学变化
选用5、7、9、11月龄APP695K595N/M596L转基因阳性小鼠每组10只及同月龄的野生型C57/6J小鼠每组10只,利用Morris水迷宫进行小鼠行为学分析(Ethovision XT监测分析软件,Morris水迷宫系统,Noldus公司,荷兰)。水迷宫实验过程分为连续5天的隐藏平台获得实验和第6天的空间探索实验两部分。每天训练4次,每次使小鼠在不同区域下水,水迷宫按东南西北分为1、2、3、4区域,平台即第五区域,位于第4区域内。每次游泳时间为60 s,每次训练间隔1 h左右。小鼠没有找到平台的按60 s计算潜伏期。平台隐藏获得实验检测小鼠学习获得能力,空间探索实验检测小鼠空间记忆能力。
1.6 统计学方法
利用SPSS16.0软件统计分析,平台隐藏获得实验中的逃避潜伏期采用多重测量的方差分析学习试验;空间探索实验中的各象限的游泳时间和穿越目标次数采用单因素方差分析。数据采用均数±标准差,差异显著水平设为双侧α=0.05。
2 结果
2.1 APP表达载体的构建和转基因小鼠基因表型的鉴定
将人APP695K595N/M596L突变基因插入小鼠阮蛋白启动子(mouse prion protein)的下游,构建APP转基因载体(图1A)。显微注射法将线性化的转基因载体注射到C57BL/6J小鼠的受精卵中,转入到假孕受体ICR小鼠中,小鼠出生后9~14 d提取基因组DNA,用PCR检测APP转基因小鼠(图1B)。
2.2 Westernblotting检测APP基因在蛋白水平的表达

A: APP695K595N/M 596L转基因表达载体;B:转基因小鼠的PCR鉴定。注:1:空白对照;2:阴性对照;3:阳性对照; 4:DNA分子标记DL2000;5-17:转基因小鼠的DNA样品。图1 APP695K595N/M 596L基因表达载体的构建和转基因小鼠的PCR鉴定图A:APP695K595N/M596L transgenic expression construct; B:PCR genotyping of APP695K595N/M 596L transgenic mice Note:1:Blank control;2:Negative control; 3:Positive control;4:DL2000 DNA marker; 5-17:Genomic DNA samples from transgenic mice.Fig.1 APP695K595N/M596L transgenic expressionconstruct and PCR genotyping of APP695K595N/M596L transgenic mice
分别提取首建鼠F1代阳性转基因小鼠和同龄阴性对照小鼠的脑组织总蛋白,进行Western blotting分析,结果显示7号转基因阳性小鼠脑脑组织中人APP蛋白表达量明显高于同龄阴性对照小鼠(图2),选取该品系的小鼠用于繁殖并进行病理学和行为学分析。
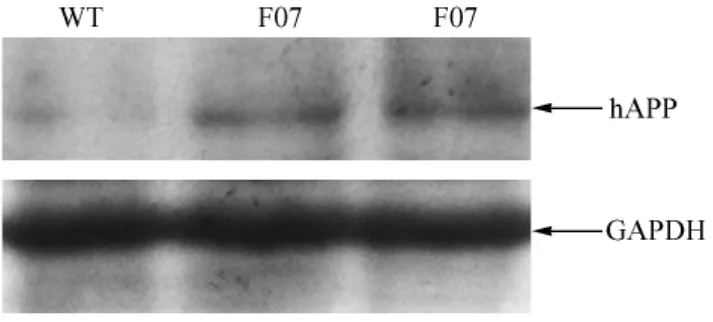
注:WT:同窝阴性对照小鼠; F07:转基因阳性品系;GAPDH:内参图2 人APP蛋白在APP695K595N/M596L转基因小鼠脑组织中的表达Note:WT:The wild type mouse;F07:The transgenic line; GAPDH:Loading normalization.Fig.2 Expression of human APP695K595N/M596L in the brain tissues of trangenic mice
2.3 病理学检验
Thioflavin-S荧光结果均显示5月、7月龄动物海马区均未检测到明显老年斑出现,9月龄时转基因阳性小鼠在海马区出现老年斑,11月,12月呈年龄依赖性增多(图3见彩插2)。
2.4 行为学结果
经过检验前5 d学习有效,所有小鼠都能较快的找到平台。随后第6天撤出平台,进行空间探索实验。Ethovision XT监监测分析软件记录小鼠在目标区域(即第4从5区)的穿梭次数和停留时间。Morris水迷宫试验发现5月、7月、9月、11月龄转基因小鼠空间探索实验结果与同月龄野生型小鼠相比有显著差异,较同月龄野生型C57BL/6J小鼠学习及记忆能力降低(P<0.05)(图4~5)。
3 讨论
全球预计有3 700万痴呆症患者,阿尔茨海默病是一种常见的中枢神经系统退行性变性疾病,疾病早期出现轴突病变(轴突肿胀,轴突运输障碍)以及突触功能缺陷,晚期临床表现为进行性记忆减退和认知障碍,主要神经病理特征是大脑皮质萎缩、神经细胞丧失,细胞外存在大量由淀粉样蛋白组成的老年斑(senile plaques,sp)、神经细胞内神经纤维丝缠结(neurofibrillary tangles,nfts)以及皮质动脉和小动脉的血管淀粉样变性[2]。在家族性A D家系中最早发现的突变基因是淀粉样前体蛋白(amyloid precursor protein),其后发现的突变基因还包括早老素(presenilin),转脂蛋白(apoe),tau蛋白等。

A:5月龄野生小鼠与转基因模型小鼠寻找隐藏平台的潜伏期比较;B:7月龄野生小鼠与转基因模型小鼠寻找隐藏平台的潜伏期比较;C:9月龄野生小鼠与转基因模型小鼠寻找隐藏平台的潜伏期比较;D:11月龄野生小鼠与转基因模型小鼠寻找隐藏平台的潜伏期比较;E:5-11月龄野生小鼠与转基因模型小鼠第4天寻找隐藏平台的潜伏期差值比较。* P<0.05图4 不同年龄小鼠水迷宫实验分析A:Comparison of escape latency between transgenic and controlmice at 5-month old age;B:Comparison of escape latency between transgenic and controlmice at 7-month old age;C:Comparison of escape latency between transgenic and controlmice at 9-month old age;D:Comparison of escape latency between transgenic and controlmice at11-month old age;E:Comparison of average value of the 4th day escape latency between transgenic and controlmice at 5-11-month old ages.* P<0.05Fig.4 Determination of escape latency in hidden platform acquisition training of the mice at different ages
目前在家族性A D病人中已鉴别出多个A P P基因的突变位点,这些突变使得APP代谢途径发生异常改变,是家族性A D的主要病因。本文所研究的瑞士突变带来的蛋白构象变化使A P P蛋白更容易被β-分泌酶切割,导致其通过淀粉样代谢途径生成的Aβ增多,增多的Aβ异常聚集,形成老年斑,进而影响认知行为。
神经特异性启动子通常在进行神经系统疾病基因治疗和神经生物学研究方面具有非常重要的意义[3]。其中,小鼠朊蛋白(mouse prion protein,PrP),人血小板源性生长因子(p latelet-derived grow th factor,PDGF),钙/钙调素依赖性蛋白激酶IIα(calcium/calmodulin-dependent protein kinase IIα,CaMKIIα),小鼠甲状腺素-1(thyroxine-1,Thy-1)是研究者经常使用的神经组织特异启动子。Thy-1和CaMKIIα启动子能够使下游目的基因在海马、胼胝体、前皮层神经元内特异性高表达[4,5],而PDGF和PrP启动子可以使目的基因在小脑、大脑、脊索的神经元广泛高表达[6,7]。PrP启动子更为突出的优点是在神经胶质细胞中也具有活性,而其余3个启动子不具有这样的功能[6-7]。所以我们选择PrP启动子,在其下游插入突变的APP基因建立阿尔茨海默病(Alzheimer's disease,AD)动物模型。

图5 Morris水迷宫空间探索实验结果比较A:Comparison of target zone duration between 5-11-month old transgenic and controlmice;B:Comparison of target zonefrequency between 5-11-month old transgenicand controlmice.*P<0.05Fig.5 Results of 6th day probe trial testing by Morris watermaze
在9月龄时,该转基因小鼠的海马区出现老年斑,11月,12月呈年龄依赖性增多,这和hsiao等[7]报道的结果相一致。Morris水迷宫结果显示5月龄转基因小鼠与同月龄野生小鼠有差异,说明5月龄转基因小鼠在出现明显老年斑之前就出现了学习记忆能力障碍。与此相一致,临床上AD患者神经病理学改变之前,就会出现轻度的认知障碍[8]。研究发现:神经元功能活动调控产生的内源性Aβ可能是正常机体对神经元持续兴奋的反应,通过从对神经元兴奋性的负反馈调节,控制神经元兴奋毒性的发生[9,10]。而当可溶性的Aβ过多,聚集成的Aβ寡聚体,能够破坏海马脑片及动物的长时程增强效应(long-term potentiation,LTP),降低海马的树突棘密度;干扰与记忆相关的即刻早期基因的表达;通过破坏神经信号转导,引起神经元功能障碍、变性、死亡,直接影响大脑学习记忆[11-13]。Morris水迷宫寻找平台隐藏实验中第3天是检测小鼠学习记忆能力是否存在差异的关键时间点,本实验中发现11月龄转基因小鼠与野生型小鼠相比,在第4天仍然存在差异,说明转基因体小鼠学习记忆能力呈现渐进性加重。
综上,本文报道的PrP-APP695K595N/M596L转基因小鼠在5月龄开始出现学习记忆能力缺陷和渐进性加重。在9月龄出现老年斑并呈年龄依赖性增多。该转基因小鼠的病理表型可以再现人类AD患者的渐进性病理表型,是具有应用价值的阿尔茨海默病小鼠转基因动物模型。PrP-hAPP695K595N/M596L转基因小鼠与PDGF-hAPP770V717I、PDGF-hAPP695V642I/K595N/M596L[14]、PDGF-hAPP695K595N/M596L转基因小鼠相比,由于PrP启动子在神经胶质细胞中也具有活性,使得该转基因小鼠可用于阿尔茨海默病神经炎症机制方面的研究,具有更广泛的用途。
[1]Kim D,Tsai LH.Bridging physiology and pathology in AD[J].Cell,2009,137(6):997-1000.
[2]Stokin GB,Lillo C,Falzone TL,et al.Axonopathy and transport deficits early in the pathogenesis of Alzheimer's disease[J].Science,2005,307(5713):1282-8.
[3]Ulrich VM.Gene therapy methods in bone and joint disorders.Evaluation of the adeno-associated virus vector in experimental models of articular cartilage disorders,periprosthetic osteolysis and bone healing[J].Acta Orthop(Suppl),2007,78(325):1-64.
[4]Moechars D,Dewachter I,Lorent K,et al.Early phenotypic changes in transgenic mice that overexpress different mutants of amyloid precursor protein in brain[J].JBiol Chem,1999,274 (10):6483-92.
[5]Ryan KA,Pimplikar SW.Activation of GSK-3and phosphorylation of CRMP2 in transgenic mice expressing APP intracellular domain[J].JCell Biol,2005,171(2):327-35.
[6]Sasahara M,Fries JW,Raines EW,et al.PDGF B-chain in neurons of the central nervous system,posterior pituitary,and in a transgenic model[J].Cell,1991,64(1):217-27.
[7]Hsiao K,Chapman P,Nilsen S,et al.Correlative memory deficits,Abeta elevation,and amyloid plaques in transgenic mice[J].Science,1996,274(5284):99-102.
[8]Mesulam M,Shaw P,Mash D,et al.Cholinergic nucleus basalis tauopathy emerges early in the aging-MCI-AD continuum[J].Ann Neurol,2004,55(6):815-828.
[9]Priller C,Bauer T,Mitteregger G,et al.Synapse formation and function is modulated by the amyloid precursor protein[J].J Neurosci,2006,26(27):7212-7221.
[10]Abramov E,Dolev I,Fogel H,et al.Amyloid-beta as a positive endogenous regulator of release probability at hippocampal synapses[J].Nat Neurosci,2009,12(12):1567-76.
[11]LesnéS,Koh MT,Kotilinek L,et al.A specific amyloid-beta protein assembly in the brain impairs memory[J].Nature,2006,440(7082):352-357.
[12]Selkoe DJ.Soluble oligomers of the amyloid beta-protein impair synaptic plasticity and behaviour[J].Behav Brain Res,2008,192(1):106-113.
[13]Townsend M,Mehta T,Selkoe DJ.Soluble Abeta inhibits specific signal transduction cascades common to the insulin receptor pathway[J].J Biol Chem,2007,282(46):33305 -312.
[14]方瑾,马春梅,黄澜,等.London/Swedish双突变APP转基因小鼠的鉴定[J].中国比较医学杂志,2008,18(5):24 -27.

