艾叶用于动物实验室空气消毒的效果观察及吸入刺激实验
韩志刚,韦 莉,吴登虎,杨俊卿,潘永全
(1.重庆医科大学实验动物中心,重庆 400016;2.重庆动物园,重庆 400050; 3.重庆医科大学药理学教研室,重庆 400016)
动物实验室常用的空气消毒方法包括甲醛熏蒸、过氧乙酸喷雾、紫外线照射等。近年来,国内外许多学者开始尝试使用艾叶进行室内空气消毒并取得了一定效果。本实验观察艾叶用于动物实验室空气消毒的效果及其对实验动物的吸入刺激性,希望能为其应用于动物实验室空气消毒提供依据。
1 实验材料
1.1 药品及试剂
艾叶由重庆医科大学中医学院附属医院提供并鉴定;血液琼脂培养基由重庆庞通医疗器械有限公司提供。
1.2 实验动物
SD大鼠20只,体重(200±10)g,由重庆医科大学实验动物中心提供(生产许可证号:SCXK(渝) 2007-0001)。
1.3 主要仪器设备
303AS-2型电热培养箱,上海浦东跃欣科学仪器厂;PY4型大、小鼠隔离器,苏州新区枫桥实验动物笼具厂。
2 实验方法
2.1 艾叶熏蒸动物实验室空气消毒的效果观察
2.1.1 消毒方法:分别用艾叶1 g/m3、2 g/m3、4 g/ m3的剂量对大小相同(25 m2)的三间空动物实验室进行熏蒸消毒。将艾叶放在金属网上置于房间中央地上,点燃艾叶,但不需燃成火苗,只需不断产生烟雾状气体扩散到室内空间,立即离开,密闭房间,让其自然燃烧怠尽,采样后开窗通风。
2.1.2 采样方法:消毒前及消毒后12 h各采样1次。按照国标14925-2001实验动物环境空气落下菌数检测方法,每5~10 m2设置1个测定点的标准,将4个血液琼脂培养皿放于房间地面上,均匀分布。平皿打开后放置30 min,加盖,放于37℃恒温培养箱内培养48 h后计CFU[(colony form ing units,CFU),个/皿]。
按照以上方法分别对三间动物实验室进行空气消毒及采样,每周1次,连续10周。
2.1.3 判断标准及计算、统计方法:按照国标14925-2001动物实验环境落下菌数指标标准:普通环境CFU≤30个/皿为合格。4个测定点CFU的平均值作为该组该次采样的CFU,以此数据判断该次检测CFU是否合格,消毒10次后计算各组消毒合格率(%)。实验数据用±s表示,运用SPSS11.5统计软件进行单因素方差分析,组间两两比较用LSD法,以P<0.05为差异有显著性。
2.2 艾叶熏蒸消毒对实验动物的吸入刺激实验
将40只SD大鼠分为对照组和艾叶低、中、高剂量组,每组10只,分别放在空间为1.5 m3的4个隔离器内。分别用艾叶1 g/m3、2 g/m3、4 g/m3的剂量对低、中、高剂量组隔离器进行熏蒸消毒,方法同上。消毒12 h后将各组大鼠脱颈椎处死并解剖,取肺组织,用4%甲醛溶液固定,常规石蜡包埋切片,HE染色,光镜下观察肺组织形态学的变化。
3 结果
3.1 艾叶熏蒸动物实验室空气消毒的效果观察
三个剂量艾叶消毒结果显示(表1):消毒前,低、中、高剂量组CFU均不合格,且组间差异无显著性。消毒后12 h,各组CFU均合格,低剂量组与中、高剂量组差异显著(P<0.05),中、高剂量组组间差异不显著;消毒10次,低剂量组合格率为80%,中、高剂量组均为100%。
表1 不同剂量艾叶消毒前后CFU(±s)及合格率Tab.1 CFU(±s)before and after air disinfection with Folium Artemisiae argyi and the eligible rate in different dose groups
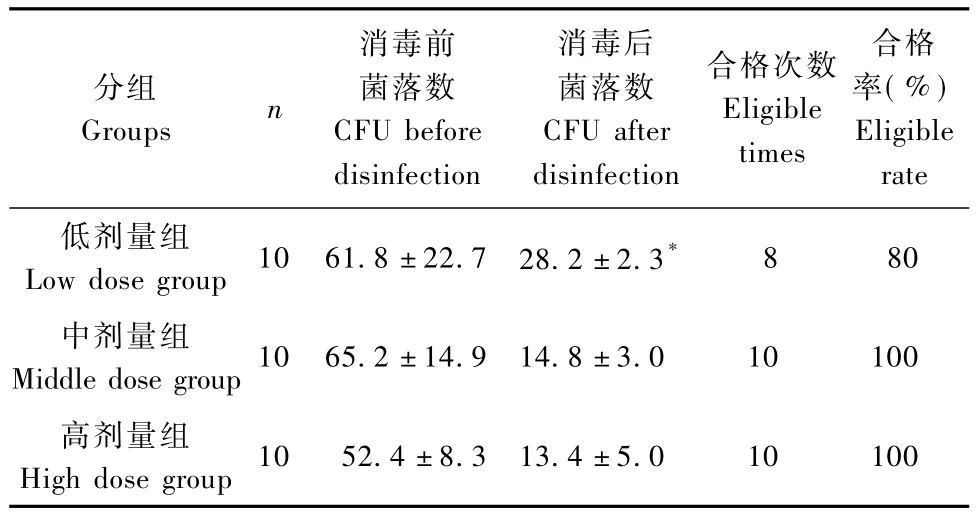
表1 不同剂量艾叶消毒前后CFU(±s)及合格率Tab.1 CFU(±s)before and after air disinfection with Folium Artemisiae argyi and the eligible rate in different dose groups
*分别与中、高剂量组比较,P<0.05Note:vs.midd le-dose group and high-dose group,P<0.05
分组Groups n消毒前菌落数CFU before disinfection消毒后菌落数CFU after disinfection合格次数Eligible times合格率(%) Eligible rate低剂量组Low dose group 10 61.8±22.7 28.2±2.3*8 80中剂量组Middle dose group 10 65.2±14.9 14.8±3.0 10 100高剂量组High dose group 10 52.4±8.3 13.4±5.0 10 100
3.2 艾叶熏蒸消毒对实验动物的吸入刺激实验
光镜下观察,对照组大鼠肺内小支气管上皮无倒状,管壁无炎症细胞浸润,管腔内无分泌物;肺泡管及肺泡无扩张、萎陷;肺泡腔内无出血和水肿液,肺泡上皮无损伤;肺泡壁无增厚和炎症细胞浸润,肺毛细血管无扩张、充血(图1A-B)。与对照组比较,低、中、高剂量组大鼠肺组织均出现不同程度的病理变化,表现为肺内小支气管腔内分泌物增多;肺毛细血管充血;肺泡壁增宽,肺泡壁内见中性粒细胞浸润;肺泡上皮肿胀,个别肺泡腔内见出血(图1C-H)(图1见彩插5)。
4 讨论
对动物实验室进行日常空气消毒是预防疾病、防止交叉感染的重要措施,也是控制动物实验室环境质量的重要内容之一。传统的空气消毒法包括甲醛熏蒸、过氧乙酸喷雾、紫外线照射等[1],但都存在一定局限性,如甲醛、过氧乙酸对人体、动物的刺激性和毒性[2-6],紫外线的毒性及消毒效果的受限性等[7]。
中药艾叶(Folium Artemisiae argyi)是中医常用药之一,为菊科植物艾的干燥叶,药用历史悠久。艾叶对多种病原微生物有杀灭或抑制作用[8]。近年来,国内外许多学者开始尝试使用艾叶进行室内空气消毒并取得了一定效果[9-13]。笔者查阅大量文献,未见艾叶用于动物实验室空气消毒的实验研究。
三种剂量艾叶消毒结果显示,消毒前,三个组CFU均不合格,且组间差异无显著性,表明消毒前三个房间菌落数水平相当。消毒后12 h,各组CFU均合格,这表明三种剂量艾叶对动物实验室空气均有一定的消毒作用。消毒10次后统计,低剂量组合格率为80%,中、高剂量组合格率均为100%。低剂量组菌落数与中、高剂量组差异显著(P<0.05),中、高剂量组组间差异不显著。这表明中、高剂量组消毒效果相当且优于低剂量组。由此提示,艾叶用于动物实验室空气消毒的较佳剂量为中剂量组的2 g/m3。
由于大鼠对空气污染非常敏感,常被用作空气污染、有害气体慢性中毒等方面的研究[14],故本实验选用大鼠进行吸入刺激实验。结果显示,与对照组比较,低、中、高剂量组大鼠肺组织均出现不同程度的炎性病变,表明艾叶薰蒸消毒对大鼠呼吸系统有刺激性损伤。此结果与张大维等[4]所做过氧乙酸吸入刺激实验的结果类似。尽管三个剂量的大鼠肺组织均出现不同程度的损伤,但其表现却并不规律。同组10只大鼠肺组织的损伤程度并不一致;组间比较,也不能看出损伤程度与艾叶剂量之间的关系。于此,作者正在做进一步的实验研究,以探索其中的相关性,希望对今后的实际应用作出指导。
综上所述,艾叶熏蒸对动物实验室有一定消毒效果,可以作为动物实验室日常消毒的方法之一,但由于其对实验动物呼吸系统有刺激性损伤,表明此方法也存在类似传统消毒方法的局限性,因此使用时须控制好浓度和剂量,且不宜长期使用,应与其它消毒方法交替使用为宜。
[1]刘恩岐,尹海林,顾为望,主编.医学实验动物学[M].北京:科学出版社,2008:54.
[2]顾为望,黄韧,潘甜美,主编.实验动物屏障设施建设与管理[M].西安:陕西科学技术出版社,2002:66-67.
[3]张大维,邴国强,李萍,等.2%含量的过氧乙酸眼刺激实验[C].中国实验动物学会第七届学术年会论文集.桂林:中国实验动物学会,2006:278-281.
[4]张大维,邴国强,李萍等.2%含量的过氧乙酸吸入刺激实验[C].中国实验动物学会第七届学术年会论文集.桂林:中国实验动物学会,2006:282-284.
[5]张大维,邴国强,李萍,等.0.2%戊二醛、0.2%过氧乙酸、2%过氧乙酸、0.2%次氯酸钠皮肤毒性实验[C].中国实验动物学会第七届学术年会论文集.桂林:中国实验动物学会,2006:285-287.
[6]张大维,邴国强,李萍等.2%过氧乙酸吸入毒性实验[C].中国实验动物学会第七届学术年会论文集.桂林:中国实验动物学会,2006:288-290.
[7]梅全喜,高玉桥.中药艾叶空气消毒研究近况[J].中医药学刊,2005,23(9):1581-1582.
[8]李慧.艾叶的药理研究进展及开发应用[J].基层中药杂志,2002,16(3):51-53.
[9]赵俐玲,余素飞.3种空气消毒法的效果比较[J].中华现代护理杂志,2001,7(12):5-6.
[10]姜文全,崔彩萍.艾叶熏蒸用于母婴同室空气消毒[J].西北药学杂志,2 002,17(2):80-81.
[11]赖胜芳,梁秀兰,冯超英,等.苍术、艾叶熏蒸发热门诊空气的消毒效果分析[J].现代临床护理,2004,3(2):17-18.
[12]丁丽,尹莲蓉.福利机构婴儿室艾叶熏蒸空气消毒剂量的探讨[J].中国民康医学,2006,18(4):300-302.
[13]蔡彩萍.母婴同室病房艾叶消毒效果观察[J].温州医学院学报,2006,36(3):296-297.
[14]孙靖,主编.实验动物学基础[M].北京:北京科学技术出版社,2005:56.
——硫酰氟熏蒸应用技术

