微生物来源的Aurora-B激酶抑制剂的分离、结构鉴定和抗肿瘤活性研究
牛玉强,姜威,余利岩,王彦昶,李妍,司书毅
微生物来源的Aurora-B激酶抑制剂的分离、结构鉴定和抗肿瘤活性研究
牛玉强,姜威,余利岩,王彦昶,李妍,司书毅
目的从微生物代谢产物中分离和纯化 Aurora-B 激酶抑制剂并检测其抗肿瘤活性。
方法以野生型酵母菌 Y300 和ipl1-321 温度敏感型突变株为模式菌跟踪活性组分;从阳性放线菌 I07A-01038 发酵产物中分离纯化活性化合物并进行结构鉴定;体外酶学实验验证阳性化合物对 Aurora-B 激酶的抑制活性;MTT 法检测阳性化合物对肿瘤细胞增殖的抑制活性;AnnexinVFITC/PI 双染法检测活性化合物对肿瘤细胞早期凋亡的诱导作用。
结果从阳性放线菌 I07A-01038 发酵产物中得到活性化合物酒渣碱甲酯(flazin methyl ester),酒渣碱甲酯对ipl1-321 突变株具有特异性抑制作用,其在野生型酵母菌株 Y300 和突变株ipl1-321 的 IC50分别为 48 μmol/L 和24 μmol/L;体外酶学实验证实其对 Aurora-B 激酶具有抑制作用,其 IC50为 10 μmol/L(ATP = 50 μmol/L);酒渣碱甲酯对 HepG2、A549、Hela 肿瘤细胞均具有杀伤活性,IC50分别为 13、11 和 10 μmol/L。并能够诱导 Hela 细胞发生早期凋亡。
结论得到一个微生物来源的具有抗肿瘤活性的 Aurora-B激酶抑制剂—酒渣碱甲酯。
磷酸转移酶类; 细胞抑制剂; 细胞增殖;细胞凋亡
激光激酶(aurora 激酶)家族的成员在细胞有丝分裂的过程中,参与中心体成熟、染色体固缩、核膜破裂、中心体分离、双极纺锤体组装、染色体分离及胞质分裂等多个过程,通过将其底物磷酸化来调节中心体、纺锤体、染色体或者细胞骨架的变化[1]。最近几年,多项研究表明,在人的多种肿瘤细胞中出现Aurora激酶家族成员的过表达,可通过干扰其活性从而抑制肿瘤细胞的生长[2]。作为容易被抑制的激酶,Aurora 家族成员被认为是极有希望的肿瘤化疗的药物靶标。
本室用酵母突变株ipl1-321 对样品库进行Aurora-B 激酶抑制剂的筛选,得到多个具有Aurora-B 激酶抑制活性的阳性化合物[3]。本研究就是从前期筛选到的阳性菌株发酵液中提取活性成分并研究其抗肿瘤活性。
1 材料和方法
1.1 材料
1.1.1 试剂与培养基 乙酸乙酯、甲醇、丙酮,均为分析纯,购自北京化工厂;F-12、MEM、DMEM培养基、胎牛血清均购自赛默飞世尔生物化学制品(北京)有限公司;HTScan(R) Aurora B Kinase Assay Kit(#7513)试剂盒购自美国 CST 公司;AnnexinVFITC/PI 细胞凋亡检测试剂盒购自凯基生物公司。1.1.2 菌种与细胞株 放线菌株 I07A-01038 由本所菌种保藏中心提供;酵母菌株 Y300(Mata ura3-1his3-11,15lue2-3,112trp1-1ade2-1can1-100)由美国佛罗里达州立大学 Elledge 实验室惠赠;ipl1-321(Mata ipl1-321DAM1-HA-his5+)由本实验室保存;A549 人肺腺癌细胞株为本实验室保存,于 F-12 培养基中培养;HepG2 人肝胚细胞瘤细胞株为本实验室保存,于 MEM 培养基中培养;Hela人宫颈癌细胞株为本实验室保存,于 DMEN 培养基中培养。
1.1.3 主要仪器 酶标仪为美国 PerkinElmer 公司的 EnVision;流式细胞仪为美国 BD 公司的FACSCalibur;HPLC 为日本 Shimadzu 公司的Shimadzu LC-10A vp 泵和 SPD-M10Avp 检测器;核磁共振仪为美国 Varian 公司的 INOVA-501型;质谱仪为英国 Micromass 公司的 Autospec-Ultima-Tof。
1.2 方法
1.2.1 活性化合物的提取、分离、纯化 将 30 L放线菌 I07A-01038 的发酵液离心,收集菌丝体,丙酮浸泡过夜。旋转蒸发去除丙酮后,放在通风橱吹风过夜。用等体积的乙酸乙酯萃取 3 次,旋转蒸发去除乙酸乙酯,粗品用少量的甲醇溶解,过Φ30 mm × 400 mm 的 ODS 柱。用 50%、60%、70%、80%、90%、100% 的甲醇梯度洗脱,分部收集。用酵母菌株ipl1-321 突变株和 Y300 检测活性部分,把有活性的 70% 甲醇的第四个洗脱体积旋转蒸干,经 HPLC 鉴定为单组分,纯度达 95%以上。
1.2.2 活性化合物对 Aurora-B 激酶的抑制作用 根据 HTScan(R) Aurora B Kinase Assay Kit 试剂盒说明建立体外测活方法:于普通 96 孔板中将100 ng 纯化的重组人 Aurora-B 激酶与不同浓度的活性化合物室温孵育 15 min;设立空白对照(不加活性化合物)和本底(不加一抗和活性化合物);于每个反应体系中加入生物素标记的底物多肽和预冷的腺嘌呤核苷三磷酸(ATP),使底物多肽和 ATP的终浓度分别为 1.5 μmol/L 和 50 μmol/L,室温孵育 30 min;每孔中加入 50 μl 终止液(50 mmol/L二乙胺四乙酸,pH = 8)终止反应。把 25 μl 上述反应体系加到含有 75 μl 去离子水的链霉亲和素包被的 96 孔板中(每孔设立 3 个复孔);室温孵育 60 min,洗板 3 次;然后按顺序加入一抗,洗板 3 次;加入二抗,洗板 3 次;加入 TMB 底物15 min 后,每孔加入 100 μl 的终止液(2 mol/L H2SO4),450 nm 处检测各孔的吸光度。活性化合物对 Aurora-B 激酶抑制率按下列公式计算:
抑制率% =(1 - A/B)× 100%A:各实验组吸光度均值 - 本底吸光度均值B:空白对照组吸光度均值 - 本底吸光度均值1.2.3 MTT 法检测活性化合物对肿瘤细胞的增殖抑制作用 取对数生长期肿瘤细胞,消化、计数,调节细胞浓度至 1 × 105个/ml,加入 96 孔板中,每孔 100 μl,于 37 ℃、5% CO2培养箱中培养过夜。设立空白对照。实验组加入不同浓度的活性化合物溶液,对照组加入等体积的含 0.05% 二甲基亚砜(DMSO) 的细胞完全培养液,每组均设 4 个复孔,置培养箱中培养 72 h 后,小心吸出孔内液体,然后每孔加入由细胞培养液配制的终浓度为1 mg/ml 的 MTT 100 μl,继续培养 4 h 后,小心吸出孔内液体,加 150 μl DMSO,充分振荡 10 min,溶解结晶物,于酶标仪 490 nm 处测吸光度值,计算各组 4 个复孔的平均值,计算细胞生长抑制率。实验重复 3 次,以细胞生长抑制率及药物浓度作曲线,计算 IC50。细胞生长抑制率 =[(对照组吸光度平均值 - 实验组吸光度平均值)/对照组吸光度平均值]× 100%。
1.2.4 AnnexinV-FITC/PI 双染法检测早期细胞凋亡 将处于对数生长期的肿瘤细胞以1 × 105个/ml的浓度接种于 6 孔细胞培养板中,待细胞贴壁后,加入终浓度为 0、10、20 mg/ml 的活性化合物细胞培养液,并设置空白对照组。加药 30 h 后用 0.25%的胰蛋白酶消化细胞,细胞悬液移入洁净试管中,于 4 ℃ 条件下 100 ×g离心 5 min 沉淀细胞,弃上清液后用冷 PBS 缓冲液洗 2 次。将收集的细胞重悬于 100 μl 结合缓冲液中,分别加入 5 μl AnnexiV-FITC 和 5 μl PI 溶液,轻轻混匀后室温避光反应 15 min,反应结束后再加入 400 μl 结合缓冲液,流式细胞仪检测。
2 结果
2.1 活性化合物的结构鉴定
经过对放线菌 I07A-01038 的发酵,30 L 发酵液经分离、纯化,得到活性化合物纯品 20 mg,纯度在 95% 以上。该化合物纯品为淡黄色粉末,易溶于甲醇、丙酮、三氯甲烷、乙酸乙酯等常见的有机溶剂。由 FAB-MS 的测定显示该化合物的分子式为 C18H14N2O4,分子量为 322.31。对该化合物进行了1H-NMR 和13C-NMR 的测定,数据见表 1。

表 1 酒渣碱甲酯的 1H-NMRa、13C-NMRb、1H-1H COSYa 和 HMBC数据Table 1 1H-NMRa、13C-NMRb、1H-1H COSYa and HMBC of flazin methyl ester
由理化性质、分子量、1H-NMR 及13C-NMR核磁谱的测定数据,并结合文献[4-7],确定该化合物的结构为酒渣碱甲酯(flazin methyl ester),为β-咔啉碱类衍生物(图 1)。

图 1 酒渣碱甲酯的化学结构Figure 1 Structure of flazin methyl ester
2.2 酒渣碱甲酯在酵母细胞上的 MIC 的确定
酒渣碱甲酯在 24 μmol/L 即能抑制ipl1-321温度敏感型突变株的生长,而抑制 Y300 的 MIC为 48 μmol/L。
2.3 酒渣碱甲酯对 Aurora-B 激酶的抑制作用
以抑制率为纵坐标,log[μmol/L]为横坐标,绘制浓度-效应曲线,并以 OrigenPro 7.5 软件拟合(图 2)。显示随着酒渣碱甲酯浓度的升高Aurora-B 激酶活性逐渐降低,并呈剂量依赖性,其IC50为 10 μmol/L(ATP = 50 μmol/L 时)。
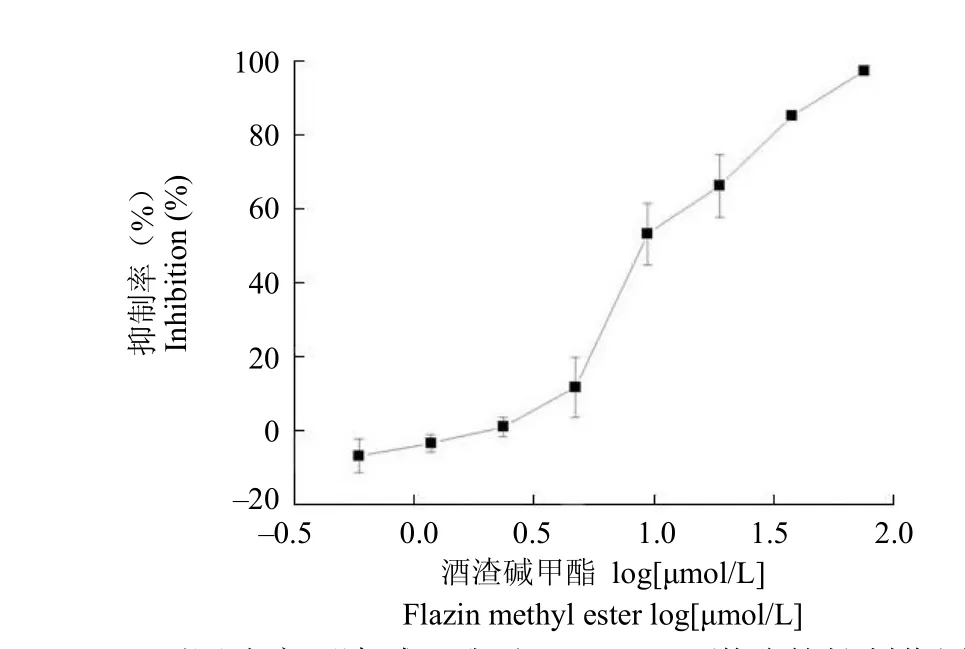
图 2 不同浓度酒渣碱甲酯对 Aurora-B 激酶的抑制作用Figure 2 The effect of flazin methyl ester on the kinase activity of Aurora-B
2.4 MTT 法检测酒渣碱甲酯对肿瘤细胞的增殖抑制作用
酒渣碱甲酯能够抑制肿瘤细胞增殖,并呈剂量依赖性(图 3)。酒渣碱甲酯在肿瘤细胞HepG2、A549、 Hela 上的 IC50分别为 13、11 和10 μmol/L。
2.5 AnnexinV-FITC/PI 双染法检测细胞凋亡
在双变量流式细胞仪的散点图上(图 4),左下象限显示活细胞,为(FITC-/PI-);右下象限为早期凋亡细胞,显现(FITC+/PI-);而左上象限为坏死细胞(FITC-/PI+)。右上象限显示晚期凋亡细胞,

图 3 MTT 法测定不同浓度的酒渣碱甲酯对细胞增殖抑制作用的量效曲线图(A:HepG2;B:A549;C:Hela)Figure 3 Dose-effect curve of tumor cell proliferation effect in different concentration by flazin methyl ester (A: HepG2; B:A549; C: Hela)

图 4 Annexin V-FITC/PI 双染法检测 Hela 细胞凋亡Figure 4 Quantification of Hela sapoptosis by Annexin-FITC/PI analyses
不同时期细胞的百分比
Table 2 The percent of cells after 30 h treatment with different concentrations of flazin methyl ester为(FITC+/PI+)。酒渣碱甲酯处理 Hela 细胞 30 h后,处于不同时期的细胞百分比见表 2。结果显示,酒渣碱甲酯可以诱导 Hela 细胞发生早期凋亡。

表 2 酒渣碱甲酯处理 Hela 细胞 30 h 后
3 讨论
有丝分裂是一个比较复杂的生物学过程,生物体本身具有一整套监测机制,以确保遗传物质能准确地分配到子细胞中,Aurora 激酶在这个过程中起着重要作用。同时,Aurora 激酶的活性和定位以及其功能的正常执行也受到其上游调控分子和伙伴分子的调控。酵母基因组只编码一个激光激酶 IPL1,而哺乳动物中有三个成员:Aurora-A、Aurora-B 和Aurora-C[8-11]。目前,已经发现多种包括 ZM447439、VX-680、Hesperadin 在内的小分子 Aurora 激酶抑制剂,并已经进入临床研究阶段[12-15]。
Ipl1-321 温度敏感型突变酵母菌株在 25 ℃时生长良好,但在 37 ℃ 时不能生长,即使在 25 ℃条件下,其 IPL1 激酶活性也受到部分损伤[16],故该菌株比野生型对激光激酶抑制剂更敏感。本实验室曾以其为模型筛选了化合物库,得到具有Aurora-B 激酶抑制活性的化合物 Jadomycin B 及其两个衍生物,证实了该模型能够用于 Aurora-B激酶抑制剂的高通量筛选。本研究从前期筛选得到的阳性菌株代谢产物中分离到具有 Aurora-B 激酶抑制活性的化合物酒渣碱甲酯,说明该模型也可以用于从微生物代谢产物中发现新的 Aurora-B 激酶抑制剂。
酒渣碱甲酯属于 β-咔啉碱类化合物,Shiomi等[17]曾于 2005年从链霉菌中分离得到,但是其抗肿瘤活性尚未见文献报道。此外,β-咔啉碱类是多靶点的抗肿瘤物质[18-19],不同结构的 β-咔啉碱化合物抗肿瘤活性有很大差异[20],目前该类化合物的研究方向主要是通过结构改造,以寻找更好的抗肿瘤衍生物[21-23]。本研究首次发现其具有 Aurora-B 激酶的抑制活性和抗肿瘤活性,可能对该类化合物抗肿瘤机制的深入研究以及结构改造具有比较重要的意义。
在对 I07A-01038 活性组分分离纯化过程中我们还发现了其他在酵母模型上有抑制活性的成分,进一步纯化有可能找到其他 Aurora-B 激酶抑制剂。
[1]Cheeseman IM, Anderson S, Jwa M, et al.Phospho-regulation of kinetochore-microtubule attachments by the Aurora kinase Ip11p.Cell,2002, 111(2):163-172.
[2]Meraldi P, Honda R, Nigg EA.Aurora kinases link chromosome segregation and cell division to cancer susceptibility.Curr Opin Genet Dev, 2004, 14(1):29-36.
[3]Fu DH, Jiang W, Zheng JT, et al.Jadomycin B, an Aurora-B kinase inhibitor discovered through virtual screening.Mol Cancer Ther, 2008,7(8):2386-2393.
[4]Su BN, Chang LC, Park EJ, et al.Bioactive constituents of the seeds of Brucea javanica.Planta Med, 2002, 68(8):730-733.
[5]Dong ZJ, Wang F, Wang RR, et al.Chemical constituents of fruiting bodies from basidiomycete Suillus granulatus and their anti-HIV-1 activity.Chin Traditional Herbal Drugs, 2007, 38(3):337-339.(in Chinese)
董泽军, 王飞, 王睿睿, 等.点柄乳牛肝菌子实体中抗 HIV-1活性成分.中草药, 2007, 38(3):337-339.
[6]Shaaban M, Schröder D, Shaaban KA, et al.Flazin, perlolyrin, and other β-carbolines from marine derived bacteria.Rev Latinoamer Quím, 2007, 35(3):58-67.
[7]Wang YH, Tang JG, Wang RR, et al.Flazinamide, a novel beta-carboline compound with anti-HIV actions.Biochem Biophys Res Commun, 2007, 355(4):1091-1095.
[8]Biggins S, Severin FF, Bhalla N, et al.The conserved protein kinase Ipl1 regulates microtubule binding to kinetochores in budding yeast.Genes Dev, 1999, 13(5):532-544.
[9]Chu Y, Yao PY, Wang W, et al.Aurora B kinase activation requires survivin priming phosphorylation by PLK1.J Mol Cell Biol, 2010:1-9.
[10]Zeitlin SG, Shelby RD, Sullivan KF.CENP-A is phosphorylated by Aurora B kinase and plays an unexpected role in completion of cytokinesis.J Cell Biol, 2001, 155(7):1147-1157.
[11]Goto H, Yasui Y, Nigg EA, et al.Aurora-B phosphorylates Histone H3 at serine28 with regard to the mitotic chromosome condensation.Genes Cells, 2002, 7(1):11-17.
[12]Wilkinson RW, Odedra R, Heaton SP, et al.AZD1152, a selective inhibitor of Aurora B kinase, inhibits human tumor xenograft growth by inducing apoptosis.Clin Cancer Res, 2007, 13(12):3682-3688.
[13]Hardwicke MA, Oleykowski CA, Plant R, et al.GSK1070916, a potent Aurora B/C kinase inhibitor with broad antitumor activity in tissue culture cells and human tumor xenograft models.Mol Cancer Ther, 2009, 8(7):1808-1817.
[14]Soncini C, Carpinelli P, Gianellini L, et al.PHA-680632, a novel Aurora kinase inhibitor with potent antitumoral activity.Clin Cancer Res, 2006, 12(13):4081-4089.
[15]Hauf S, Cole RW, LaTerra S, et al.The small molecule Hesperadin reveals a role for Aurora B in correcting kinetochore-microtubule attachment and in maintaining the spindle assembly checkpoint.J Cell Biol, 2003, 161(2):281-294.
[16]Kotwaliwale CV, Frei SB, Stern BM, et al.A pathway containing the Ipl1/aurora protein kinase and the spindle midzone protein Ase1 regulates yeast spindle assembly.Dev Cell, 2007, 13(3):433-445.
[17]Shiomi K, Hatae K, Hatano H, et al.A new antibiotic, antimycin Ag,produced by Streptomyces sp.K01-0031.J Antibiot (Tokyo), 2005,58(1):74-78.
[18]Ishida J, Wang HK, Bastow KF, et al.Antitumor agents 201.Cytotoxicity of harmine and beta-carboline analogs.Bioorg Med Chem Lett, 1999, 9(23):3319-3324.
[19]Cao R, Peng W, Chen H, et al.Synthesis and in vitro cytotoxic evaluation of 1,3-bisubstituted and 1,3,9-trisubstituted beta-carboline derivatives.Eur J Med Chem, 2005, 40(3):249-257.
[20]Li Y, Liang F, Jiang W, et al.DH334, a beta-carboline anti-cancer drug,inhibits the CDK activity of budding yeast.Cancer Biol Ther, 2007,6(8):1193-1199.
[21]Zhang J, Li Y, Guo L, et al.DH166, a beta-carboline derivative,inhibits the kinase activity of PLK1.Cancer Biol Ther, 2009,8(24):2374-2383.
[22]Ishida J, Wang HK, Bastow KF, et al.Antitumor agents 201.Cytotoxicity of harmine and beta-carboline analogs.Bioorg Med Chem Lett, 1999, 9(23):3319-3324.
[23]Kou PC, Shi LS, Damu AG, et al.Cytotoxic and antimalarial beta-carboline alkaloids from the roots of Eurycoma longifolia.J Nat Prod, 2003, 66(10):1324-1327.
www.cmbp.net.cn Chin Med Biotechnol, 2011, 6(2):116-120
Isolation, structure identification and anti-tumor activity of potential small-molecular inhibitor of human Aurora-B kinase from microbial nature products
NIU Yu-qiang, JIANG Wei, YU Li-yan, WANG Yan-chang, LI Yan, SI Shu-yi
ObjectiveTo find potential small-molecular Aurora-B kinase inhibitors from microbial metabolites and research on anti-cancer activity.
MethodsIn vitrobiochemical assay was performed to test the inhibition of candidates determined by screening with wild-type yeast strain andipl1-321 temperature sensitive strain.MTT assay was used to evaluate the inhibitory effect of flazin methyl ester on the proliferation of tumor cells.Annexin V-FITC and PI were performed to determine the induction of flazin methyl ester on the early apoptosis of tumor cells.
ResultsThe compound 70-4 named flazin methyl ester was isolated and purified from the fermentation products of a positive strain I07A-01038.The flazin methyl ester inhibited the growth ofipl1-321 temperature sensitive mutant more dramatically than the wild-type yeast cells, and its MIC was 24 μmol/L and 48 μmol/L.The flazin methyl ester inhibited Aurora-B kinase activityin vitro,and its IC50was 10 μmol/L when the ATP concentration was 50 μmol/L.The flazin methyl ester inhibited the growth of tumor cells,such as HepG2, A549 and Hela , and its IC50was 13, 11 and 10 μmol/L respectively.The flazin methyl ester could induce early apoptosis of tumor cells, Hela.
Conclusion A potential small-molecular inhibitor of human Aurora-B kinase, flazin methyl ester, was obtained.
Phosphotransferases; Cytostatic agents; Cell proliferation; Apoptosis
s: LI Yan, Email: jnllyy@yahoo.com.cn; SI Shu-yi, Email: sisyimb@hotmail.com
www.cmbp.net.cn 中国医药生物技术, 2011, 6(2):116-120
10.3969/cmba.j.issn.1673-713X.2011.02.007
100050 北京,中国医学科学院医药生物技术研究所
李妍,Email:jnllyy@yahoo.com.cn;司书毅,Email:sisyimb@hotmail.com
2011-02-28
Author Affiliations: Institute of Medicinal Biotechnology, Chinese Academy of Medical Sciences, Beijing 100050, China
·论著·

