液相色谱-串联质谱分离鉴定树莓叶中黄酮类化合物
叶晓珂,秦 沛,李 伟,郭 璐,唐伟伟,王 硕
(天津科技大学食品工程与生物技术学院,食品营养与安全省部共建教育部重点实验室,天津 300457)
液相色谱-串联质谱分离鉴定树莓叶中黄酮类化合物
叶晓珂,秦 沛,李 伟,郭 璐,唐伟伟,王 硕
(天津科技大学食品工程与生物技术学院,食品营养与安全省部共建教育部重点实验室,天津 300457)
树莓叶作为一种新的黄酮资源,为了分析鉴定其黄酮类化合物的结构,采用高效液相色谱-二极管阵列-离子阱多级质谱(HPLC-PDA-MSn)联用技术分离鉴定树莓叶乙醇提取物中的黄酮类化合物。通过离子阱多级质谱提供的准分子离子峰和多级碎片离子信息,分析得到了黄酮类化合物的相对分子质量、黄酮糖苷的组成结构、黄酮糖苷中糖的类型和多糖链的连接次序等。结合液相色谱相对保留时间、标准品和相关文献对照,对树莓叶乙醇提取物中的15个黄酮类化合物的可能结构进行推断。结果表明,树莓叶中有8个槲皮素衍生化的黄酮化合物和7个山奈酚衍生化的黄酮化合物,这与树莓中主要含有槲皮素和山奈酚衍生化的黄酮化合物报道一致。
树莓叶;黄酮类化合物;分离鉴定;液相色谱-质谱法(HPLC-MSn);离子阱
树莓(Rubusidaeus)是蔷薇科悬钩子属多年生落叶小灌木植物,又名山莓、三叶泡、覆盆子、托盘、马林、梅子、插田泡等,我国野生树莓资源非常丰富。近年来,树莓果作为一种新型的果品加工类型和其独特的保健作用[1],引起了国内外广泛的研究。树莓全株都含有黄酮类化合物,尤以树莓叶中黄酮成分最为丰富。张敏[2]测得山莓叶中总黄酮含量为1.18mg/g。Venskutonis等[3]在树莓叶的乙醇提取物中鉴定出槲皮素-3-O-葡萄糖苷,槲皮素-3-β-葡萄糖醛酸苷,芦丁。Lee等[4]从悬钩子植物RhodiolasachalinensisA.Bor中分离出山奈酚。国外学者对该属植物的黄酮类成分进行研究,并对其中6个黄酮化合物的结构进行了鉴定[5]。国内学者[6-8]从本属植物中分离出儿茶素、山萘素苷、异鼠李素等黄酮类化合物。
目前,随着电喷雾离子(ESI)软电离技术的迅速发展,高效液相色谱-质谱(HPLC/MS)联用技术已成为分析天然产物复杂体系中微量化学成分强有力的工具。利用质谱这个具有高灵敏度的广谱检测器,不仅可以获得物质的相对分子质量,而且还可以利用碎片离子获得一些结构信息,尤其是借助多级串联质谱(MS/MS)可获得更为详细而系统的结构信息,从而实现黄酮等天然产物的在 线 结 构 鉴 定[9-11]。袁 帅 等[12]利 用HPLC-ESI-MS/MS技术识别了蓝莓提取物中的 黄 酮 醇 类 化 合 物。Colombo 等[13]利 用LC/MS技术研究了甘蔗渣和甘蔗叶中的黄酮类化合物,共鉴定出7种化合物。
本工作利用高效液相色谱-二极管阵列-离子阱多级质谱(HPLC-PDA-MSn)联用技术分析鉴定树莓叶乙醇提取物中的黄酮类化合物,为树莓叶中功能性活性成分的鉴定和研究提供理论依据。
1 材料与方法
1.1 仪器与设备
LCQ液相色谱-质谱联用仪:美国Finnigan公司产品,配有Suveyor二极管阵列(PDA)检测器、电喷雾离子源(ESI)、LCQ 离子阱(ion trap)及Xcalibur1.4数据处理系统;Hypersil GOLD色谱柱(100mm×2.1mm×3μm):美国Thermo公司产品;Centrifuge 5804R台式冷冻离心机:德国Eppendorf公司产品;Millipore超纯水系统:美国 Millipore公司产品;VGT-1730QT超声波清洗仪:美瑞泰克公司产品。
1.2 材料与试剂
树莓叶于10月份采摘于北京延庆树莓种植园。
乙腈、甲醇(色谱纯):美国 Merck公司产品;无水乙醇、乙酸、石油醚(分析纯):天津市化学试剂一厂公司产品;水为经Millipore超纯水系统处理过的超纯水。
1.3 样品处理方法
准确称取0.500 0g树莓叶片粉末,加入10 mLV(乙醇)∶V(水)=75∶10的溶液,65℃超声波中提取1h,在4℃下,4 500r/min离心分离20min,重复提取2次,收集滤液,备用。提取液用20mL石油醚反复萃取,除色素。取2.5 mL提取液,置于25mL容量瓶中,甲醇定容,稀释10倍。取1mL上述溶液,经0.22μm微孔有机滤膜过滤后进样。
1.4 实验条件
1.4.1 色 谱条 件 Hypersil GOLD 色 谱 柱(100mm×2.1mm×3μm);柱温:30℃;流动相:乙腈(A)和含0.1%乙酸的水(pH 3.2)(B);梯度洗脱:0~5min 15%~30%A,5~10min 30%~35%A,10~15min 35%~45%A,15~20min 45%~50%A,20~25min 50%~15%A,25~35min 15%A;流速:0.2mL/min;自动进样器进样量:10μL;二极管阵列检测器(PDA)全扫描波长:230~400nm。
1.4.2 质谱条件 电喷雾(ESI)离子源;毛细管温度275℃;电喷雾电压4.5kV;鞘气流速9 L/min;辅助气流速1.5L/min;扫描方式:负离子模式下全扫描;质量扫描范围:m/z100~700;离子阱多级串联质谱,选取各组分苷元为母离子(precursor ion),多级质谱分析采用50%的碰撞归一化能量。
2 结果与讨论
标准品山奈酚的相对分子质量为286,在负离子扫描模式下很容易丢失一个H,得到m/z285的准分子离子峰[M-H]-,示于图1a,在MS2中,准分子离子峰[M-H]-285失去一个中性小分子CO[M-28-H]-,得到m/z257的碎片离子;再失去一个中性小分子CH2[M-28-14-H]-,得到m/z243的碎片离子,若是失去一个中性小分子CO2[M-28-44-H]-,形成m/z213的碎片离子,示于图1b。
标准品槲皮素的相对分子质量为302,在负离子扫描模式下很容易丢失一个H,得到m/z301的准分子离子峰[M-H]-,示于图2a,在MS2中,准分子离子峰[M-H]-301的C环发生逆-狄尔斯-阿尔德(RDA)裂解,易产生 Ai,j-和Bi,j-
离子,1/3两个化学键发生断裂,产生 A1,3-或者 B1,3-离子,其中 A1,3-m/z151;0/4两个化学键发生断裂,产生[B0,4+H]-m/z179的碎片离子,示于图2b,其断裂方式示于图3。
对树莓叶乙醇提取物在上述实验条件下进行分析,共发现15种黄酮类化合物,其提取质谱总离子流图(EIC),示于图4。
把这15种物质作为母离子,碰撞归一化能量为50%,进行二级、三级、四级串联质谱分析,得到多级质谱碎片信息,列于表1。通过对15种物质的多级质谱碎片信息分析,可以推测出这些物质是由槲皮素和山奈酚衍生化的黄酮糖苷类化合物。
2、3、4、5、6、8、14号物质的 MS3碎片和7号物质的MS4碎片151,179刚好与标准品槲皮素的特征碎片离子相同,表明2、3、4、5、6、7、8、14号物质是槲皮素衍生化的黄酮糖苷;1、9、10、12、13、15号物质的 MS3碎片和11号物质的MS4碎片刚好与标准品山奈酚的特征碎片离子相同,表明1、9、10、11、12、13、15号物质是山奈酚衍生化的黄酮糖苷。

图1 山奈酚标准品在负离子扫描模式下的电喷雾质谱图(a)及其二级质谱图(b)Fig.1 ESI-MS spectrum of standard kaempfeol(a)and its MS2 spectrum(b)in negative ion mode

图2 槲皮素标准品在负离子扫描模式下的电喷雾质谱图(a)及其二级质谱图(b)Fig.2 ESI-MS spectrum of standard quercetin(a)and its MS2 spectrum(b)in negative ion mode

图3 槲皮素断裂方式Fig.3 Fragmentation of quertetin
黄酮类化合物主要以游离态或者与糖结合成苷的形式存在于自然界中,在质谱检测中,若对其施加一定的电压,很容易丢失中性碎片或者单(多)糖残基,骨架上每减少一个取代基,其相对分子质量相应有所减少。例如,羟基减17;甲氧基减30;氧键相连的六碳糖减162,如葡萄糖、半乳糖;氧键相连的糖醛酸减176,如葡萄糖醛酸;氧键相连的六碳去氧糖减146,如鼠李糖;氧键相连的五碳糖减132,如阿拉伯糖;氧键相连的二糖减308,如芸香糖。同时根据碎片断裂的不同顺序,还可以确定糖的连接次序[14]。因此,根据此规律以及文献中的报道,对这15种黄酮化合物的结构进行了推断。
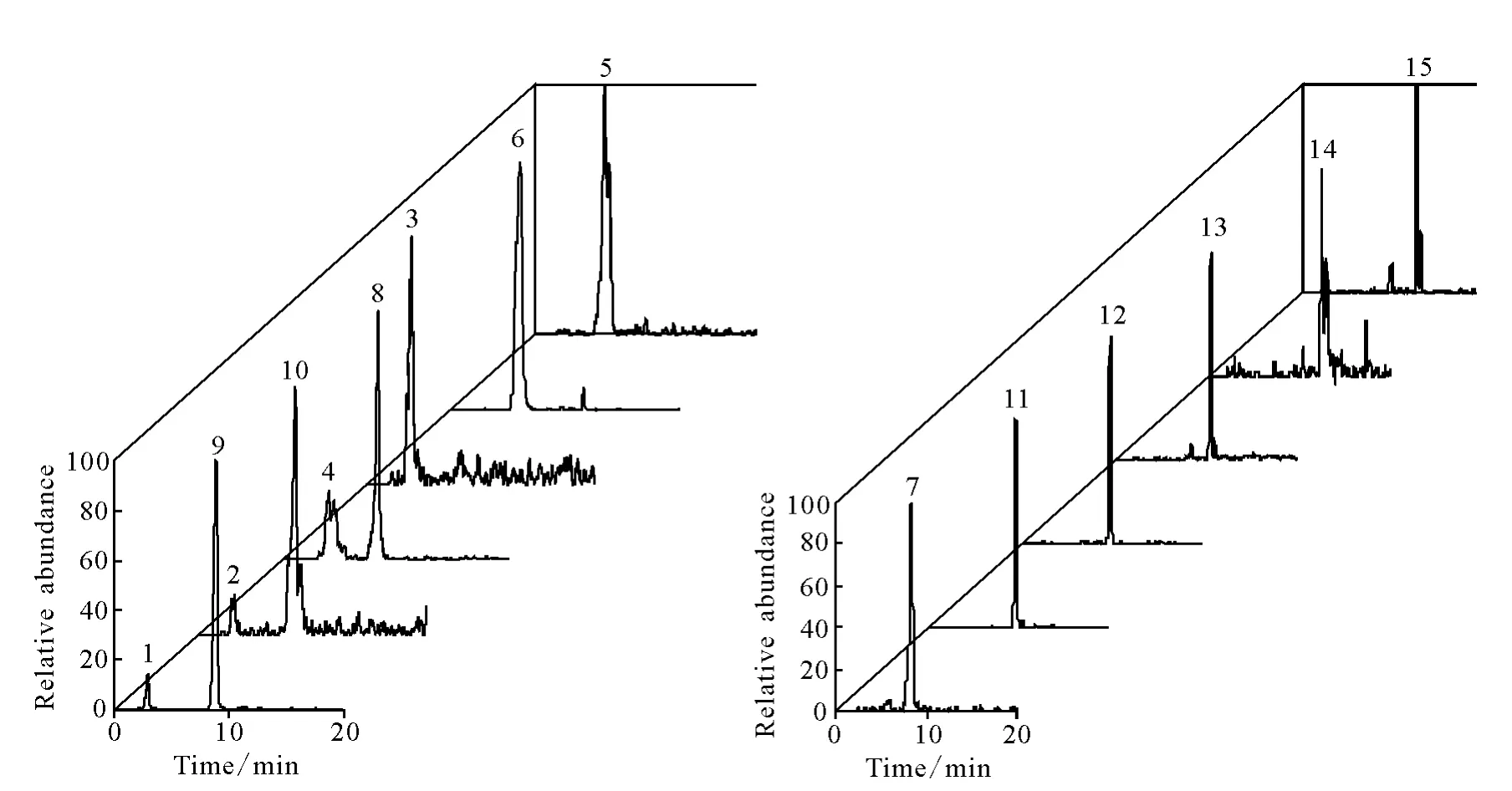
图4 树莓叶中15种黄酮化合物的提取离子流图Fig.4 Extracted ion chromatograms(EIC)of 15components of flavonoids in leaves of Rubusidaeus
1、9号峰,m/z都为461,即[M-H]- 为461,在1号峰的 MS2中,产生m/z285的二级碎片离子,即 [M-H-176]-,失去一个葡萄糖醛酸残基;在MS3中,m/z285的二级碎片离子产生m/z257的三级碎片离子,这与标准品山奈酚的碎片离子相同,因此可以推断1、9号峰为山奈酚衍生化的黄酮糖苷。Ryan等[15]报道在树莓中发现山奈酚-3-β-葡萄糖醛酸(kaempferol-3-β-glucuronide),因此1、9号峰推测为山奈酚-3-β-葡萄糖醛酸糖苷,可能由于两者单糖残基的空间位置不同,两者的液相色谱相对保留时间不同,因此两者为同分异构体,化学式为C21H18O12,相对分子质量为462。
2、10号峰,m/z都为447,即[M-H]-为447,根据一级质谱很难进行区别,但在MS2中,2号峰产生m/z301的二级碎片离子,即[MH-146]-,失去一个鼠李糖残基;10号峰产生m/z285的二级碎片离子,即[M-H-162]-,失去一个葡萄糖残基。在MS3中,2号峰的二级碎片离子m/z301产生m/z151,179的三级碎片离子,这与标准品槲皮素的碎片离子相同;10号峰的二级碎片离子m/z285产生m/z257的三级碎片离子,这与标准品山奈酚的碎片离子相同,因此,2、10号峰分别为槲皮素和山奈酚的衍生化黄酮类糖苷。根据2号峰失去一个脱氧己糖残基[16]即鼠李糖残基,产生m/z301的二级碎片离子,推测2号峰为槲皮素-3-O-鼠李糖苷(quercetin-3-O-rhamnoside);根据10号峰失去一个葡萄糖残基,产生m/z285的二级碎片离子,推 测 为 山 奈 酚-3-O-D-吡 喃 葡 萄 糖 苷(kaempferol-3-O-β-D-glucopyranoside)[17]。 因此,2、10号峰化学式为C21H20O11,相对分子质量为448。
3、7号峰,m/z为609,即[M-H]-为609,3号峰在MS2中,产生m/z301的碎片离子,即[M-H-308]-,失去一个芸香糖残基;7号峰在MS2中,产生m/z447的二级碎片离子,即[M-H-162]-,在 MS3中,产生m/z301的三级碎片离子,即[M-H-162-146]-。根据两者的碎片信息可知,3号峰直接产生m/z301的二级碎片离子,没有出现任何中间碎片离子;7号峰的三级碎片离子也为m/z301的离子,但7号峰出现了中间碎片离子,即m/z447的二级碎片离子。3号峰的这种没有出现中间碎片离子的断裂为芸香糖苷特有的断裂方式,因此,3号峰推断为槲皮素-3-O-芸香糖苷(quercetin-3-O-rutinoside),也即芦丁(rutin),是一种广泛存在于植物中黄酮类化合物。根据7号峰的二级、三级碎片信息,推测为槲皮素-3-O-葡萄糖-鼠李糖苷(quercetin-3-O-glucosylrhamnoside)。两者的化学式为C27H30O16,相对分子质量为610。
4、8号峰,m/z都为433,即 [M-H]- 为433,在 MS2中,产生m/z301的碎片离子,即[M-H-132]-,失去一个阿拉伯糖残基或者木糖残基。Wang等[18]报道在该属植物Rubus pungens中 发 现 槲 皮 素-3-O-α-阿 拉 伯 糖 苷(quercetin-3-O-α-arabinopyranoside)。因 此,4、8号峰推测为槲皮素-3-O-α-阿拉伯糖苷,可能由于两者单糖残基的空间位置不同,两者在液相色谱柱的流出时间不同,因此推测两者为同分异构体,化学式为C20H18O11,相对分子质量为434。
5号峰,m/z为463,即[M-H]-为463,在MS2中,产生m/z为301的碎片离子,即[MH-162]-,失去一个葡萄糖基或者半乳糖基。Gudej等[19]报道在树莓叶中发现有槲皮素-3-O-β-D-吡喃葡萄糖苷(quercetin-3-O-β-D-glucopyranoside),在同属植物Rubuscoreanum中也发现有此类物质。因此5号峰为槲皮素-3-O-β-D-葡萄糖苷,化学式为C21H20O12,相对分子质量为464。

表1 树莓叶乙醇粗提取物中黄酮类化合物保留时间、多级质谱特征离子碎片Table 1 Retention time and fragments ions of flavonoids in leaves of Rubusidaeus
6号峰,m/z为477,即[M-H]-为477,在MS2中,产生m/z301的碎片离子,即[M-H-176]-,失去一个葡萄糖醛酸残基。Lee等[20]报道在同属植物Rubuscoreanum中发现槲皮素-3-β-葡萄糖醛酸(quercetin-3-β-glucuronide)。因此6号峰为槲皮素-3-β-葡萄糖醛酸糖苷,化学式为C21H18O13,相对分子质量为478。
11、15号峰,m/z为593,即 [M-H]- 为593,11号峰在MS2中,产生m/z477的二级碎片离子,即[M-H-146]-,失去一个鼠李糖残基。在 MS3中,m/z477产生m/z285的三级碎片离子,即[M-H-146-162]-,失一个葡萄糖残基。然而,15号峰在 MS2中,直接产生m/z285的碎片离子,即[M-H-308]-,失去一个芸香糖残基。根据对3、7号峰的碎片断裂机理的讨论,可以推断11号峰为山奈酚-3-O-葡萄 糖-鼠 李 糖 苷 (kaempferol-3-O-glucosylrhamnoside),15 号 峰 为 山 奈 酚-3-O-芸 香 糖 苷(kaempferol-3-O-rutinoside)。两者的化学式为C26H28O15,相对分子质量为594。
12号峰,m/z为417,即[M-H]-为417,在MS2中,产生m/z285的碎片离子,即[MH-132]-,失去一个阿拉伯糖残基或者木糖残基。Wang等[18]报道在同属植物树莓Rubus pungens中发现有山奈酚-3-O-α-L-阿拉伯糖苷(kaempferol-3-O-α-L-arabinopyranoside)。因此12 号 峰 推 测 为 山 奈 酚-3-O-阿 拉 伯 糖 苷(kaempferol-3-O-arabinopyranoside),化学式为C19H16O10,相对分子质量为418。
13号峰,m/z为469,即[M-H]-为469,在MS2中,产生m/z285的碎片离子,且m/z285的碎片离子为267、225,因此可以确定13号峰是含有山奈酚的黄酮糖苷,相对分子质量为470。
14号峰,m/z为517,即[M-H]-为517,在MS2中,产生m/z301的碎片离子,即[MH-216]-,失去一个中性碎片,且m/z301的碎片离子为179、151,因此可以确定14号峰是含有槲皮素的黄酮糖苷,相对分子质量为518。
树莓叶乙醇提取物中黄酮类化合物结构的推断列于表2。
3 结论
通过对树莓叶乙醇提取物 HPLC-PDAMSn分析,检测出15种黄酮化合物,主要是槲皮素和山奈酚衍生化的黄酮醇类化合物,这与文献中的报道一致。通过对这15种黄酮化合物的一级和多级质谱碎片信息的分析,对其基本结构组成进行初步的推断。但对于糖基具体的空间结构的鉴定还需要通过对目标化合物进行高度纯化后,结合核磁等手段进行准确的结构判断。该方法简单、原料前处理便捷、同时具有灵敏度高等特点,可实现黄酮类化合物快速的初步定性研究,对于天然产物复杂体系中活性成分的初步定性研究也具有重要的意义。
[1]韩 加,刘继文.树莓营养保健功效及开发前景[J].中国食物与营养,2008,8:54-56.
[2]张 敏.湘西山莓叶有效成分提取分离结构鉴定及活性研究[D].长沙:湖南大学,2006.
[3]VENSKUTONIS P R,DVARANAUSKAITE A,LABOKAS J.Radical scavenging activity and composition of raspberry (Rubusidaeus)leaves from different locations in Lithuania[J].Fitoterapia,2007,78:162-165.
[4]LEE M W,LEE Y A,PARK H M,et al.Antioxidative phenolic compounds from the roots ofRhodiolasachalinensisA.Bor[J].Archives of Pharmacal Research,2000,23(5):455-458.
[5]刘明生,王利华,赵 力,等.悬钩子属植物成分研究 现 状 [J]. 时 珍 国 医 药,1999,10(11):867-868.
[6]黄可新,王明奎.川莓的化学成分[J].应用与环境生物学报,2000,6(2):194-196.
[7]甘 露,王 宾,梁 鸿,等.粗叶悬钩子化学成分的分离鉴定[J].北京医科大学学报,2000,32(3):226-228.
[8]郭启雷,杨峻山.掌叶覆盆子的化学成分研究[J].中国中药杂志,2005,30(2):198-200.
[9]王艳萍,薛兴亚,张秀莉,等.HPLC/ESI-MS法鉴定半枝莲乙酸乙酯组分中黄酮苷元类化合物[J].质谱学报,2009,30(3):129-138.
[10]GENG P,SUN J H,ZHANG R P,et al.An investigation of the fragmentation differences of isomeric flavonol-O-glycosides under different collision-induced dissociation based mass spectrometry[J].Rapid Communications in Mass Spectrometry,2009,23(10):1 519-1 524.
[11]鲁 林,石 莹,宋凤瑞,等.山奈甲黄素-3,7-二-O-多取代糖苷的串联质谱研究[J].化学学报,2010,68(17):1 735-1 740.
[12]袁 帅,姚胜军,耿 昱,等.HPLC-ESI-MS/MS识别蓝莓提取物中的花青素和黄酮醇[J].化学学报,2009,67(4):318-322.
[13]COLOMBO R,YARIWAKE J H,QUEIROZ E F,et al.On-line identification of sugarcane (SaccharumofficinarumL.)methoxyflavones by liquid chromatography-UV detection using post-column derivatization and liquid chromatographymass spectrometry[J].Journal of Chromatography A,2005,1 082(1):51-59.
[14]肖贻崧,张廷志,侯镜德.苦竹叶中黄酮类化合物的液相色谱-质谱联用分析[J].宁波高等专科学校学报,2001,13:124-125.
[15]RYAN J J,COFFIN D E.Flavonol glucuronides from red raspberry,Rubusidaeus(rosaceae)[J].Phytochemistry,1971,10(7):1 675-1 677.
[16]HAKKINEN S,AURIOLAC S.High-performance liquid chromatography with electrospray ionization mass spectrometry and diode array ultraviolet detection in the identification of flavonol aglycones and glycosides in berries[J].Journal of Chromatography A,1998,829:91-100.
[17]郭启雷,杨峻山,刘建勋.掌叶覆盆子的化学成分研究[J].中国药学杂志,2007,42(15):1 141-1 143.
[18]WANG B G,ZHONG J J.Triterpenes and triterpenoid glycosyl ester fromRubuspungensCamb.var.Old hamii[J].Phytochemistry,1998,49(1):185-188.
[19]GUDEJ J,RYCHLINSKA I.Flavonid compounds from the leaves of R.ideausL.[J].Herba Polonica,1996,42(4):257-261.
[20]LEE M W.Phenolic compounds from the leaves of R.coreanum.[J].Yakhak Hoechi,1995,39(2):200-204.
Separation and Identification of Flavonids of Leaves of Rubus idaeus by High Performance Liquid Chromatography Electrospray Ionization Multi-Stage Tandem Mass Spectrometry
YE Xiao-ke,QIN Pei,LI Wei,GUO Lu,TANG Wei-wei,WANG Shuo
(Key Laboratory of Food Nutrition and Safety,Ministry of Education,Tianjin University of Science and Technology,Tianjin300457)
To analysis and determinate the construction of flavonids in the leaves of raspberry as a new flavonids resource,the utility of high performance liquid chromatograph in combined with photodiode array detection and mass spectrometer technology (HPLC-PDAMSn)was successfully applied to simultaneous separate and determinate 15flavonoides in ethanol extracts of leaves ofRubusidaeus.It was analyzed that constructions of flavonoid aglycones,the types of glycogen,sequences of polysaccharide using the information of molecular weight and ion fragmentations of MSnprovided by ion trap.In addition to liquid chromatography retention time,standard materials and published reports,the possible construction of 15flavonoids in ethanol extracts was inferred.The result shows that it contains 8quercetin derivatives and 7kaempferol derivatives,which was corresponded with the pub-lished reports.
leaves ofRubusidaeus;flavonoids;separation and determination;HPLC-MSn;ion trap
O 657.63
A
1004-2997(2011)05-0271-07
2011-01-15;
2011-06-14
叶晓珂(1986~),女(汉族),河南漯河人,硕士研究生,食品科学专业。E-mail:yexiaoke1986@sina.com
王 硕(1969~),男(汉族),天津人,博士生导师,从事食品营养与安全研究。E-mail:s.wang@tust.edu.cn

