P311蛋白与金属硫蛋白ⅡA相互作用位点的计算机预测
薛晓怡, 冯铁男, 王群群, 王翼飞
(上海大学理学院,上海200444)
P311是一种具有重要生物学作用的细胞因子,它参与体内细胞分化、调节其他蛋白/基因转录、创伤修复、肿瘤发生等多种正常或异常的生物学活动[1-2].已有的研究结果显示,P311在抗纤维化、瘢痕形成、促进神经细胞再生以及组织损伤修复等方面有着非常重要的作用[3-4].
金属硫蛋白(metallothionein,MT)是一类低分子量、富含半胱氨酸、无芳香族氨基酸、能与金属结合且普遍存在于生物界的非常独特的蛋白质[5].哺乳动物组织中通常含有4个较大的MT组分:MT-1,MT-2,MT-3和MT-4.这些组分又可分为10个有生物学功能的亚型和7个无生物学功能的亚型[6],其中MT2A是MT-2组分中唯一具有生物学功能的蛋白质[7].研究表明,MT2A不仅具有重金属解毒、清除自由基、抗辐射、修复组织损伤、抗衰老以及调节微量元素平衡等重要作用,还与细胞的增殖、凋亡,多种肿瘤的发生、发展及肿瘤耐药性密切相关[8-10].
Miura等[11]的研究发现,MT2A参与P311基因的表达,其主要表现在缺乏MT2A的转基因小鼠中存在P311表达的缺失,这说明MT2A在P311的表达中可能起着关键性的调节作用,表明二者存在相互作用的关系.本研究采用同源建模的方法构建P311蛋白的3D结构,通过计算机模拟蛋白质间的相互作用,预测二者间的作用区域及作用位点,找出关键残基,为进一步的实验研究奠定了一定的基础.
1 材料与方法
本研究的P311蛋白序列(编号为NP_001135955)由NCBI(http://www.ncbi.nlm.nih.gov)中获取.在Brookheaven Protein Databank(PDB)数据库中,人体MT2A没有完整的单体,只有被蛋白酶降解后单一的α或β结构域.本研究选取人体MT2A的α结构域作为研究对象(PDB代码为1MHU),使用的软件包主要有SYBYL 8.0,Autodock 4.0和Chimera.
1.1 P311蛋白3D结构模建
1.1.1 同源建模步骤
P311蛋白3D模建、能量优化和计算均采用SYBYL 8.0软件包完成,除特别说明之外,计算中选用的参数均为默认值.
输入需要模建的P311蛋白序列,在SYBYL 8.0的HOMSTRAD数据库中寻找同源蛋白,选取P311蛋白可同源建模的最优模板;同源蛋白结构叠合以确定SCR区和Loop区;通过序列对比确定参考蛋白与目标蛋白之间的序列保守区;复制序列保守区中参考蛋白的坐标给目标序列;确定目标序列中其他区域的结构,包括C端和N端的结构以及Loop区或柔性区域的结构;确定目标蛋白残基侧链的坐标;利用分子动力学对搭建的模型进行侧链位置的修正优化;评估模建蛋白在结构和折叠模式上是否合理[12].
1.1.2 能量优化
使用SYBYL 8.0中的Biopolymer模块对得到的模建蛋白加全氢,加Kollman_all电荷,采用Tripos力场,电解质常数为1.0.能量优化采用逐步放开的策略,先对蛋白的氢原子进行能量优化,进而优化侧链、主链直至全部放开优化.优化过程采用Ramachandran图和ProTable检验蛋白质的结构合理性,得到最终的3D结构模型.
1.2 P311与MT2A分子对接
从PDB数据库直接获取的结构存在一定的不合理碰撞和张力,因此,配体分子MT2A用于研究前,要先在SYBYL 8.0中进行简单的分子力学能量优化.在Tripos力场下,以Gasteiger方法计算电荷,进行能量优化,迭代次数为1 000次,收敛梯度为4.186 8 kJ/(mol·nm).
在实施计算机对接前,首先,对配体与受体进行坐标规范化,使二者处于相同的坐标系下.随后,利用Autodock 4.0将P311结构模型与经过预处理的配体分子MT2A进行分子对接:① 先生成参数文件,根据SiteID找到可能的活性位点为口袋,口袋周围选取几个残基;②以这些残基的中心为格点盒子的中心,产生一个格点间距为0.037 5 nm,x,y,z 3个方向分别为80×96×78格点的盒子;③ 使用Autogrid 4.0产生grid文件,该文件中包括探针原子在各个网格点与受体的相互作用能;④ Autodock 4.0运用Lamarchian遗传算法,将局部能量搜索与遗传算法相结合,以半经验函数作为能量打分函数,对MT2A构象和位置进行全局搜索,对MT2A与模建结构进行独立的10次对接实验,选取结合能最低的构象作为最佳对接构象.最后,将所选结果生成的分子从输出文件中提取,并与受体文件合并,形成一个复合物的结构.
P311蛋白同源建模以及与MT2A分子对接的流程如图1所示,具体步骤如下:①从PDB数据库下载配体MT2A的3D结构,PDB代码为1MHU,从基因数据库NCBI中获取P311蛋白序列,在SYBYL 8.0中进行同源建模,能量优化,最终得到P311蛋白的结构模型;② 将受体P311蛋白与配体MT2A导入Autodock 4.0中进行分子对接;③从10个对接构象中,选取结合能最低的构象为最佳对接构象;④从Autodock 4.0的输出文件中提取最佳对接构象与受体P311蛋白的PDB文件合并,形成复合物构象;⑤分析受体P311蛋白与配体MT2A的复合物结构,找出关键残基.

图1 P311蛋白同源建模以及与MT2A分子对接流程图Fig.1 Flow chart of P311 protein’s homology modeling and docking with MT2A
2 结果与讨论
2.1 序列联配及同源建模结果
从NCBI数据库中获取人的P311蛋白序列,其中包含68个氨基酸残基.在SYBYL 8.0的HOMSTRAD数据库中寻找同源蛋白,得到10个候选模板,前3位的模板为 hs1i5kd,hs2dohc和 hs2i32e,三者与P311蛋白序列的比对如图2所示.得分最高的模板hs1i5kd为A族链球菌表面蛋白M蛋白,PDB数据库中1I5K的 D链与P311蛋白序列的同源性为30.8%,满足了进行同源建模最低同源性25%~30%的要求.因此,本研究选取得分最高、同源性较好的模板hs1i5kd作为P311蛋白同源建模的最优模板,最后得到的3D结构模型如图3所示.

图2 P311蛋白与hs1i5kd,hs2dohc和hs2i32e的序列比对Fig.2 Comparison of sequence alignments between P311 protein and hs1i5kd,hs2dohc and hs2i32e
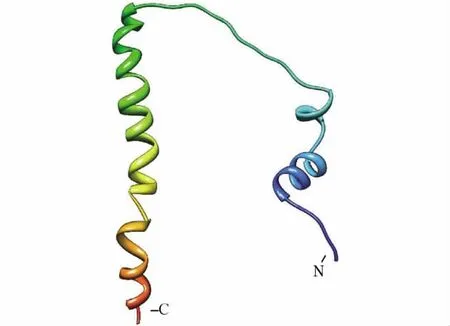
图3 P311蛋白3D结构Fig.3 P311 protein 3D structure
同时,在SYBYL 8.0中对P311蛋白进行二级结构预测(见图4).结果表明,P311蛋白是由多个α螺旋和少数β折叠构成,与模建结构(见图3)基本相符,增加了模建结构的可信度.

图4 P311蛋白二级结构预测Fig.4 Prediction of P311 protein’s secondary structure
采用 ProTable分析蛋白结构产生的Ramachandran图(见图5).可以看出,模建结构蛋白的主链结构基本合理,主链二面角φ和ψ落于中心区域和“可接受区域”的残基占91.2%,绝大多数的φ和ψ角均在正常范围内,没有落在不允许区域内的残基.

图5 P311蛋白模建结构Ramachandran图Fig.5 Ramachandran plot of the modeled structure of P311 protein
利用Biopolymer/SiteID分析P311蛋白的活性位点,发现在模建结构中有2个空腔(见图6),其溶剂化氛围、空腔体积以及作为可能的活性位点的氨基酸残基如表1所示.这些残基为进行分子对接时选取适当的残基作为活性口袋提供了有利参考.
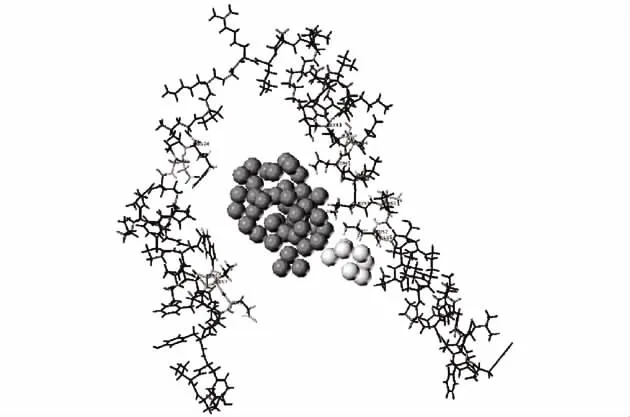
图6 SiteID发现的P311活性位点Fig.6 Active site of P311 protein discovered by SiteID

表1 P311蛋白的2个空腔中可能的活性位点Table 1 Two cavities discovered on the modeled structure of P311 protein
2.2 P311蛋白与配体MT2A的对接
采用Autodock 4.0评价模建的合理性,并预测P311蛋白与配体MT2A(见图7)的对接情况.该软件能够自动将底物对接到受体的活性中心或结合部位,并利用遗传算法寻找合适的结合构象,使得配体与受体的形状和相互作用的匹配效果达到最佳稳定状态,形成合理的复合物结构.
经Autodock 4.0分子对接后得到了10个对接构象,其结合能排序结果如表2所示.从最低结合能考虑,选取表格中第一个配体(编号为6)作为最优可能对接形式.将该配体中生成的配体分子从输出文件中提取并与受体文件合并,形成了一个复合物结构.利用SYBYL 8.0软件生成的复合物结构模型如图8所示,氢键连接如图9所示.图8中的深色部分为计算机预测出的二者相互作用区域,浅色部分为附近的相关区域.图9中的配体MT2A以球棍型表示,受体P311蛋白以棍型表示,黑色代表与配体相互作用的残基,浅灰色代表附近的相关残基,深灰色表示较远残基.

图7 配体MT2A 3D结构Fig.7 MT2A 3D structure

表2 10个对接构象的结合能Table 2 Binding energy of the ten conformations

图8 P311蛋白表面化后的复合物结构Fig.8 Complex structure after surfacing P311 protein

图9 P311蛋白与MT2A氢键作用示意图Fig.9 Hydrogen bond interactions between P311 protein and MT2A
从图8可以看出,配体MT2A嵌于受体P311蛋白的活性口袋中,形成了稳定的复合物结构.从图9 (a)中看到,配体残基 LYS31的末端与受体残基GLU14和TRP10相互吸引,LYS31残基与GLU14残基有氢键连接,形成了稳定结构.在图9(b)中,配体残基ALA61伸入到受体SER48,PRO51及LEU52所形成的活性口袋中,并与上述三者的分子表面形成几何互补,其中残基ALA61与SER48之间有氢键作用,形成了稳定结构.在图9(c)中,配体残基LYS43与受体残基GLU56相互靠近,也形成了稳定的氢键结构,这些氢键对促进和稳定底物MT2A结合到P311蛋白的活性中心起到了重要的作用.
通过上述表象,受体残基GLU14,SER48以及GLU56成为重要功能残基的可能性很高,该可能性有待实验的进一步验证.
3 结束语
P311蛋白具有多种生物学功能,除了促神经再生、创伤修复、肿瘤浸润等方面外,在其他的一些疾病中依然见有表达并可能参与其中.设计与P311特异性结合的小分子药物,或者通过影响P311的某些关键残基的活性来抑制或促进它的生物学功能,将成为研究的焦点.
本研究采用同源建模的方法模建了P311蛋白的3D结构,使用ProTable分析和Ramachandran图验证其合理性.结果表明,大部分氨基酸的φ和ψ角分布在合理的区域.通过预测P311蛋白的二级结构可知,P311蛋白由多个α螺旋构成,与模建结构基本相符.经配体MT2A与受体P311蛋白的模建结构分子对接后,发现受体残基GLU14,SER48以及GLU56可能是重要的功能残基.这些研究结果为进一步了解P311蛋白的作用域、反应机制以及功能等提供了新的视角和重要信息,使生物学实验研究更有目的性、方向性及针对性,大大降低了研究成本,为发现药靶及研制新的药物提供了强有力的工具.
[1] TAYLORG A,HUDSONE,RESAUJ H,et al.Regulation of P311 expression by Met-hepatocyte growth factor/scatter factor and the ubiquitin/proteasome system[J].Biol Chem,2000,275(6):4215-4219.
[2] MARIANIL,MCDONOUGHW S,HOELZINGERD B,et al.Identification and validation of P311 as a glioblastoma invasion gene using laser capture microdissection[J].Cancer Res,2001,61(15):4190-4196.
[3] FUJITANIM,YAMAGISHIS,CHEY H,et al.P311 accelerates nerve regeneration of the axotomized facial nerve[J].Neurochem,2004,91(3):737-744.
[4] PALIWALS,SHIJ,DHRUU,et al.P311 binds to the latency associated protein and downregulates the expression of TGF-beta1 and TGF-beta2[J].Biochem Biophys Res Commun,2004,315(4):1104-1109.
[5] GUOX,CHANH M,GUEVREMONTR,et al.Analysis of metallothioneins by means of capillary electrophoresis coupled to electrospray mass spectrometry with sheathless interfacing[J].Rapid Commun Mass Spectrom,1999,13(6):500-507.
[6] MIDIDODDIS,MCGUIRTJ P,SENSM A,et al.Isoformspecific expression of metallothionein mRNA in the developing and adult human kidney[J].Toxicol Lett,1996,85(1):17-27.
[7] COYLEP,PHILCOXJC,CAREYLC,etal.Metallothionein:the multipurpose protein[J].Cell Mol Life Sci,2002,59(4):627-647.
[8] PALMITERR D.The elusive functions of metallothioneins[J].Proc Natl Acad Sci USA,1998,95:8230-8248.
[9] CHERIAN M G, JAYASURYA A, BAY B H.Metallothioneins in human tumors and potential roles in carcinogenesis[J].Mutat Res,2003,533(1/2):201-209.
[10] 周敏,杨芳,贺智敏,等.人金属硫蛋白MT-2a的原核表达、纯化及其抗血清的制备[J].细胞与分子免疫学杂志,2006,22(4):530-532.
[11] MIURAN,NAGANUMAA.Metallothionein mediates gene expression of 3.1 mRNA(PTZ17)related to epileptic seizure[J].FEBS Lett,2000,479:146-148.
[12] 刘小利,王陆瑶,胡文祥.μ阿片受体的三维结构预测及活性位点分析[J].化学通报,2009,72(2):133-137.

