聚乙二醇修饰多壁碳纳米管对质粒DNA的影响
劳文艳, 商迎辉, 焦 正, 劳凤学
(1.北京联合大学北苑校区,北京100012;2.上海大学环境与化学工程学院,上海200444)
随着纳米技术的发展,碳纳米管(carbon nanotubes,CNTs)的用途越来越广[1-6],与科研人员和普通大众的接触也越来越多.因此,在CNTs基材料广泛应用之前,深入彻底地研究其健康与安全问题非常有必要.CNTs或含CNTs复合材料的生物相容性研究已经成为CNTs研究领域的一个新热点.Webster等[7]研究了一系列复合材料 polyurethane (PU)/CNTs和星状细胞的关系,并发现随着CNTs含量的提高,材料中的星状细胞量减少,并且阻碍了星状细胞的增殖.Hu等[8]和Gabay等[9]的研究结果显示,经聚乙烯亚胺化学修饰后的CNTs对神经细胞生长有促进作用.Supronowicz等[10]发现,导电复合材料polylactic acid(PLA)/MWNTs通过交流电击能够明显提高造骨细胞的增殖速度.
DNA是生物体中一类最基本的大分子,是遗传信息的原初载体,是细胞生长、发育、繁殖和遗传的重要物质基础.研究由纳米材料所导致的DNA结构和功能的变化,有利于从微观角度理解纳米材料的生物相容性本质,从而为探讨和解决宏观领域中的实际问题提供依据.本研究通过电泳实验和原子力显微镜观测,分析多壁碳纳米管(MWNTs)和PEG修饰MWNTs与质粒DNA的作用情况,并从二者对质粒DNA损伤的角度考察了MWNTs的生物相容性.
1 实验
本实验中使用的MWNTs直径为10~30 nm,长度为5~50 μm,购自深圳市纳米港公司.本实验采用混酸氧化法纯化MWNTs,用V(浓硝酸)∶V(浓硫酸)=1∶3的混合酸超声处理MWNTs,通过离心分离和真空干燥,得到的黑色固体为纯化MWNTs.PEG修饰MWNTs的合成方法为如下:取干燥的50 mg纯化MWNTs,加入15 mL pH=7.0的磷酸盐缓冲液中,超声分散均匀,加入 200 mg的碳二亚胺与250 mg N-羟基琥珀酰亚胺,超声30 min,再加入500 mg PEG-1500,置于磁力搅拌器上室温搅拌24 h,反应后的溶液用水洗涤,12 000 r/min离心分离30 min,得到的固体用去离子水洗涤后再用0.22 μm的纤维素微孔滤膜真空过滤,得到PEG修饰MWNTs.原始MWNTs、纯化MWNTs和PEG修饰MWNTs的透射电子显微镜(transmission electron microscope,TEM)照片如图1所示.
本实验中所使用的其他试剂均为分析纯.实验采用碱法抽提质粒DNA,所用质粒为pGBKT7,大小约为7.3 kb.MWNTs经超声振荡后与DNA混合形成混合溶液,然后进行凝胶电泳实验.取9 μL样品加入1 μL的loading buffer(染色剂)混合均匀,按照由高到低的浓度顺序,用移液枪依次在每个孔中注入样品、质粒和loading buffer的混合物,最后加入水、质粒和loading buffer的混合物作为对照.电泳实验电压设定为120 V,时间设定为50 min.
使用天能凝胶成像系统对电泳结果进行凝胶成像,应用凝胶成像系统的分析软件对凝胶中不同形态DNA的光密度进行定量分析,从而得到不同质量浓度下MWNTs对质粒DNA的损伤情况.
使用岛津公司的SPM-9600AFM观察MWNTs对DNA的作用.对质粒DNA进行成像时,AFM采用如下的制样方法.在室温下,将250 μg/mL的原始WMNTs、纯化WMNTs和PEG修饰MWNTs与DNA溶液混合(质粒DNA终质量浓度控制在250 ng/mL左右),涡旋震荡器上恒温(25℃)轻轻震荡24 h.用移液枪吸取5 mL的MWNTs与质粒DNA的混合液,缓缓滴于3-氨基丙基三乙氧基硅烷-云母衬底上,随后用干净平整的封口膜轻轻覆盖在液滴上,并使溶液均匀地平铺在衬底上.将衬底静置几分钟后揭去封口膜,吸取少量的去离子重蒸水冲洗衬底面,重复冲洗若干次以便去除未吸附的质粒.最后,将冲洗后的衬底置于阴凉干燥处,使残留在衬底上的水分自然风干,样品制备完毕.由于是测试生物样品,扫描速率要尽量放慢在0.5 Hz左右,振源幅度要尽量调低,设置点调高,确保在成像时,AFM的针尖以较小的力拍击样品表面,从而不会对样品产生破坏.
2 结果与讨论
2.1 电泳实验结果与讨论

图1 MWNTs的TEM图Fig.1 TEM images of MWNTs
本实验选择体外评价方法(plasmid DNA assay)对MWNTs以及PEG修饰MWNTs的生物活性进行研究.在纳米材料对DNA的损伤过程中,最初的损伤表现为超螺旋DNA松弛(relaxed),进一步的损伤表现为DNA的线化(linearized).正常的质粒DNA在琼脂糖凝胶中的电泳速度比松弛和线化的DNA快,故在智能凝胶成像系统所生成的图像中能够得到3条明显分开的条带(见图2).通过对图2进行分析,可以定量检测不同的纳米材料对质粒DNA超螺旋部分的损伤程度[11],并由此对纳米材料的生物相容性作出相应的评价.

图2 不同质量浓度的MWNTs对质粒DNA损伤的凝胶成像结果(μg/mL)Fig.2 Gel images of plasmid DNA damage by various concentration of MWNTs(μg/mL)
图3为不同质量浓度的CNTs对质粒DNA损伤情况的定量分析结果.可以看出,当原始单壁碳纳米管 (single-walled CNTs,SWCNTs)质量浓度为125 μg/mL时便开始损伤质粒DNA,并且随着质量浓度的增加,损伤程度也逐渐增加;当质量浓度达到2 000 μg/mL时,对质粒DNA的损伤已非常明显,可达48.6%.纯化MWNTs对质粒DNA的损伤较原始SWCNTs稍有减弱,低质量浓度范围内的纯化MWNTs对质粒DNA超螺旋部分的损伤百分比处于一个较低的水平;但当质量浓度达到2 000 μg/mL时,纯化MWNTs对质粒DNA超螺旋部分的损伤也达到了21.1%,表明原始SWCNTs和纯化MWNTs在达到一定质量浓度时,对质粒DNA都有较为明显的损伤.而PEG修饰MWNTs对质粒DNA的损伤明显减弱,其损伤百分比一直处于一个非常低的水平;当质量浓度达到2 000 μg/mL时,PEG修饰MWNTs对质粒DNA超螺旋部分的损伤也只有13.6%.
2.2 AFM实验结果与讨论
AFM在生物结构的研究中具有如下独特的优势:①可在纳米水平上分辨生物大分子的结构信息;②具有直观的三维表面信息;③样品制备相对简单,无需进行染色、包埋等复杂处理过程;④可深入了解单个生物分子的三维结构变化.越来越多的研究者利用AFM来研究DNA的结构变化.Pang等[12]利用AFM研究了电子辐射导致水溶液中DNA断裂的情况.Zhu等利用AFM观测了Zn2+导致DNA扭曲的现象.本实验利用 AFM分别观测了纯pGBKT7质粒结构以及原始MWNTs、纯化MWNTs和PEG修饰MWNTs对质粒DNA结构的影响,结果如图4~图7所示.

图3 不同质量浓度的CNTs溶液中质粒DNA超螺旋部分的损伤情况Fig.3 Percentage of supercoiled DNA damage in CNTs solution at different mass concentration
图4为纯pGBKT7质粒DNA的AFM图像,可以清晰地看到,其完整的环状结构均匀地分布在云母片上,每个环状质粒的外径约为85 nm,高度约为2 nm.

图4 pGBKT7质粒DNA的AFM图像Fig.4 AFM images of pGBKT7 plasmid DNA
图5为质粒DNA与原始MWNTs混合培养后的AFM图像.可以看出,未经纯化的原始MWNTs对质粒DNA的损伤非常严重,绝大多数质粒DNA失去了其完整的环状结构,即共价闭合环状质粒DNA发生链断裂变成了开环的质粒(open circular DNA,ocDNA),还有一些质粒DNA发生了更为严重的断裂现象,即断裂成小段并形成线化 DNA(linear DNA,lDNA).

图5 pGBKT7质粒DNA与原始MWNTs混合培养后的AFM图像Fig.5 AFM images of pGBKT7 plasmid DNA after incubated with pristine MWNTs
图6为质粒DNA与纯化MWNTs混合培养后的AFM图像.可以看出,大部分质粒DNA保持了原有的完整环状结构,在与原始MWNTs共同培养过程中出现的共价闭合环断裂现象已经得到了明显的改善,线化的质粒DNA较少,但质粒DNA出现了扭曲现象,DNA间的纠结、缠绕现象也较为严重.由图6可以明显地看到,质粒DNA在云母片上的分布不均匀,大量的质粒DNA团聚成一簇.
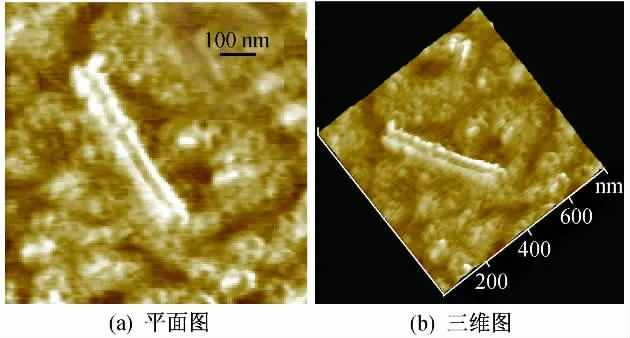
图6 pGBKT7质粒DNA与纯化MWNTs混合培养后的AFM图像Fig.6 AFM images of pGBKT7 plasmid DNA after incubated with purified MWNTs
图7为质粒DNA与PEG修饰MWNTs混合培养后的AFM图像.可以明显地看出,大部分的质粒DNA完整地保存了其环状结构,基本上未出现开环、线化和团聚的现象,绝大多数环状质粒DNA均匀地分布在云母片上.AFM图像中出现的管状结构为PEG修饰MWNTs,点状结构为质粒DNA,它们均匀地分布在云母片上,结构非常完整.

图7 pGBKT7质粒DNA与PEG修饰MWNTs混合培养后的AFM图像Fig.7 AFM images of pGBKT7 plasmid DNA after incubated with PEG-MWNTs
通过AFM的剖面分析观测,可以发现与各种MWNTs混合培养之后,质粒DNA的外径都有不同程度的收缩,纯的质粒DNA的直径为80~90 nm,平均直径约为85 nm.纯化MWNTs与质粒DNA共同培养后,质粒DNA的收缩情况比较明显,平均直径收缩至50 nm左右.PEG修饰MWNTs与质粒DNA共同培养后,质粒DNA的收缩情况不明显,平均直径在75 nm左右.利用AFM中的长度分析软件,对每种外径的缩小情况统计40个质粒DNA,结果如表1所示.

表1 pGBKT7质粒DNA与纯化后的MWNTs,PEG修饰WMNTs混合培养后外径测量Table 1 Outer mean diameters for ringlike plasmid DNA incubated with purified-MWNTs and PEG-MWNTs measured by AFM
AFM观测得到的结果与电泳实验所得到的结论非常吻合.未经纯化处理的原始MWNTs对质粒DNA的损伤较为严重,原因可能是原始MWNTs中含有的包括铁、钴、镍等金属颗粒杂质对质粒DNA产生了损伤.经过纯化的MWNTs,由于金属催化剂和大部分的杂质颗粒被除去,因而对质粒DNA的损伤有所减弱,不会造成质粒DNA的断裂,但质粒DNA发生了收缩和扭曲现象.经过 PEG修饰的MWNTs,由于其表面包裹了一层溶解性良好的高分子材料,体现出较好的生物相容性.其对质粒DNA的损伤非常小,不会造成质粒DNA的断裂和扭曲,基本完好地保持了原有的形态.
3 结束语
Plasmid DNA assay的研究结果表明,就对质粒DNA的损伤程度而言,原始MWNTs>纯化MWNTs>PEG修饰MWNTs.PEG修饰MWNTs具有较好的生物相容性,当质量浓度达到2 000 μg/mL时,PEG修饰MWNTs对质粒DNA超螺旋部分的损伤也只有13.6%;而在相同质量浓度下,原始MWNTs和纯化MWNTs对质粒 DNA超螺旋部分的损伤分别为48.6%和21.1%.
AFM观察的结果和plasmid DNA assay的结果非常吻合.原始MWNTs能够造成大量的质粒DNA分解、断裂成线状.纯化MWNTs对质粒DNA的形貌损伤有所减弱,大部分质粒DNA保持了原有的环状结构,但质粒DNA的收缩、团聚和缠绕现象非常明显.PEG修饰MWNTs对质粒DNA形貌的影响最弱,绝大多数质粒DNA完好地保持了原有的环状结构,质粒的收缩现象不明显.
[1] KROTOH W,HEATHJ R,O’BRIENS C,et al.C60:buckminsterfullerene[J].Nature,1985,318:162-163.
[2] IIJIMAS.Helical microtubules of graphitic carbon[J].Nature,1991,354:56-58.
[3] SALVETATJ P,BONARDJ M,KULIKA J,et al.Mechanical properties of carbon nanotube[J].Appl Phys A Mater,1999,69(3):255-260.
[4] TERSOFFJ,RUOFFR S.Structural properties of a carbon-nanotube crystal[J].Phys Rev Lett,1994,73 (5):676-679.
[5] DALTONA B,COLLINSS,MUNOZE,et al.Supertough carbon-nanotube fibres—these extraordinary composite fibres can be woven into electronic textiles[J].Nature,2003,423:703-705.
[6] SENR,ZHAOB,PEREAD,et al.Preparation of singlewall carbon nanotube reinforced polystyrene and polyurethane nanofibers and membranes by electrospinning[J].Nano Lett,2004,4:459-464.
[7] WEBSTERJ J,WAIDM C,MCKENZIEJ L,et al.Nanobiotechnology: carbon nano-fibers as improved neural and orthopedic implants[J].Nanotech,2004,15:48-54.
[8] HUH,NIY,MONTANAV,etal.Chemically functionalized carbon nanotubes as substrates for neuronal growth[J].Nano Lett,2004,4(3):507-511.
[9] GABAYT,JAKOBSE,BEN-JACOBEY,etal.Engineered selforganisation of neural networks using carbon nanotube clusters[J].Physica,2005,350:611-621.
[10] SUPRONOWIZP R,AJAYANP M,ULLMANK R,et al.Novel-current conducting composite substrates for exposing osetoblasts to alternating current stimulation[J].J Biomed Mater Res,2002,59:499-506.
[11] JIAG,WANGH,YANL,et al.Cytotoxicity of carbon nano materials: single-wall nanotube, multi-wall nanotube,and fullerene[J].Environ Sci&Technol,2005,39(5):1378-1383.
[12] PANGD,POPESCUG,RODGERSJ.Atomic force microscopy investigation of radiation-induced DNA double strand breaks[J].Scanning Microscopy,1996,10(4):1105-1110.

