非抗凝猪血提取血红素的工艺优化研究
赵金红,许金鹏,李朝品
(1.皖南医学院 人体寄生虫学教研室,安徽 芜湖 241002;2.安徽中医学院第一附属医院 检验科,安徽 合肥230031)
血红素又称铁卟啉,由原卟啉Ⅸ与一个铁离子络合而成,广泛存在于动物的血液、肌肉和某些植物组织中,是血红蛋白、肌红蛋白、细胞色素C、过氧化氢酶和过氧化物酶等的辅基。在血液中,血红素主要存在于红细胞内,一分子珠蛋白与四分子血红素以非共价键结合构成血红蛋白。血红素具有重要的生理功能和较高的应用价值,在医药、食品、化工、保健品、建筑及化妆品行业中有广泛应用。目前,从动物抗凝血液中提取血红素的工艺优化研究较多[1~5],利用非抗凝猪血(血凝块)提取血红素工艺尚未见报道。因非抗凝猪血的获取、保存、运输更为便利,故本研究以非抗凝猪血为原料,对血红素的提取及其优化工艺进行初步研究,现报道如下。
1 材料与方法
1.1 试剂与仪器 新鲜非抗凝猪血(芜湖城南屠宰场),丙酮、盐酸、氢氧化钠、无水乙醇等(国产分析纯),血红素标准品(Sigma公司,纯度≥98.0%);高速组织捣碎机(上海标本模型制造厂,DS-1),超声波细胞粉碎机(宁波新芝生物科技股份有限公司,JY96-Ⅱ),旋转蒸发仪(上海亚荣生化仪器厂,RE-2000),循环水式多用真空泵(郑州长城科工贸有限公司,SHB-Ⅲ),紫外分光光度计(苏州岛津,UV-2550)。
1.2 血红素的提取工艺 将1 kg新鲜非抗凝猪血,高速组织捣碎机匀浆5 min,加入等体积双蒸水,用超声波细胞粉碎机,以200W功率破碎10 min,再加入1%盐酸丙酮溶液(即V盐酸丙酮∶V溶血液﹦5∶1),混匀,用1 mol/L盐酸调pH值至2~3(此时血红素与珠蛋白结合最为疏松),搅拌抽提10 min,血红素与珠蛋白分离溶于盐酸丙酮溶液中,而珠蛋白变性沉淀,以4 000 r/min离心15 min,收集含血红素的盐酸丙酮上清,抽滤除去珠蛋白颗粒。滤液用旋转蒸发仪蒸馏回收丙酮,血红素析出,离心收集沉淀,将沉淀用0.1 mol/L NaOH溶液溶解(血红素溶于稀NaOH溶液),离心除去不溶性的珠蛋白杂质,收集上清液,再以1 mol/L盐酸调pH值5~6,血红素重新沉淀析出,离心,收集沉淀,分别用双蒸水和无水乙醇洗涤2次,干燥即得血红素,称重,并计算产率。
1.3 血红素样品的定性测定 紫外-可见吸收光谱法:将血红素标准品与提取的血红素样品105℃干燥至恒重,准确称量干燥好的血红素标准品和样品,用0.1 mol/L NaOH溶液溶解,制成浓度为200 mg/L的标准品和样品溶液的母液备用。再分别制成10.0 mg/L的稀溶液,用紫外分光光度计于300~700 nm波长范围内扫描。
1.4 血红素样品的含量和纯度测定
1.4.1 血红素标准曲线的绘制 以0.1 mol/L NaOH溶液为空白,用紫外分光光度计于最大吸收波长389 nm处测定不同浓度的血红素标准品溶液的吸光度。以血红素标准品溶液的浓度为横坐标,以吸光度为纵坐标,绘制标准曲线,计算回归方程。
1.4.2 血红素的精密度和回收率
1.4.2.1 精密度 量取血红素标准品母液,制成8.0 mg/L的标准品溶液,在389 nm处测定其吸光度,计算相对标准偏差(RSD)结果。
1.4.2.2 回收率 量取9份血红素样品母液2.0 ml,分为3组。每组分别加入血红素标准品母液1.0 ml、2.0 ml、3.0 ml,用0.1 mol/L NaOH溶液定容至100 ml,测定结果作为样品加入量和标准品加入量。此外,另分别移取血红素样品母液2.0 ml和血红素标准品母液1.0 ml、2.0 ml、3.0 ml,用0.1 mol/L NaOH溶液定容至100 ml,测定结果作为样品加入量和标准品加入量。在389 nm处分别测溶液的吸光度值,代入回归方程计算加样回收率。
1.4.3 血红素样品的含量和纯度测定 制浓度为8.0 mg/L的血红素样品溶液,以0.1 mol/L NaOH溶液为空白,在389 nm波长处测得吸光度,代入回归方程,计算出8.0 mg/L的血红素样品溶液中血红素含量,并利用纯度计算公式计算提取的血红素样品的纯度。
1.5 正交试验对血红素提取工艺的优化 血红素的提取受多种因素影响,根据预实验结果和文献报道影响血红素产率的因素,本研究选择非抗凝血的匀浆时间、匀浆后双蒸水加入量、加入的盐酸丙酮溶液与溶血液的体积比(V盐酸丙酮∶V溶血液)和搅拌抽提时间4个因素,每个因素3个水平(表1),运用L9(34)正交表,每次以0.5 kg非抗凝猪血为原料,进行正交试验,以血红素的产率(%)为指标,探讨非抗凝猪血提取血红素的最佳提取条件和参数。
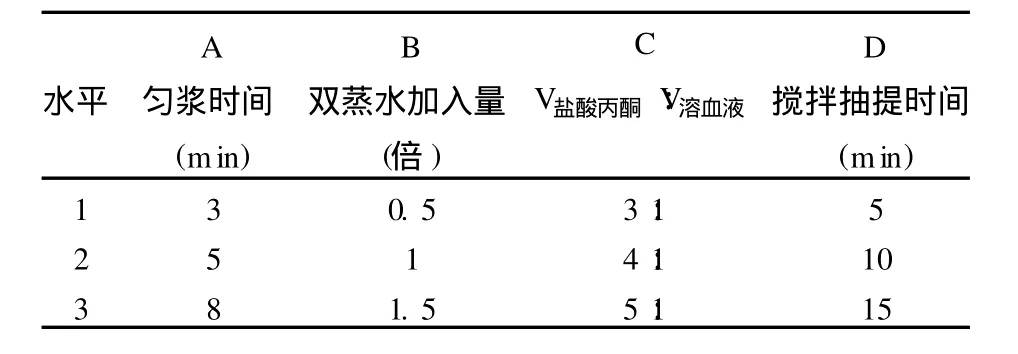
表1 血红素提取的正交试验因素-水平表Tab 1 Factors and levels of orthogonal experiment in heme extraction
2 结果
2.1 血红素样品的一般性质和产量 提取的血红素为黑紫色粉末状固体,易溶于稀NaOH溶液和酸性丙酮溶液,不溶于蒸馏水和无水乙醇,105℃不熔解。该法提取血红素的平均产量为10.6 g/kg非抗凝猪血,平均产率为1.06%。
2.2 血红素的定性结果 紫外-可见吸收光谱法结果显示,于300~700 nm波长范围内,血红素样品与标准品的的光谱图基本一致,在340 nm、389 nm、578 nm、603 nm波长处显示吸收峰,最大吸收峰在389 nm处(图1)。

图1 血红素标准品与样品的紫外-可见吸收光谱图Fig 1 Ultraviolet-visible absorption spectrum of heme samples and standard substance
2.3 血红素样品的含量和纯度 血红素标准曲线的回归方程为y=0.0891χ-0.0064(R2=0.9996),相关系数趋近于1。该回归方程可用于计算血红素样品中血红素的含量。平均吸光度值为0.699,RSD=0.72%(n=6),平均回收率为100.27%,RSD=0.73%(n=9),表明该法测定血红素精密度、回收率良好。
经计算,血红素样品溶液中血红素含量为7.12 mg/L,纯度为90.8%。
2.4 正交试验对非抗凝猪血提取血红素工艺优化的结果 通过对以上正交试验结果进行分析可以得出:极差(R)C>B>A>D(表2),表明V盐酸丙酮∶V溶血液对非抗凝血提取血红素产率影响最大,其后影响大小依次为:双蒸水加入量、匀浆时间、搅拌抽提时间。最佳工艺参数为:C3>B2>A2>D3,即盐酸丙酮溶液与溶血液的体积比(V盐酸丙酮∶V溶血液)为5∶1,匀浆后双蒸水加入量为加入等体积双蒸水,非抗凝血的匀浆时间为5 min,搅拌抽提15 min。
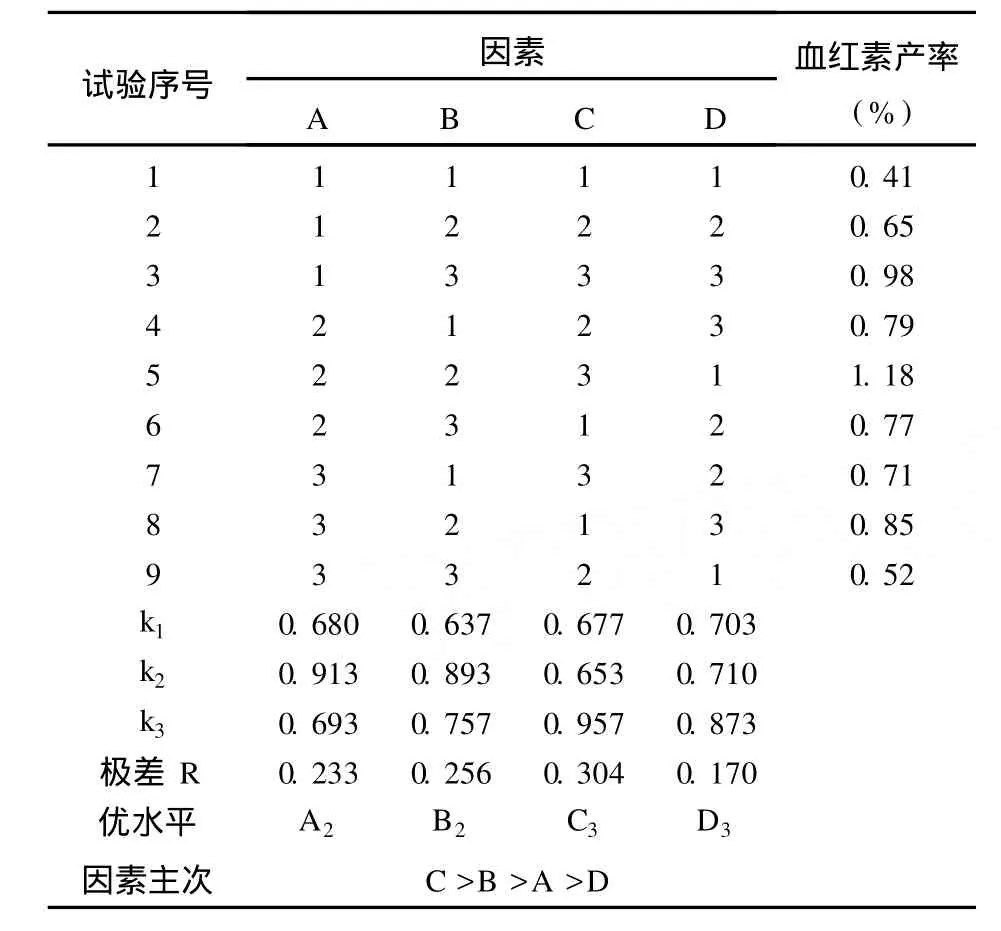
表2 非抗凝猪血提取血红素的L9(34)正交试验结果Tab 2 Results of L9(34)orthogonal experiment for heme extracted from non-anticoagulated blood
3 讨论
近年来,许多发达国家,如美国、日本、英国、德国等先后利用动物血液,生产食品添加剂、保健品及药品等。2000年2月,国家经贸委结合市场需求和技术现状,会同有关部门和单位,提出了要综合利用我国屠宰资源,利用动物血液、脏器等提取凝血酶、超氧化物歧化酶等动物生化药物。由于动物生化药物具有针对性强、毒副作用小、显效快、易于吸收和代谢等优点,因此利用动物血液等生物资源研制高活性生化药物已成为我国药物开发的重要组成部分[6]。我国动物血液资源十分丰富,估计每年在2.3×106吨以上,其中每年猪血总量约有150万吨,除极少量用于制作血豆腐或饲料外,大部分被废弃,造成资源浪费和环境污染[7]。如果能够综合开发利用猪血资源提取血红素,既可以减少环境污染,又可以增加猪血的经济效益和社会效益[8]。由抗凝血提取血红素的技术已渐趋成熟,而非抗凝血提取血红素的相关报道甚少[9]。
在红细胞内,四分子血红素与一分子珠蛋白以非共价键紧密结合,构成血红蛋白,并且血红蛋白在丙酮中易变性而空间结构发生变化,当pH值<3时,血红素中的铁与珠蛋白结合最为疏松。实验中将非抗凝猪血匀浆和超声波溶血,红细胞中的血红蛋白释出,通过加入丙酮并调pH值至3.0左右,此时血红素与珠蛋白分离溶于酸性丙酮溶液中,珠蛋白等变性沉淀,回收丙酮,血红素浓缩析出。本研究根据预试验的结果采用正交试验对非抗凝血提取血红素的工艺进行优化,选择非抗凝血的匀浆时间、匀浆后双蒸水加入量、加入的盐酸丙酮溶液与溶血液的体积比(V盐酸丙酮∶V溶血液)和搅拌抽提时间4个因素,分别研究了其对原卟啉产率的影响,确定了最佳提取工艺为:C3>B2>A2>D3,即非抗凝血的匀浆时间为5 min,匀浆后双蒸水加入量为加入等体积双蒸水,1%盐酸丙酮溶液加入量为溶血液体积的5倍,搅拌抽提时间为15 min。
本研究以非抗凝猪血为原料提取血红素,原料获取、保存、运输更为便利,制备过程中减少了中间产物,简化了操作步骤,制备周期大大缩短,且所用的丙酮又可经蒸馏回收而重复利用,既降低了制备成本,又减少了其对环境的污染;分离的珠蛋白等血液蛋白还可以进一步开发利用,如制作饲料或蛋白粉等。可见,以非抗凝猪血为原料制备血红素,综合开发利用了猪血资源,减少了环境污染,具有一定的应用价值和较好的市场前景。
[1]胡美琴,余蓉.用PEG6000从新鲜猪血中分离提取猪血红蛋白[J].华西药学杂志,2008,23(3):329-330.
[2]马永征,宋宏新,李敏康.氯化血红素提取中超声波细胞破碎条件的研究[J].陕西科技大学学报,2005,23(2):41-44.
[3]贺峰,史先振.鸭血中提取血红素的研究初报[J].农产品加工·学刊,2008,142(7):206-209.
[4]钟耀广.利用冰醋酸提取血红素的研究[J].食品科学,2004,25(4):90-95.
[5]瞿桂香,黄耀江,董明盛.血红素制备工艺研究进展[J].中央民族大学学报(自然科学版),2007,16(1):19-22.
[6]刁治民,杜军华,马寿福.动物血液的开发利用[J].青海科技,2000,9(3):7-10.
[7]冯咏梅,王文华,陈小平.猪血制品的研究与开发[J].食品研究与开发,2002,23(6):71-73.
[8]赵金红,许金鹏,李朝品.利用血红素制备原卟啉钠的工艺优化研究[J].皖南医学院学报,2011,30(1):11-13,30.
[9]许金鹏,李朝品.利用动物血液制备的原卟啉钠研究进展[J].动物医学进展,2009,30(10):78-81.
- 皖南医学院学报的其它文章
- 综合性实验在《护理实验学》教学中的应用

