L-精氨酸、氨基胍和胍丁胺在大鼠局灶性脑缺血再灌注损伤中的作用*
王露茜, 贾 静, 郭明发, 张 耀, 张翔宇, 郭军军, 耿若君, 李 炳, 钟 华, 李东亮△
(1新乡医学院生理学与神经生物学教研室,河南新乡453003;2上海交通大学医学院,上海200025;)
一氧化氮(nitric oxide,NO)在缺血性脑损伤中具有损伤及保护双重作用,与组织损伤的发展进程和产生一氧化氮合酶(nitric oxide synthase,NOS)的类型密切相关。在脑组织中,L-精氨酸(L-arginine,L-Arg)作为底物在NOS的作用下生成NO。将NO前体和NOS抑制剂应用于脑缺血的研究已有报道,但作用结果尚有争议[1]。L-Arg在精氨酸脱羧酶(arginine decarboxylase,ADC)作用下脱羧基产生胍丁胺(agmatine,AGM)。AGM作为一种新型神经递质或神经调质,具有增强阿片类药物镇痛效果、减少缺血再灌注损伤、保护神经元等作用[2]。因其具有良好的药理学镇痛作用,因此将其应用于脑损伤的治疗将具有双重疗效。但AGM和NO的相互作用目前尚无一致报道[3]。本实验利用线栓法建立大鼠大脑中动脉阻塞(middle cerebral artery occlusion,MCAO)模型,在大鼠脑缺血后分别给予NO前体L-Arg、诱导型一氧化氮合酶(inducible nitric oxide synthase,iNOS)抑制剂氨基胍(aminoguanidine,AG)及AGM,求证它们对缺血性脑损伤的保护作用,并探讨各自的脑保护作用机制。
材料和方法
1 主要试剂与仪器
L-Arg、AG和AGM购自Sigma;iNOS免疫组化试剂盒购自武汉博士德生物公司;NO检测试剂盒购自碧云天生物工程有限公司。
2 方法
2.1 实验动物及分组 健康成年雄性Sprague-Dawley大鼠90只,清洁级,体重(280±20)g,新乡医学院实验动物中心提供。将75只大鼠随机分为5组:假手术组、模型组、AG组、L-Arg组和AGM组,每组15只。每组根据再灌注时间又随机分为再灌注12 h组、再灌注24 h组和再灌注72 h组,每组5只。假手术组只作颈部切开,分离颈总动脉但不插拴线;AG组、L-Arg组和AGM组均于缺血模型成功建立后即刻给药,AG组腹腔注射给予AG(100 mg/kg)1 mL,L-Arg组腹腔注射给予L-Arg(500 mg/kg)1 mL,AGM组尾静脉给予AGM(40 mg/kg)1 mL;模型组腹腔注射等容积的灭菌生理盐水。
2.2 动物模型的制备 参照Longa等[4]的线栓法,采用颈内动脉线栓法建立大鼠右侧MCAO模型。大脑中动脉栓塞2 h后,乙醚麻醉下抽出栓线,恢复大脑中动脉血液灌注。再灌注后20 min待动物清醒,参照Longa评分标准给予行为学评分:无神经病学征象为0分;竖毛,轻度运动低下为0.5分,前肢屈曲,有运动障碍为1分;行动不协调,屈曲姿势,旋转运动为2分;偏瘫,不能站立行走为3分;痉挛,昏睡为4分,死亡为5分。分数越高,动物的行为障碍越严重。
2.3 取材与NO检测 用水合氯醛(3 mL·kg-1)麻醉大鼠后迅速打开胸腔暴露心脏,右心室取血 3 mL,3 000 r·min-1,离心 10 min,提上清,打入 1 mL Eppendorf管中置于超低温冰箱待用。将灌注针头迅速自左心室插入到升主动脉,剪开右心耳,依次灌注生理盐水100 mL,多聚甲醛(20 g·L-1,pH 7.4)300 mL,3 h完毕。大鼠断头取脑,置于多聚甲醛(20 g·L-1,4 ℃)24 h ,常规脱水,在 20% 蔗糖溶液和30%蔗糖溶液进一步脱水固定。冰冻切片厚10 μm,放入脑片保护液中4℃保存1 d。大脑切片进行常规苏木素伊红(hematoxylin and eosin,HE)染色,观察脑内海马区神经元细胞的结构及损伤情况。血清NO含量测定时,先取出备用血清,用Bio Tek ELX800酶标仪,严格按NO检测试剂盒说明书测NO含量。
2.4 iNOS表达检测 以免疫组化ABC法观察脑内iNOS表达变化。显微镜下计数各组每只大鼠相应脑区内iNOS阳性表达的细胞数。在高倍镜下(×400)随机选择5个视野,每个视野计数200个细胞,计算平均百分率。根据细胞染色程度和着色细胞比例确定计分:不染色=0,轻度染色=1,中度染色=2,强染色=3;无细胞着色=0,<25%细胞着色=1,26% -50%细胞着色=2,51% -75%细胞着色=3,>75%细胞着色=4。两者计分之和大于或等于2为阳性,2-3分为+;4-5分为++;6-7分为+++。结果的判定由2位不知实验资料情况的临床病理医师进行计数。
3 统计学处理
采用SPSS 11.0软件分析。计量资料以均数±标准差(±s)表示。多组均数间比较采用单因素方差分析,两样本均数比较采用t检验。
结 果
1 大鼠行为学变化
各组大鼠行为学评分结果见表1。缺血再灌注12 h,LArg组行为学评分显著低于模型组(P<0.05);AG组(P<0.01)和AGM组(P<0.05)在缺血再灌注24 h,其行为学评分均显著低于模型组,而在缺血再灌注12 h,均明显高于LArg组(P<0.05)。其余指标差别无统计学意义。
表1 术后12、24、72 h 5组大鼠神经行为学评分Table 1.The neurobehavioral scores in the 5 groups 12 h,24 h and 72 h after operation(±s.n=5)
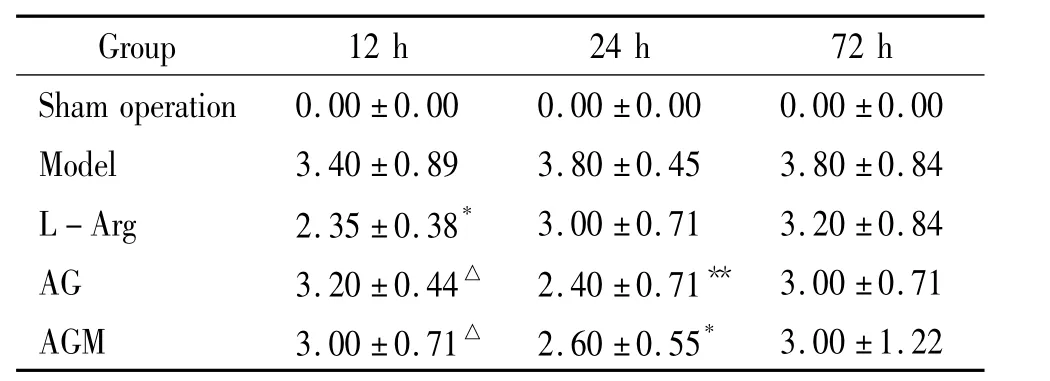
表1 术后12、24、72 h 5组大鼠神经行为学评分Table 1.The neurobehavioral scores in the 5 groups 12 h,24 h and 72 h after operation(±s.n=5)
*P <0.05,**P <0.01 vs model group;△P <0.05 vs L - Arg group.
Group 12 h 24 h 72 h Sham operation 0.00 ±0.00 0.00 ±0.00 0.00 ±0.00 3.00 ±1.22 Model 3.40 ±0.89 3.80 ±0.45 3.80 ±0.84 L -Arg 2.35 ±0.38* 3.00 ±0.71 3.20 ±0.84 AG 3.20 ±0.44△ 2.40 ±0.71** 3.00 ±0.71 AGM 3.00 ±0.71△ 2.60 ±0.55*
2 血清NO含量变化
各组大鼠血清中NO含量结果见表2。与假手术组相比,模型组、L-Arg组、AG组和 AGM组在缺血再灌注12、24、72 h的NO含量均显著增加(P<0.05);与模型组相比,LArg组在缺血再灌注12 h的NO含量显著升高(P<0.01);AG组和AGM组在缺血再灌注24、72 h的NO含量显著降低(P<0.05)。AG组和 AGM组在缺血再灌注12、24、72 h的NO含量均显著低于L-Arg组(P<0.05);其余指标差别无统计学意义。
表2 术后12、24、72 h 5组大鼠血清中NO含量Table 2.The content of NO in serum in the 5 groups 12 h,24 h and 72 h after operation(±s.n=5)
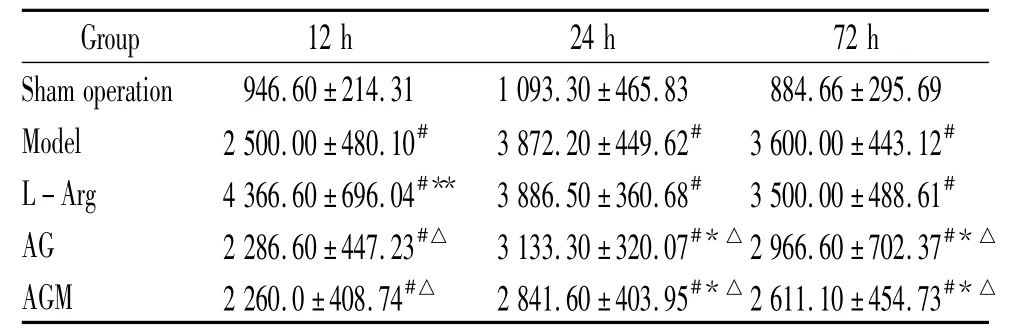
表2 术后12、24、72 h 5组大鼠血清中NO含量Table 2.The content of NO in serum in the 5 groups 12 h,24 h and 72 h after operation(±s.n=5)
#P <0.05 vs sham operation group;*P <0.05,**P <0.01 vs model group;△P <0.05 vs L-Arg group.
Sham operation 946.60 ±214.31 1 093.30±465.83 884.66±295.69 Model 2 500.00±480.10# 3 872.20±449.62# 3 600.00±443.12#L -Arg 4 366.60 ±696.04#** 3 886.50±360.68# 3 500.00 ±488.61#AG 2 286.60±447.23#△ 3 133.30±320.07#*△2 966.60±702.37#*△AGM 2 260.0±408.74#△ 2 841.60±403.95#*△2 611.10±454.73#*△
3 HE染色病理观察
光镜下假手术组脑组织未见明显异常;随着再灌注时间的延长,模型组手术侧的海马区和皮层区组织均出现明显改变,扩张的血管周围有中性粒细胞浸润,神经元细胞可见核周水肿,细胞轮廓消失、溶解等坏死性改变等程度加重。与模型组相比,L-Arg 12 h组、AG 24 h组和AGM 24 h组病变范围明显缩小,变性神经元数目明显减少,间质水肿程度明显减弱。
4 iNOS的表达
各组大鼠免疫组织化学iNOS阳性细胞计数结果见表3。与假手术组相比,各时点模型组及治疗组的iNOS阳性细胞均明显增加(P<0.05)。与模型组相比,缺血再灌注L-Arg组iNOS阳性细胞数在3个时点无显著差异(P>0.05),而AG组、AGM组均明显减少(P<0.05)。而与L-Arg组相比,AG组和AGM组的iNOS阳性细胞数在3个时点均显著降低(P<0.05)。AG组和AGM组相比,在3个时点iNOS阳性细胞数无显著差异(P>0.05)。
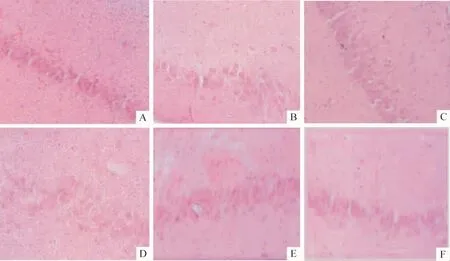
Figure 1.Neuronal changes in different groups 12 h and 24 h after reperfusion following ischemia(HE staining,×400).A:sham operation group(12 h);B:model group(12 h);C:L-Arg group(12 h);D:model group(24 h);E:AG group(24 h);F:AGM group(24 h).
图1 各组大鼠缺血再灌注12 h和24 h后神经元变化表3 5组大鼠免疫组化iNOS阳性细胞计数情况Table 3.Positive cells with iNOS protein in the 5 groups 12 h,24 h and 72 h after operation detected by immunohistochemical method(±s.n=5)

图1 各组大鼠缺血再灌注12 h和24 h后神经元变化表3 5组大鼠免疫组化iNOS阳性细胞计数情况Table 3.Positive cells with iNOS protein in the 5 groups 12 h,24 h and 72 h after operation detected by immunohistochemical method(±s.n=5)
#P<0.05 vs sham operation group;*P<0.05 vs model group;△P<0.05 vs L-Arg group.
Group 12 h 24 h 72 h Sham operation 0.40 ±0.55 0.40 ±0.55 0.20 ±0.03 Model 5.20 ±0.84# 5.20 ±1.10# 4.95 ±0.11#L - Arg 5.16 ±0.29# 4.60 ±0.55# 5.20 ±0.25#AG 1.80 ±0.84#*△ 3.20 ±0.45#*△ 4.08 ±0.88#*△AGM 1.86 ±0.11#*△ 3.31 ±0.18#*△ 3.92 ±0.11#*△
讨 论
作为强烈的血管舒张因子和信息物质,NO在急性局灶性脑缺血损伤中的作用倍受研究者关注。NOS是NO合成的关键因素,体内NO含量的多少及其生物作用完全依赖于NOS的活性。因此,对NOS的测定是深入研究NO生理病理作用的重要环节。NOS在脑内至少有3种同工酶,分别为神经元型 NOS(neuronal nitric oxide synthase,nNOS)、iNOS和内皮型NOS(endothelial nitric oxide synthase,eNOS);其中nNOS和eNOS为结构型同工酶(constitutive nitric oxide synthase,cNOS),与维持神经传递和血管舒张等生理功能有关;iNOS为诱导型同工酶,广泛存在于小胶质细胞、星形胶质细胞、中性细胞、巨噬细胞等多种细胞中[5]。在生理情况下,iNOS并不表达;但病理条件下,一些细胞可诱导iNOS基因转录,启动蛋白质合成,生成大量iNOS。iNOS的高表达产生大量的NO导致后续的过氧脂质化过程可引起DNA断裂、神经元凋亡和血脑屏障开放,因此iNOS被认为是一种“病理型”酶[6]。
本实验中,与模型组相比,L-Arg组在缺血再灌注12 h血清中NO含量显著升高,而大鼠行为学评分也有明显改善,HE染色发现病变范围缩小,变性神经元数目明显减少。该结果与以往研究相符,证实在脑缺血再灌注损伤早期,由NOS催化底物L-Arg生成一定量的NO可起保护作用。但是随着缺血再灌注损伤的延续,以及NO释放“第二窗”的开始,缺血再灌注损伤24 h后,iNOS催化产生的NO逐渐增多[7],而大剂量的NO则产生明显的细胞毒性作用。本实验通过给予大鼠iNOS抑制剂(AG)治疗后,可观察到各时点大鼠血清中NO含量均较模型组有所下降,其中缺血再灌注24 h AG组NO含量显著降低,行为学评分和脑组织病理性变化也有显著改善。但L-Arg在24 h、AG在12 h对脑组织保护作用不明显。
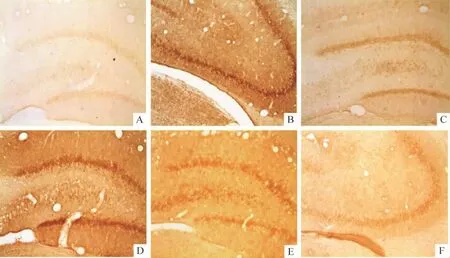
Figure 2.Expression of iNOS protein in different groups 12 h and 24 h after reperfusion following ischemia(immunohistochemical staining,×200).A:sham operation group(12 h);B:model group(12 h);C:L-Arg group(12 h);D:model group(24 h);E:AG group(24 h);F:AGM group(24 h).图2 各组大鼠缺血再灌注12 h和24 h后iNOS 蛋白表达
有报道认为,AGM是NO合成的前体,且其舒血管作用可完全被NOS抑制剂L-NAME或去除肺动脉内皮细胞所取消[8]。而Galea等[9]研究结果显示,AGM 不是NO 的前体,而是NOS的竞争性抑制剂,可抑制NO的产生。本实验中AGM组在缺血再灌注12 h、24 h、72 h脑组织中NO含量均较模型组有所降低,且最大抑制活性发生在缺血再灌注24 h。在暂时性脑缺血模型中,iNOS在6 h就有表达,6-24 h作用明显[10],因此我们推测AGM是NOS竞争性抑制剂,且主要抑制iNOS。
通过本实验,我们再次观察到NO参与缺血性脑损伤的发展及其双重作用。它们可能通过不同机制对缺血脑组织起不同作用,依赖于NO的不同来源和NOS在脑缺血不同时期的表达。脑缺血早期NO具有保护作用的机制可能是:升高平滑肌cGMP水平舒张脑血管;抑制血小板或白细胞黏附聚集;阻断N-甲基-D-天冬氨酸(N-methyl-D-aspartate,NMDA)受体[11];对突触传递介质的调节;降低神经元胞浆中游离钙的水平。但是,其详细作用机理及临床应用效果有待进一步深入研究。脑AGM作为一种内源性物质,能阻断NMDA受体通道,进入神经胶质细胞后则调节NOS的表达及活性,抑制一氧化氮合酶(NOS)活性[12]。缺血再灌注后期,脑组织内iNOS生成过量NO加重缺血再灌注损伤。但以往的研究认为iNOS选择性抑制剂AG,主要抑制NOS活性,减少NO生成,从而减轻过量NO介导的兴奋性氨基酸毒性、减少氧自由基的生成、钙超载、线粒体损伤等造成的缺血脑损伤[13,14]。但我们的研究发现:应用AG和AGM后,iNOS的蛋白表达均出现了下降,通过减少iNOS的数量减少NO的大量生成。但AG和AGM抑制作用的确切机制仍有待进一步研究。
综上所述,12 h内我们可以应用L-Arg来促进NO的释放,12-24 h之间可以应用AG、AGM抑制NO的产生。这2种方法可用于保护脑组织。选择具有高度选择性、高效低毒的临床新药,同时选择合适的给药时机和给药途径,将为临床缺血性卒中早期治疗开辟新的途径,也为早期用溶栓等方法恢复脑血供后预防缺血再灌注损伤提供更佳的治疗方案。
[1]张建新,张会欣,李兰芳,等.L-精氨酸和氨基胍对实验性脑缺血损伤的影响[J].沈阳药科大学学报,2002,19(6):435-439.
[2]Berkels R,Taubert D,Gründemann D,et al.Agmatine signaling:odds and threads[J].Cardiovasc Drug Rev,2004,22(1):7-16.
[3]阮志鹏,李春来,林丽珊,等.胍丁胺对实验性大鼠局灶脑缺血的保护作用[J].山西医科大学学报,2005,36(2):191-192.
[4]Longa EZ,Weinstein PR,Carlson S,et al.Reversible middle cerebral artery occlusion without craniectomy in rats[J].Stroke,1989 ,20(1):84 -91.
[5]Yu J,deMuinck ED,Zhuang Z,et al.Endothelial nitric oxide synthase is critical for ischemic remodeling,mural cell recruitment,and blood flow reserve[J].Proc Natl Acad Sci USA ,2005,102(31):10999-11004.
[6]刘 巍,王 钜.一氧化氮、一氧化氮合成酶及其抑制剂在缺血性脑损伤研究中的进展[J].实验动物科学与管理,2006,23(3):42 -46.
[7]张建新,张会欣,李兰芳,等.大鼠局灶性脑缺血后一氧化氮合酶基因表达的变化[J].中国应用生理学杂志,2005,21(3):246-247,277.
[8]Morrissey JJ,Klahr S.Agmatine activation of nitric oxide synthase in endothelial cells[J].Proc Assoc Am Physicians,1997,109(1):51 -57.
[9]Galea E,Regunathan S,Eliopoulos V,et al.Inhibition ofmammalian nitric oxide synthases by agmatine,an endogenous polyamine formed by decarboxylation of arginine[J].Biochem J,1996,316(Pt 1):247 -249.
[10]Zhu DY,Deng Q,Yao HH,et al.Inducible nitric oxide synthase expression in the ischemic core and penumbra after transient focal cerebral ischemia in mice[J].Life Sci,2002,71(17):1985 -1996.
[11]张会欣,张建新,李兰芳,等.一氧化氮合酶抑制剂氨基胍对脑缺血大鼠脑组织氨基酸含量的影响[J].中国病理生理杂志,2005,21(2):342-346.
[12]Reis DJ,Regunathan S.Agmatine:an endogenous ligand at imidazoline receptors is a novel neurotransmitter[J].Ann N Y Acad Sci,1999,881:65 -80.
[13]邓小明,李金宝,刘树孝,等.大鼠脑缺血再灌注损伤期间脑组织间质各种氨基酸递质水平的变化[J].中国病理生理杂志,2004,20(4):660 -663.
[14]Zhang HX,Zhang JX,Li LF,et al.Mechanism of protective effect of aminoguanidine on experimental cerebral ischemic injury in rats[J].Chin J Pharmacol Toxic,2006,20(4):281-287.

