菩人丹超微粉对糖尿病大鼠视网膜神经细胞凋亡及相关基因表达的影响
董志军, 李晓红, 董微丽, 张铁民
(承德医学院附属医院眼科,河北承德067000)
糖尿病视网膜病变(diabetic retinopathy,DR)是糖尿病眼部并发症中严重的致盲病变,是导致视力丧失的主要原因[1,2]。以往对DR发病机制的研究主要集中在视网膜新生血管方面。近年的研究表明[3],DR不仅有视网膜微血管病变,而且早期即存在视网膜神经组织的功能损害,视网膜神经保护治疗日益受到关注。本研究旨在通过观察菩人丹超微粉(Purendan superfine powder,PRD)对糖尿病大鼠视网膜神经细胞凋亡及相关基因表达的影响,探讨其对糖尿病大鼠视网膜神经组织的保护作用。
材料和方法
1 材料
1.1 药物与试剂 菩人丹超微粉由苦瓜、人参、丹参、制首乌、葛根、水蛭组成,河北以岭药业集团有限公司代加工生产;链脲佐菌素(streptozotocin,STZ)购自Sigma;Trizol购自Invitrogen;脱氧核糖核苷酸末端转移酶介导的缺口末端标记法(TdT-mediated dUTP nick end labeling,TUNEL)细胞凋亡检测试剂盒购自Roche;B细胞白血病/淋巴瘤相关抗原2(B-cell leukemia/lymphoma 2,Bcl-2)和 B细胞白血病/淋巴瘤相关抗原相关X蛋白(Bcl-associated X,Bax)兔抗多克隆抗体均购自Santa Cruz;半胱氨酸天冬氨酸蛋白酶3(caspase-3)兔抗多克隆抗体购自Bioworld Technology;bcl-2、bax和 caspase-3引物购自上海生工公司;SP免疫组化试剂盒购自北京中杉金桥生物技术公司;RT-PCR试剂盒购自大连宝生物工程有限公司。
1.2 动物 清洁级雄性Wistar大鼠[北京维通利华实验动物技术有限公司,许可证编号为SCXK(京)2006-0009],体重200-250g。
2 方法
2.1 动物分组、模型制备与给药 将36只大鼠应用随机数字表法进行完全随机化分组,分为正常对照组、糖尿病模型组和PRD治疗组,每组12只。糖尿病模型组、PRD治疗组大鼠均采用2%STZ(25 mg·kg-1·d-1,3 d)连续腹腔注射建立糖尿病动物模型,以血糖≥16.7 mmol·L-1作为成模标准[4]。模型成功建立后,依体表面积折算确定PRD治疗组给药剂量为 1.8 g 超微粉·kg-1·d-1,用蒸馏水配制成浓度为0.25 kg超微粉/L混悬液,按7.2 mL/kg动物体重灌胃,每天灌胃1次,连续灌胃3个月。正常对照组及糖尿病模型组按7.2 mL/kg动物体重用蒸馏水灌胃。
2.2 标本制备 PRD治疗结束后,10%水合氯醛腹腔注射麻醉(0.5 g·kg-1)大鼠,迅速取出双侧眼球,一侧眼球浸于4%多聚甲醛固定液24 h,常规脱水、透明、浸蜡和包埋,分别备用于TUNEL法原位检测细胞凋亡及免疫组织化学染色检测Bcl-2、Bax和caspase-3蛋白表达;另一侧眼球迅速利用动物手术显微镜在冰面上钝性分离视网膜组织,投入液氮中保存,备用于RT-PCR法检测bcl-2、bax、caspase-3 mRNA表达。
2.3 TUNEL法原位检测细胞凋亡 石蜡切片常规脱蜡至水,proteinase K工作液消化15 min,TUNEL反应液37℃孵育60 min,过氧化物酶(peroxidase,POD)转化剂37℃孵育30 min,二氨基联苯胺(diaminobenzidine,DAB)显色,苏木素复染,脱水,透明,封片。凋亡细胞的细胞核呈棕褐色着染。凋亡指数(apoptotic index,AI)的确定:切片在×400显微镜下选取视网膜,以TUNEL阳性细胞数目与同一视野神经细胞总数的比值作为视网膜神经细胞凋亡指数。每只动物任选3张切片,每张切片选取5个视野,取平均值。
2.4 免疫组织化学染色检测Bcl-2、Bax和caspase-3蛋白的表达 眼球平行视神经连续矢状切片,片厚4 μm,采用SP免疫组织化学染色方法检测视网膜Bcl-2、Bax和caspase-3蛋白的表达。Ⅰ抗分别为Bcl-2、Bax和caspase-3多克隆抗体,稀释浓度为1∶100,DAB 显色,苏木素复染细胞核。以0.01 mmol·L-1PBS代替Ⅰ抗作为阴性对照。Bcl-2和Bax以胞浆中出现棕黄色颗粒为阳性反应,caspase-3以胞核中出现棕黄色颗粒为阳性反应。采用MiVnt图像分析系统对免疫组化阳性结果进行定量分析:切片在×400显微镜下选取视网膜,以免疫阳性产物面积占视野面积的比值作为目的蛋白的相对表达水平。每只动物任选3张切片,每张切片选取5个视野,取平均值。
2.5 RT-PCR 检测视网膜 bcl-2、bax和 caspase-3 mRNA表达 取液氮中保存的视网膜,按Trizol总RNA抽提说明书操作,提取视网膜组织的总RNA。取5 μL RNA,1%琼脂糖凝胶电泳,可见明显的28 S、18 S和5 S三条完整条带,说明抽提的总RNA比较完整;紫外分光光度计检测A260/A280值为1.9-2.1,说明RNA没有被污染。取3 μg总RNA为模板逆转录成cDNA,反应条件为:30℃10 min;55℃30 min;99℃5 min;5℃5 min。PCR反应条件:94℃2 min;94℃30 s;50℃ -65℃30 s;72℃1 min,第2步起循环。bcl-2引物序列为:正义链5'-TGGGATGCCTTTGTGGAACTAT-3',反义链5'-GCTGATTT-GACCATTTGCCTGA -3',退火温度为 55℃,30 个循环,产物大小为328 bp;bax引物序列为:正义链5'-GAGCGAGTGTCTCCGGCGAATT-3',反义链 5'-GCCACAAAGATGGTCACTGTCTGC -3',退火温度为59℃,31个循环,产物大小为357 bp;caspase-3引物序列为:正义链5'-ATGTCGATGCAGCTAACCTCA -3',反义链 5'- TGTCTCAATACCGCAGTCCAG-3',退火温度为53℃,31个循环,产物大小为320 bp;β-actin引物序列为:正义链 5'-CATCCTGCGTCTGGACCT-3',反义链 5'- TCAGGAGGAGCAATGATCTTG-3',退火温度为58℃,29个循环,产物大小为480 bp。PCR产物经2%琼脂糖凝胶电泳,采用ZF型紫外透射反射分析仪摄初像,并用Quantity One-4.6.2软件进行定量分析,以目的条带的光密度与β-actin条带吸光度的比值作为各目的基因mRNA表达的相对水平。
3 统计学处理
结 果
1 视网膜原位凋亡细胞检测结果
各组大鼠视网膜切片均可见TUNEL阳性染色。TUNEL阳性产物位于胞核,呈棕褐色颗粒状,阳性细胞主要分布于视网膜神经节细胞层及内核层,呈散在分布。模型组大鼠视网膜神经细胞AI较正常组明显升高(P<0.01);PRD治疗组大鼠视网膜神经细胞AI较模型组显著降低(P<0.01),见表1、图1。
表1 各组大鼠视网膜神经细胞凋亡指数Table 1.Apoptotic index(AI)of retina in each group(±s.n=12)

表1 各组大鼠视网膜神经细胞凋亡指数Table 1.Apoptotic index(AI)of retina in each group(±s.n=12)
** P <0.01 vs diabetes model group.
Group AI Normal control 0.0236 ±0.0043**Diabetes model 0.2244 ±0.0263 PRD treatment 0.1171 ±0.0196**
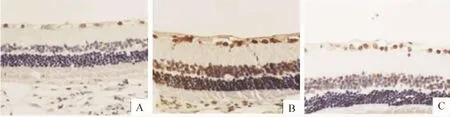
Figure 1.Neuron apoptosis in retina detected by TUNEL staining(×400).A:normal control group;B:diabetes model group;C:PRD treatment group.图1 TUNEL法检测各组视网膜神经细胞凋亡
2 免疫组织化学法检测视网膜 Bcl-2、Bax和caspase-3蛋白表达结果
Bcl-2、Bax和caspase-3免疫阳性产物呈棕黄色细腻颗粒状,Bcl-2和Bax免疫阳性产物位于胞浆,caspase-3免疫阳性产物位于胞核;阳性细胞主要分布于视网膜神经节细胞层及内核层。糖尿病模型组与正常对照组比较,大鼠视网膜Bax和caspase-3蛋白表达明显升高(P<0.01)及Bcl-2蛋白表达、Bcl-2/Bax比值显著降低(P <0.01)。PRD 治疗组与模型组比较,大鼠视网膜Bax和caspase-3蛋白表达均明显降低,Bcl-2蛋白表达及Bcl-2/Bax比值显著升高(P <0.01),见表2、图2-4。
3 RT-PCR检测视网膜bcl-2、bax和caspase-3 mRNA表达结果
在 DNA marker的 328 bp、357 bp、320 bp 及 480 bp水平处分别可见清晰的bcl-2、bax和caspase-3及β-actin mRNA条带。与正常组大鼠比较,糖尿病模型组大鼠视网膜bax和caspase-3 mRNA表达明显升高(P <0.01),bcl-2 mRNA 表达和 bcl-2/bax比值显著降低(P<0.01)。PRD治疗组与模型组比较,大鼠视网膜bax和caspase-3 mRNA表达均明显降低(P <0.01),bcl-2 mRNA 表达及 bcl-2/bax比值显著升高(P <0.01),见表3、图5-7。
表2 各组大鼠视网膜Bcl-2、Bax和caspase-3蛋白的表达Table 2.Bcl-2,Bax and caspase-3 protein expression levels in retina of rats in each group(±s.n=12)
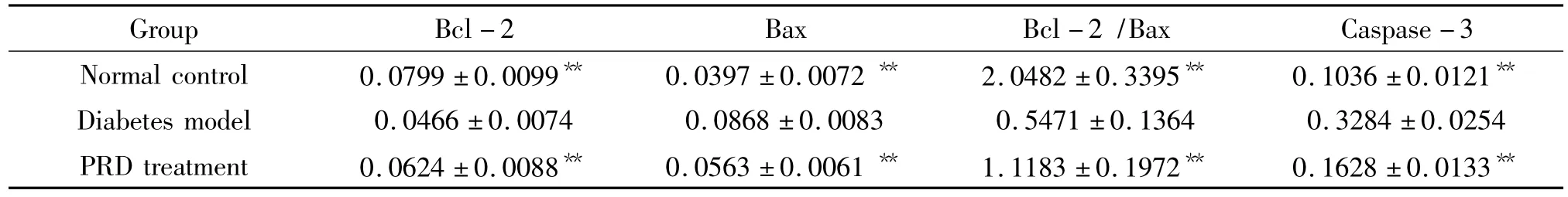
表2 各组大鼠视网膜Bcl-2、Bax和caspase-3蛋白的表达Table 2.Bcl-2,Bax and caspase-3 protein expression levels in retina of rats in each group(±s.n=12)
**P <0.01 vs diabetes model group.
Group Bcl-2 Bax Bcl-2/Bax Caspase-3 Normal control 0.0799 ±0.0099** 0.0397 ±0.0072 ** 2.0482 ±0.3395** 0.1036 ±0.0121**Diabetes model 0.0466 ±0.0074 0.0868 ±0.0083 0.5471 ±0.1364 0.3284 ±0.0254 PRD treatment 0.0624 ±0.0088** 0.0563 ±0.0061 ** 1.1183 ±0.1972** 0.1628 ±0.0133**
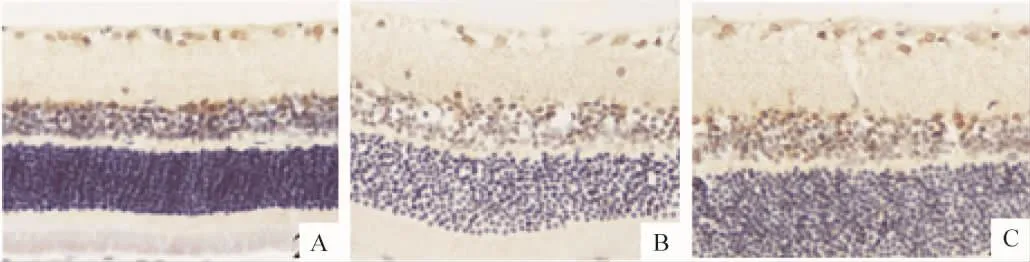
Figure 2.Bcl-2 protein expression in retina by immunohistochemical staining(×400).A:normal control group;B:diabetes model group;C:PRD treatment group.图2 免疫组织化学染色检测各组视网膜组织Bcl-2蛋白表达
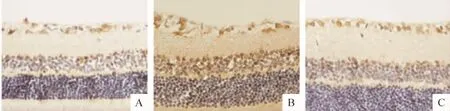
Figure 3.Bax protein expression in retina by immunohistochemical staining(×400).A:normal control group;B:diabetes model group;C:PRD treatment group.图3 免疫组织化学染色检测各组视网膜组织Bax蛋白表达
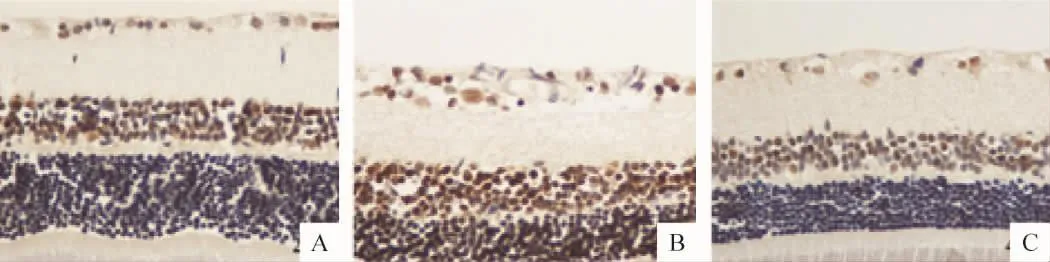
Figure 4.Caspase-3 protein expression in retina by immunohistochemical staining(×400).A:normal control group;B:diabetes model group;C:PRD treatment group.图4 免疫组织化学染色检测各组视网膜组织caspase-3蛋白表达
表3 各组大鼠视网膜bcl-2、bax和caspase-3 mRNA的表达Table 3.Bcl-2,bax and caspase-3 mRNA expression levels in retina of rats in each group(±s.n=12)
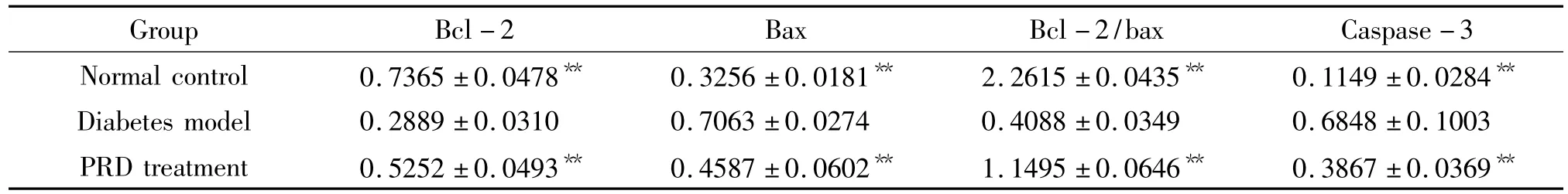
表3 各组大鼠视网膜bcl-2、bax和caspase-3 mRNA的表达Table 3.Bcl-2,bax and caspase-3 mRNA expression levels in retina of rats in each group(±s.n=12)
** P <0.01 vs diabetes model group.
Group Bcl-2 Bax Bcl-2/bax Caspase-3 Normal control 0.7365 ±0.0478** 0.3256 ±0.0181** 2.2615 ±0.0435** 0.1149 ±0.0284**Diabetes model 0.2889 ±0.0310 0.7063 ±0.0274 0.4088 ±0.0349 0.6848 ±0.1003 PRD treatment 0.5252 ±0.0493** 0.4587 ±0.0602** 1.1495 ±0.0646** 0.3867 ±0.0369**
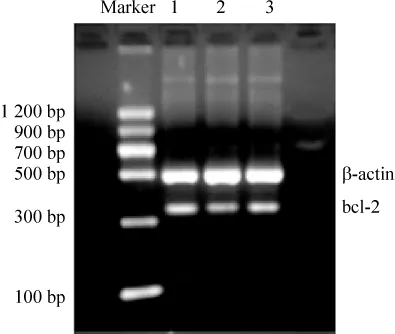
Figure 5.Bcl-2 mRNA expression in retina detected by RTPCR.A:normal control group;B:diabetes model group;C:PRD treatment group.图5 RT-PCR检测各组视网膜组织bcl-2 mRNA表达
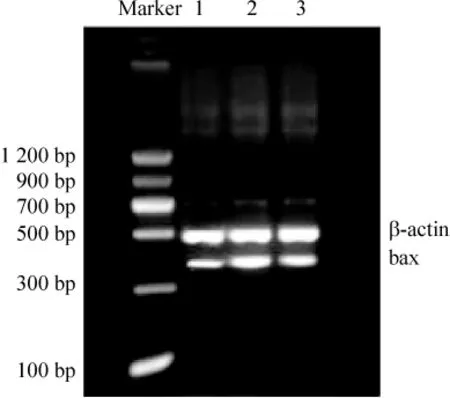
Figure 6.Bax mRNA expression in retina detected by RTPCR.A:normal control group;B:diabetes model group;C:PRD treatment group.图6 RT-PCR检测各组视网膜组织bax mRNA表达
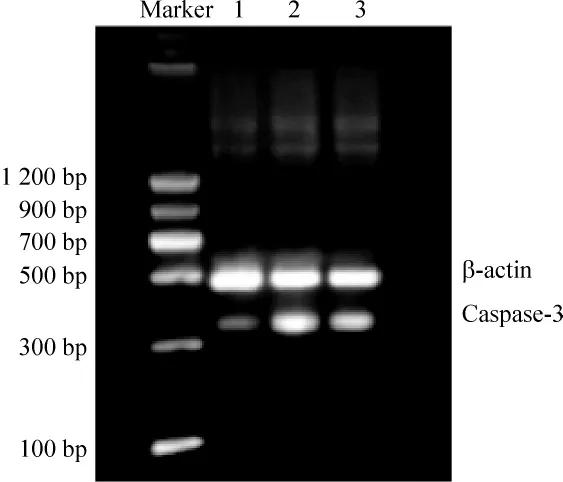
Figure 7.Caspase-3 mRNA expression in retina detected by RT-PCR.A:normal control group;B:diabetes model group;C:PRD treatment group.图7 RT-PCR检测各组视网膜组织caspase-3 mRNA表达
讨 论
DR包括微血管病变及神经组织病变,二者共同损伤视网膜造成其功能下降。以往对微血管病变的研究较为广泛和深入,但近年的研究表明,DR不仅存在视网膜神经组织的功能损害,而且常较微血管病变更早,甚至是微血管病变的启动因素[5,6]。
细胞凋亡是多细胞有机体为调控机体发育,维护内环境稳定,由基因控制的细胞主动性死亡过程。视网膜神经组织病变与细胞凋亡密切相关。Barber等[7]研究发现,病程1个月时STZ糖尿病大鼠视网膜中凋亡的神经细胞为正常对照组的10倍。本研究结果与前人类似:糖尿病模型组大鼠视网膜凋亡的神经细胞主要分布于视网膜的神经节细胞层及内核层,且神经细胞凋亡指数较正常组明显升高,因此提示视网膜神经细胞凋亡参与了DR的发生发展。
细胞凋亡的发生是在多种凋亡相关基因的调控下进行的,尤其是bcl-2、bax基因与凋亡的调控关系非常密切[8,9]。bcl-2是一种抑制细胞凋亡的基因,bax基因与bcl-2基因具有高度的同源序列,是促进细胞凋亡的基因[10]。当bax占优势时,Bax蛋白同源二聚体形成,可诱导和促进细胞凋亡;当Bcl-2占优势时,Bcl-2可以与Bax竞争结合,形成比Bax/Bax同源二聚体更稳定的Bcl-2/Bax异源二聚体,从而使Bax/Bax同源二聚体分开,减弱Bax诱导凋亡的作用[11]。Bcl-2与Bax的平衡保证细胞的稳态,二者比值的变化将决定细胞是生存还是凋亡,Bcl-2占优势、Bcl-2/bax比值升高则细胞存活;Bax占优势、Bcl-2/Bax 降低则细胞凋亡[12]。Caspase-3又被称为“细胞死亡执行者”,它的表达与活化代表了细胞凋亡的不可逆转。活性caspase-3可直接水解细胞的重要结构及功能蛋白,导致蛋白酶级联反应放大效应,最终导致细胞凋亡[13]。本研究发现,糖尿病模型组大鼠视网膜 Bcl-2、Bax及caspase-3蛋白表达主要位于神经节细胞层和内核层,与正常对照组比较,Bax、caspase-3表达明显升高,Bcl-2表达及Bcl-2/Bax比值显著降低,提示Bcl-2、Bax、caspase-3 确实在 DR 视网膜神经细胞凋亡中发挥了关键作用。
菩人丹超微粉(PRD)是针对糖尿病病机关键“热、虚、瘀”的中药组方。本方以苦瓜(《广东新语》又称菩达)清解郁热;人参、丹参、葛根益气生津、活血化瘀;制首乌补益精血,固肾益阴;水蛭祛瘀消癥,剔邪搜络。诸药协同,益气养阴,调畅气血,化瘀通络。现代药理研究证实PRD具有抑制氧化应激、对抗细胞凋亡失调和衰老、改善微循环、促进组织的修复与再生等作用[14,15]。本研究发现,PRD组大鼠视网膜神经细胞AI、Bax、caspase-3的表达明显低于模型组大鼠,Bcl-2表达及Bcl-2/Bax比值较模型组显著升高。这表明PRD可通过上调抑制凋亡基因bcl-2表达、下调促凋亡基因bax表达,抑制caspase-3的激活,从而抑制视网膜神经细胞凋亡,发挥对视网膜神经组织的保护作用。
[1]Studholme S.Diabetic retinopathy[J].J Perioper Pract,2008,18(5):205-210.
[2]史 煜,李 斌,李 涛,等.rAAV2-NTF2对糖尿病大鼠血视网膜屏障的保护作用[J].中国病理生理杂志,2009,25(4):759-763.
[3]Park JW,Park SJ,Park SH,et al.Up-regulated expression of neuronal nitric oxide synthase in experimental diabetic retina[J].Neurobiol Dis,2006,21(1):43 - 49.
[4]于德民,吴 锐,尹 潍,等.实验性链脲佐菌素糖尿病动物模型的研究[J].中国糖尿病杂志,1995,3(2):105-109.
[5]杨宏伟,陈晓隆,卜立敏,等.细胞凋亡在STZ诱导糖尿病大鼠早期视网膜病变中的作用机制[J].眼科研究,2009,27(6):472-476.
[6]Fletcher EL,Phipps JA,Ward MM,et al.Neuronal and glial cell abnormality as predictors of progression of diabetic retinopathy[J].Curr Pharm Des,2007,13(26):2699-2712.
[7]Barber AJ.A new view of diabetic retinopathy:a neurodegenerative disease of the eye[J].Prog Neuropsychophamacol Biol Psychiatry,2003,27(2):283-290.
[8]Kutuk O,Basaga H.Bcl-2 protein family:implications in vascular apoptosis and atherosclerosis[J].Apoptosis,2006,11(10):1661-1675.
[9]褚薇薇,聂 蕾,和新盈,等.后处理对肠缺血-再灌注大鼠肺组织凋亡相关基因表达的影响[J].中国病理生理杂志,2010,26(9):1786-1789.
[10]Tsukahara S,Yamamoto S,Shew TT,et al.Inhalation of low-level formaldehyde increases the Bcl-2/Bax expression ratio in the hippocampus of immunologically sensitized mice[J].Neuroimmunomodulation,2006,13(2):63 -68.
[11]Alves NL,Lier RA,Eldering E.Withdrawal symptoms on display:Bcl-2 members under investigation[J].Trends Immunol,2007,28(1):26 -32.
[12]Del Principe MI,Del Poeta G,Venditti A,et al.Apoptosis and immaturity in acute myeloid leukemia[J].Hematology,2005,10(1):25-34.
[13]李 晶,于海波,康玉明,等.灵芝孢子粉对癫痫大鼠学习记忆、caspase-3和livin的影响[J].中国病理生理杂志,2009,25(2):386-388.
[14]庞宗然,李晓军,吴丽芳,等.菩人丹超微粉对肥胖型T2DM大血管损伤大鼠血清sVCAM-1、TNF-α的影响[J].中国中医基础医学杂志,2008,14(2):152-153.
[15]庞宗然,贾春华,崔 箭,等.菩人丹胶囊对糖尿病大鼠血清胰岛素及胰岛β细胞的影响[J].中医药学刊,2004,22(10):1810-1812.

