硫酸钡比浊法测定皂角多糖修饰物中硫酸基的研究
张亚男
(泰山学院化学与环境科学系,山东 泰安 271021)
多糖是生物有机体内普遍存在的一类生物大分子,既以游离的形式参与生命过程,又与蛋白质、肽及脂质等组成聚合物的形式;它不仅参与组织细胞骨架的构成,而且是多种内源性生物活性分子的重要组成成分;它在生理机能的平衡与稳定过程中发挥重要的调节作用,同时广泛参与细胞的各种生命活动而产生多种生物学功能[1-2].某些植物多糖特别是其修饰物具有抗血栓、调节血脂、抗肿瘤、抗病毒、增强细胞免疫和机体免疫功能、抗氧化、对机体细胞的保护等作用[3-10].活性多糖的研究已成为当今研究的一个热点,它的重要特征是在多糖链上具有硫酸基,而且其活性与分子中硫酸基的含量有着直接关系,硫酸基含量越高,其抗HIV病毒的作用越强[11].因此,准确测定硫酸基含量是十分重要的.
1 实验部分
1.1 仪器与试剂
紫外分光光度计,PHAMACIA UV2000.
硫酸基标准储备液:精密称取105℃干燥至恒质量的Na2SO488.6 mg溶于1mol/L的盐酸中(SO24-浓度为0.6 mg/mL);明胶:分别配制成0.25%、0.50%、0.75%的溶液,冷藏保存;氯化钡:1 g氯化钡溶于100 mL明胶溶液中;三氯乙酸:2%、3%、5%的水溶液.
1.2 实验方法
通过盐酸水解从皂角多糖修饰物中释放硫酸基,与BaCl2生成硫酸钡,SO24-含量与其吸光度呈线性关系,用分光光度计在360nm处,测定其吸光度值,计算出硫酸基的含量.以线性关系相关系数和回收率为指标考察试剂用量和水解条件对检测方法的影响,确定最优的实验条件,确定硫酸钡比浊法检测皂角多糖硫酸基含量的准确性.
1.2.1 皂角多糖修饰物样品(以下简称样品)的处理
称取样品100 mg,用1 mol/L HCl溶液(盐酸浓度为考察条件之一)溶解,于100℃水浴中水解,冷却后,加盐酸溶液补至刻度线,用滤纸过滤,除去不溶物质,即得粗样品,保存备用.
1.2.2 紫外光谱的测定
取Na2SO4标准品和样品溶液各0.2 mL,加三氯乙酸溶液3.8 mL和氯化钡溶液1mL,将其混匀,进行紫外光谱测定.结果表明,Na2SO4和样品均在360nm处有最大吸收峰.
1.2.3 标准曲线的绘制
准确吸取标准Na2SO4标准溶液0.02mL,0.06mL,0.08mL,0.10mL,0.12mL,0.14mL,0.16mL,0.20mL,以盐酸溶液补至0.2mL,以0.2 mLHCl溶液作为空白,加入三氯乙酸3.8 mL及氯化钡溶液1.0 mL,摇匀,室温静置15 min,于360 nm测吸光度A1;以1.0 mL明胶溶液代替氯化钡溶液,测吸收度A2;以硫酸基质量浓度(μg/mL)为横坐标,吸光度(A1-A2)为纵坐标,得标准曲线,确定线性范围及线性关系.其中每点做三个平行样品,取平均值.
1.2.4 回收率试验
精密吸取标准储备液和样品溶液按比例摇匀,取0.15ml按硫酸基含量测定方法测定SO2-4含量,计算回收率及相对标准偏差RSD%[12].
2 结果与讨论
2.1 明胶浓度的影响
通过绘制Na2SO4与不同浓度明胶混合反应的标准曲线并且测定回收率,考察明胶浓度对线性关系的影响[13-14],确定硫酸比浊法中适宜的明胶浓度.
按标准曲线绘制方法操作,控制C(SO2-4)在0~60μg/ml(HCl补足至0.5 ml),3%三氯乙酸加入量3.5ml,分别用0%(超纯水代替)、0.25%、0.5%、0.75%的明胶配制的1%的BaCl2加入量1ml.标准曲线检测结果见表1,不同浓度明胶的回收率结果见表2.

表1 不同明胶浓度的线性关系考察结果

表2 不同浓度明胶的回收率
由表1可以看出明胶浓度对线性关系影响很小,去除相关系数最小的0%的明胶,其他浓度范围内,标准曲线线性关系良好,相关系数R都高于0.994.用回收率考察明胶的影响结果(表2)可以看出0.25%的明胶线性关系虽然很好,但是平均回收率非常低.明胶浓度为0.5%和0.75%的标准曲线线性关系和回收率都比较好,其中明胶浓度为0.5%时平均回收率为98.47%,RSD%为3.42%;明胶浓度为0.75%时平均回收率为100.97%,RSD%为4.33%,综合看明胶浓度为0.75%时测得的回收率更好,故适宜的明胶浓度为0.75%.
2.2 三氯乙酸浓度的影响
取0.75%的明胶作为溶剂配制1%的BaCl2.控制三氯乙酸加入量3.5ml,1%的BaCl2加入量1 ml的条件下,考察不同浓度三氯乙酸对线性关系的影响,操作步骤同标准曲线.实验结果见表3,不同浓度三氯乙酸的回收率结果见表4.

表3 不同三氯乙酸浓度的线性关系考察结果

表4 不同浓度三氯乙酸下的回收率
由表3可以看出三氯乙酸浓度对线性关系影响很小,三氯乙酸浓度0%~5%范围内,标准曲线线性关系良好,相关系数都高于0.99.由表4可以看出三氯乙酸浓度为0%和2%时回收率较低,三氯乙酸浓度为3%时回收率的平均值为98.47%,RSD%为6.52%,三氯乙酸浓度为5%时回收率的平均值为101.59%,RSD%为9.35%,结合两者看出3%的三氯乙酸测定结果更好,因此测定过程中三氯乙酸浓度宜为3%.
2.3 水解时间对检测结果的影响
选取三氯乙酸浓度为3%,明胶浓度为0.75%,按标准曲线进行操作.称取的微量样品用1molHCl以1mg/ml溶解好之后,放进超级恒温器水解,控制水解温度100℃,取出不同时间的样品溶液测吸光度,并分别计算硫酸基质量浓度C(SO2-4)、硫的质量浓度Cs及硫的质量百分含量s%,以s%为指标,考察水解时间对检测结果的影响,测定结果见表5、图1.

表5 水解时间对检测结果的影响

图1 水解时间对检测结果的影响
由表5和图1可以看出在加热水解180分钟时,吸光度和硫的质量百分含量S%测定值最高,说明在180分钟时样品水解完全,硫酸根游离出来,而水解时间过长时可能会导致反应系统发生一些变化影响检测结果,所以水解时间宜控制180分钟,水解条件确定为100℃、3小时.
2.4 水解时盐酸浓度对检测结果的影响
保持样品溶液质量浓度为1mg/mlHCl,改变盐酸浓度,检测用不同浓度盐酸溶解的样品在水解条件为100℃、3小时下的吸光度,并分别计算硫酸基质量浓度C(SO2-4)、硫的质量浓度Cs及硫质量百分含量s%,以s%为指标,确定适宜的盐酸浓度.
为了使检测结果更加准确,应消除盐酸中可能含有的硫的影响,以及考虑在加热过程中盐酸易挥发特性的影响,将未加入样品的盐酸管与加入样品的盐酸管一同在100℃下水解三小时,以便使两者盐酸的挥发量比较相近,空白与待测样品测定时浓度较一致,使测量值更准确.实验结果见表6.
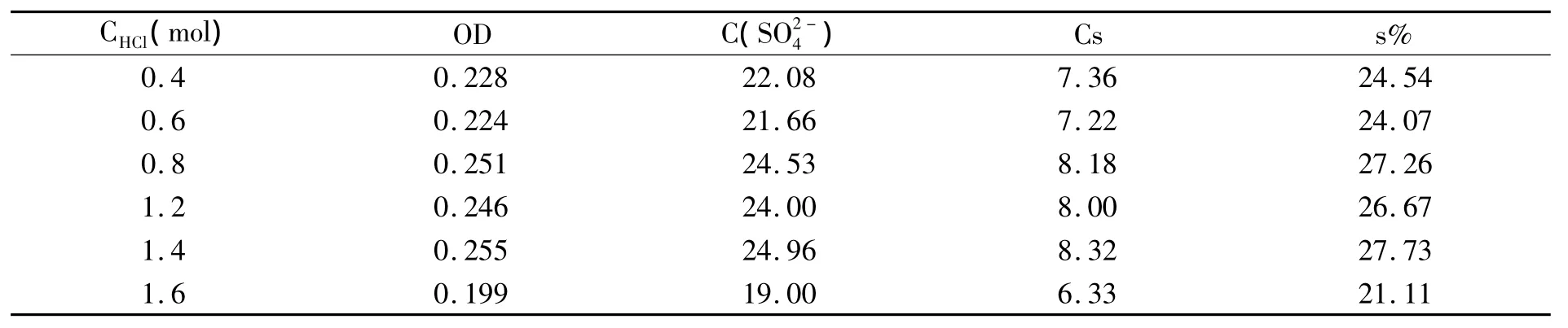
表6 盐酸浓度对检测结果的影响
由表6可以看出,盐酸浓度在0.8~1.4mol/L之间时s%较大并且稳定,说明在此条件多糖完全水解,过高的盐酸浓度1.6mol会影响检测结果,因此较适宜的盐酸浓度是0.8~1.4mol/L,为了方便起见选择浓度为1mol/L的盐酸溶解样品,进行水解.
2.5 水解时盐酸用量对检测结果的影响
保持样品用1mol/L的HCl溶解,改变盐酸的用量,检测不同质量浓度的样品在相同水解条件为100℃、3小时下的吸光度,计算硫的质量百分含量s%.以s%为指标,考察盐酸用量对检测结果的影响.同2.4操作步骤,将未加入样品的盐酸管与加入样品的盐酸管一同在100℃下水解三小时,测量结果见表7.

表7 盐酸用量对检测结果的影响
由表7可以看出,盐酸用量在4~6ml之间时s%较稳定,说明此时多糖完全水解,硫酸根游离出来,而盐酸用量较高时会影响测定结果.所以选择用5ml盐酸溶解样品去加热水解.
3 结论
通过对硫酸钡光电比浊法测定皂角硫酸多糖中硫含量的各种影响因素进行研究,得到相关的适宜测定条件.确定溶解氯化钡的明胶浓度为0.75%,三氯乙酸浓度为3%,样品溶液水解时间为3小时,溶解样品的盐酸浓度为1mol/L,每溶解1mg样品盐酸用量为5ml.对于该方法测定准确性等内容将在后续实验中进一步研究.
[1]张树政.糖生物学与糖生物工程[M].北京:清华大学出版社,2002.
[2]诸葛健.功能性多糖的构效关系[J].无锡轻工业大学学报,2002,(3):209-212.
[3]邱芳萍,张玲,于健.硫酸钡比浊法对鹿茸多糖中硫酸基含量的测定[J].长春工业大学学报,2005,26(4):268-270.
[4]Ruperez P,Ahrazem O,Leal JA.Potential antioxidant capacity of sulfated polysaccharides from the ediblemarine brown seaweed Fucus vesiculosus[J].J.Agic.Food Chem,2002,50(4):840.
[5]马茜.硫酸钡吸光比浊法测定大蒜中大蒜素含量[J].光谱实验室,2007,24(3):345-347.
[6]易凤英,刘素纯,李佳莲,等.茶多糖的提取方法及其生理功能研究进展[J].安徽农业科学,2010,38(6):2911-2913.
[7]蔡为荣,孙元琳,汤坚.果胶多糖结构与降血脂研究进展[J].食品科学,2010,31(5):307-311.
[8]毛健,马海乐.灵芝多糖的研究进展[J].食品科学,2010,31(1):295-299.
[9]孙运峰,李海娜,周长征,等.鼠尾草属药用植物多糖的研究进展[J].食品与药品,2010,12(3):138-141.
[10]Jiang RW,Lau K M,Hon PM,et al.Chemistry and biological activities of caffeic acid derivatives from salviamiltiorrhiza[J].Curr Med Chem,2005,12(2):237-246.
[11]李运龙.一种抗艾滋活性植物多糖制备工艺的研究[D].昆明:昆明理工大学,2004.
[12]马巍,战义鹏.加标回收率计算方法的探讨[J].黑龙江医药科学,1999,22(1):88.
[13]丛建波,王长振,李妍,等.褐藻硫酸多糖硫酸基含量测定——硫酸钡比浊法研究[J].解放军药学学报,2003,19(3):181-183.

