姜黄素对人肾癌786-О细胞凋亡和侵袭的影响
刘 岩, 张春阳, 张大田, 姜华茂
(辽宁医学院附属一院泌尿外科,辽宁锦州121001)
姜黄素(curcumin)是从姜科姜黄属植物姜黄curcuma longa根茎中提取的一种酚性色素。其中医性味归经属辛、苦、温。归脾、肝经,用于胸胁刺痛、闭经、风湿肩臂疼痛等[1]。姜黄的化学成分主要为姜黄素类及挥发油两大类,此外尚有糖类、甾醇等。姜黄素类化合物(curcumins)是中药姜黄的主要有效成分,含量约占3% ~6%,主要包括姜黄素(curcumin)、去甲氧基姜黄素(demethoxy curcumin)和去二甲氧基姜黄素(bisde-methoxy curcumin)3种。晶体姜黄素为淡黄色粉末,含量≥90%,溶于乙醇、丙酮、乙二醇及碱性溶液;不溶于水、乙醚;微溶于植物油[2]。姜黄素具有抗肿瘤、抗炎、抗氧化、抗纤维化、抗动脉粥样硬化的作用。Siddiqui等[3]在巨噬细胞系RAW264.7细胞中发现用50 μM和100 μM姜黄素预处理的细胞比单纯用脂多糖处理的细胞PPAR-γmRNA表达水平分别增加86%和125%,从体外实验表明姜黄素可通过上调PPAR-γ发挥抗炎作用。Kowluru[4]等研究显示姜黄素能明显阻止糖尿病导致的抗氧化能力减弱,延缓糖尿病视网膜病变的发展,其机制是姜黄素能抑制氧化DNA在视网膜的积聚和提高GSH水平。Punithavathi等[5]在胺碘酮诱导的动物肺纤维化模型的研究中证实,应用姜黄素对肺纤维化具有治疗作用,姜黄素可降低肺纤维化模型大鼠支气管肺泡灌洗液的细胞总数和蛋白总量,以及乳酸脱氢酶活性,抑制肺髓过氧化物酶的活性。Yuan HY等[6]研究发现在血管平滑肌细胞中,姜黄素能通过抑制胆固醇调节元件结合蛋白-1核转位增加小凹蛋白-1的表达,从而阻止氧化修饰型LDL引起的胆固醇积聚。此外,姜黄素还可下调HIV相关细胞因子的表达,抑制HIV患者B细胞淋巴瘤的增殖[7]。肾癌是泌尿系常见的恶性肿瘤,肾癌的发病率和死亡率均有上升趋势,转移性肾癌手术死亡率为2% ~11%[8]。肿瘤的侵袭与转移影响着肿瘤患者的预后,抑制肿瘤的侵袭和转移是治疗肿瘤的重要靶点。本研究通过体外实验研究姜黄素对肾癌细胞凋亡的影响和对肾癌细胞外基质蛋白酶MMP2、MMP9的表达效应,研究其诱导肾癌细胞凋亡及抗侵袭作用的可能机制,为肾癌的临床药物治疗提供理论依据。
1 材料与方法
1.1 材料
1.1.1 药物及细胞株 姜黄素经HPLC检测,购自上海友思生物技术公司;786-О(人)肾透明细胞癌,购自北京协和医科大学细胞所。
1.1.2 主要化学试剂 鼠抗人MMP2/MMP9单克隆抗体,购自北京中杉金桥生物技术公司;TUNEL细胞凋亡原位检测试剂盒,购自美国Roche公司。
1.1.3 主要仪器 美国BeckmanCoulter流式细胞仪,型号:EPICSFC500;BG-subMIDI多用途水平电泳仪,Baygene美国。
1.2 方法
1.2.1 流式细胞分析 取对数生长期的786-О细胞,调细胞数为5 ×106/mL,分别加入 5、10、20、40 μmol/L 不同浓度的姜黄素溶液,每个浓度3复孔,设不加任何药物的对照组,培养48 h。流式细胞仪检测、制片后荧光显微镜下观察。
1.2.2 TUNEL技术 取对数生长期的786-О细胞,调细胞数为5 ×106/mL,分别加入 5、10、20、40 μmol/L 不同浓度的姜黄素溶液,每个浓度3复孔,设不加任何药物的对照组,培养48 h。取出载玻片,用4%多聚甲醛室温固定30 min,封闭内源性过氧化物酶,滴加TUNEL混合反应液50 μL(酶溶液与标记溶液按照1∶9体积混合),置湿盒37℃孵育60 min,同时以标记溶液代替反应溶液作为阴性对照滴加POD液50 μL,置湿盒37℃孵育30 min,滴加新鲜配制的DAB显色液50 μL,中性树胶封片。
1.2.3 DNA片段琼脂糖凝胶电泳 取对数生长期的786-О细胞,调细胞数为 5 ×106/mL,分别加入 5、10、20、40 μmol/L不同浓度的姜黄素溶液,每个浓度3复孔,设不加任何药物的对照组,培养48h终止后,PBS洗2次,加入2 mL细胞裂解液(50 mmol/L tris·HCl(pH 8.0),20 mmol/L EDTA,2%SDS和0.01%(w/v)蛋白酶K),混匀,37℃水浴18 h后,再加入0.8 mL饱和NaCl溶液并37℃水浴5 min,经3 000 r/min离心1 h后,取上清液加入RNA酶(20 mg/L),37℃水浴15 min,用2倍体积无水乙醇-20℃过夜沉淀DNA,取2 μL在1.25%琼脂糖凝胶电泳。
1.2.4 Western blot分析MMPs表达 取对数生长期的786-О 细胞,调细胞数为 5 ×106/mL,分别加入 5、10、20、40 μmol/L不同浓度的姜黄素溶液,每个浓度3复孔,设不加任何药物的对照组,培养24 h。按分子克隆实验指南方法提取总蛋白,取10 μL样品稀释10倍后进行蛋白定量,并统一调整样品蛋白浓度为500 μg/mL,样品分装后-80℃保存备用。配胶,点样,电泳,转膜(半干法转移),封闭,结合一抗,结合二抗,显色:NBT/BCIP显色,5~30 min,肉眼观察出现特异性条带显蓝黑色,反应终止,用PBS终止反应。应用扫描软件进行数据分析处理。以鼠抗人β-actin(横纹肌纤维和细胞细丝的蛋白质组分)抗体作为一抗进行Western blot检测,作为判断结果的内参照。
2 结果
2.1 对细胞凋亡率的影响 流式细胞仪与TUNEL结果显示:四个不同剂量之间凋亡率有显著差异(P<0.01),见表1。
表1 不同浓度姜黄素对人肾癌786-О细胞凋亡率的影响(n=3,±s)

表1 不同浓度姜黄素对人肾癌786-О细胞凋亡率的影响(n=3,±s)
注:每个浓度组与前一个浓度组相比较,△P<0.05,△△P<0.01。
姜黄素含量/(μmol/L)凋亡率/%FCM TUNEL 0 6.52±0.42△△ 2.23±0.14△△10 8.46±0.45△△ 5.12±0.21△△20 10.21±0.50△△ 8.73±0.32△△40 12.37±0.55△△ 11.25±0.46 0.61±0.17 0.44±0.22 5△△
2.2 DNA片段琼脂糖凝胶电泳结果 DNA琼脂糖凝胶电泳分析,20 μmol/L和40 μmol/L的姜黄素溶液处理得786-О细胞后可见凋亡特征性的DNA梯形条带出现,随浓度升高而更加清晰。表明姜黄素可使得在786-О细胞的核小体连接处的DNA随机切断,形成寡聚核小体。
2.3 Western blot结果 蛋白电泳条带显示,随姜黄素浓度的逐渐增加,条带的灰度逐渐降低。用目的条带与内参照条带的比值代表目的蛋白的表达水平进行分析,MMP2及MMP9组中各组间比较,差异有统计学意义,见表2。
表2 不同浓度姜黄素作用人肾癌786-О细胞后目的条带与内参照条带比值(n=3,±s)
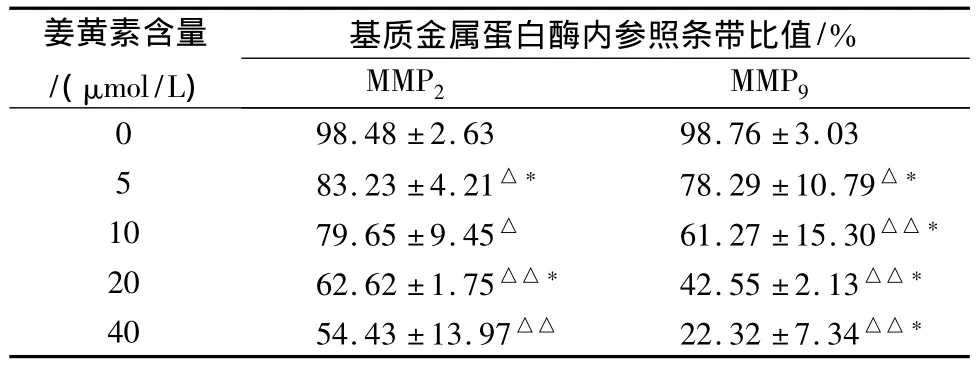
表2 不同浓度姜黄素作用人肾癌786-О细胞后目的条带与内参照条带比值(n=3,±s)
注:每个浓度组与对照浓度组相比较,△P<0.05,△△P<0.01;每个时间段与前一个时间段相比较,*P<0.05。
姜黄素含量/(μmol/L)基质金属蛋白酶内参照条带比值/%MMP2 MMP9 0 83.23±4.21△* 78.29±10.79△*10 79.65±9.45△ 61.27±15.30△△*20 62.62±1.75△△* 42.55±2.13△△*40 54.43±13.97△△ 22.32±7.34 98.48±2.63 98.76±3.03 5△△*
3 讨论
肾癌的主要治疗方法是外科手术,对化疗、放疗、激素治疗均不敏感。因此,探索新的治疗方法和开发低毒而疗效明显的药物已成为目前肾癌治疗领域研究的重点和热点。近年研究表明,姜黄素对 HL-60、K562、SGC-7901、Bel-7402、MGC-803等多种肿瘤细胞具有明显的抑制作用[9-11]。肿瘤的发生、发展与肿瘤细胞增殖失控和细胞凋亡减少有关,抑制肿瘤细胞增殖和诱导肿瘤细胞凋亡是药物治疗肿瘤最重要的机制之一[12]。本研究表明,姜黄素可诱导以人肾癌786-О细胞的凋亡,且呈浓度依赖性。DNA片段琼脂糖凝胶电泳结果表明姜黄素可使在786-О细胞的核小体连接处的DNA随机切断,形成寡聚核小体,诱导凋亡。
肿瘤的侵袭转移过程十分复杂,这一过程主要包括了肿瘤细胞之间、肿瘤细胞与宿主之间、肿瘤细胞与细胞外基质之间的相互作用。本实验中人肾癌786-O细胞在不同浓度姜黄素作用24 h后,蛋白电泳条带显示,随姜黄素浓度的逐渐增加,MMP2及MMP9条带的灰度逐渐降低。用目的条带与内参照条带的比值代表目的蛋白的表达水平进行分析,MMP9组中各组间比较,差异有统计学意义,姜黄素可以下调MMP9在人肾癌786-O细胞中的表达,且呈剂量反应关系。经比较分析,也可以看出在MMP2组中MMP2在人肾癌786-O细胞中的下调表达的趋势,且呈一定的剂量反应关系。由此可以得出初步结论,姜黄素可以下调基质蛋白酶MMP9及MMP2的表达,起到抗肿瘤侵袭的作用。姜黄素具有抑制肿瘤侵袭与转移作用,有可能成为一种具有临床应用价值的抗肿瘤侵袭与转移的药物。
[1]中国药典[S].一部.2005:186.
[2]盛柳青,严继忠,梁万根.姜黄素的研究进展及应用概况[J].中国西部科技,2006,(4):14.
[3]Siddiqui A M,Cui X,Wu R,et al.The anti-inflammatory effect of curcumin in an experimentalmodelofsepsis ismediated by upregulation of peroxisome proliferator-activated receptor-gamma[J].Crit Care Med,2006,34(7):1874-1882.
[4]Kowluru RA,Kanwar M.Effects of curcumin on retinal oxidative stress and inflammation in diabetes[J].Nutr Metab(Lond),2007,16(4):8.
[5]Punithavathi D,Venkatesan N,Babu M.Protective effects of curcumin against amiodarone-induced pulmonary fibrosis in rats[J].Br J Pharmacol,2003,139(7):1342-1350.
[6]Yuan H Y,Kuang S Y,Zheng X,et al.Curcumin inhibits cellular cholesterol accumulation by regulating SREBP-1/caveolin-1 signalingpathway in vascular smooth muscle cells[J].Acta Pharmacol Sin,2008,29(5):555-563.
[7]叶 翩,张淑玲.姜黄素抗HIV的分子机制研究进展[J].国际中医中药杂志,2006,28(4):199-202.
[8]那彦群.中国泌尿外科疾病诊断治疗指南[M].2006:84.
[9]钱 洁,刘 特,赖冬梅,等.姜黄素对HL-60细胞的增殖抑制与凋亡诱导的影响[J].中国生化药物杂志,2008,29(5):308-311.
[10]Long S,Argyle DJ,Nixon C,et al.Telomerase reverse transcrip tase(TERT)expression and proliferation in canine brain tumours[J].Neuropathol Appl Neurobiol,2006,32(6):662-673.
[11]Shammas M A,Koley H,Batchu R B,et al.Telomerase inhibition by siRNA causes senescence and apoptosis in Barrett’s adenocarcinoma cells:mechanism and therapeutic potential[J].Mol Cancer,2005,15(4):24.
[12]Aghdassi A,Phillips P,Dudeja V,et al.Heat shock protein 70 increases tumorigenicity and inhibits apoptosis in pancreatic adenocarcinoma[J].Cancer Res,2007,67(2):616-625.
