FITC标记胰岛素的合成、纯化及表征
李 铮 褚丽芸 郑爱萍*
(1 北京市药品审评中心,北京 100053;2 邯邢冶金矿山局总医院,河北 邯郸056005;3 军事医学科学院毒物药物研究所,北京 100850)
胰岛素(insulin,INS)是一种由51个氨基酸组成的蛋白多肽类药物,是目前临床治疗糖尿病最主要、最有效的药物。但由于胃酸的破坏、消化酶的降解以及难以跨越生物膜的机械屏障作用等使得该类药物口服无效,只能以注射的形式给药,且往往需要长期反复地频繁给药,为患者带来极大的不便,因此近十几年来开发口服给药系统的胰岛素纳米粒制剂已引起国内外药学工作者的广泛关注[1-3]。INS相对分子质量大(相对分子质量约5800),并且由于强亲水性而使其难以跨越脂质膜吸收,为了改善和提高水溶性药物的口服吸收利用度,口服吸收机制的研究非常重要,其中以Caco-2细胞为模型,结合激光共聚焦技术和流式细胞技术,开展药物口服吸收机制的研究是一种常用的途径[4-8]。本研究以异硫氰酸荧光素(fluorescein isothiocyanate,FITC)作为荧光探针设计合成了荧光标记的INS(FITC-INS),此标志物可用于激光共聚焦显微镜的观察或流式细胞仪的检测,以探讨INS跨膜转运的吸收机制。
1 材料与仪器
1.1 药品与试剂
胰岛素原料(27.8IU/mg,江苏万邦生化医药股份有限公司),血糖测定试剂盒(包括标准葡萄糖溶液,酶试剂RI,缓冲液RⅡ,北京中生生物工程高技术公司),SP-葡聚糖凝胶C-25(Pharmacia公司)、异硫氰酸荧光素(Sigma公司),水为超纯水,其他试剂均为分析纯。
1.2 仪器
质谱仪(MDS SCIEX QSTAR 美国ABI),荧光分光光度计(RF-5301日本岛津),冷冻干燥机(ALPH2-4,Christ德国),85-2恒温磁力加热搅拌器(上海国华企业),WH-2微型漩涡混合仪(上海沪西分析仪器厂),倒置显微镜(XDS-1B,重庆光电仪器总公司);高速台式离心机(TGL-16C,上海安亭科学仪器厂);BP211D电子天平(Sartorius)。
SD大鼠,体质量(250±20)g,雌雄兼有,军事医学科学院实验动物中心,动物质量合格证明编号:SCXK(军)2007-004。
2 实验方法
2.1 FITC-INS的标记及纯化[9]
2.1.1 FITC-INS的标记
称取胰岛素及FITC适量,使二者的摩尔比约为1∶3。胰岛素溶于pH 7.2的磷酸缓冲液(含0.2mmol/L EDTA,防止胰岛素聚集),浓度为20mg/mL;FITC溶解于1/10溶液体积的丙酮。将FITC溶液加入胰岛素溶液中,避光下置磁力搅拌器搅拌12h,所得产物为标记混合物,由标记产物FITC-insulin、未反应完全的胰岛素及剩余的游离FITC组成。
2.1.2 FITC-INS的纯化
采用葡聚糖凝胶对上述标记混合物进行分离。将溶胀好的Sephadex G-25装入玻璃柱,柱直径1.5cm,长20cm。柱床预先用pH7.2的0.01mol/L的磷酸盐缓冲液饱和,然后将反应液上样,每次1.0mL。用pH 7.2的0.01mol/L磷酸缓冲液洗脱,可见二条黄色条带,收集第一条黄色带的洗脱液。将洗脱液以醋酸调到pH 4.5,于4℃冷藏过夜,则FITC-INS形成沉淀,3500rpm离心15min,弃上清,沉淀以pH 4.5醋酸溶液洗涤,冻干,即得纯化的FITC-INS。
2.2 FITC-INS质谱鉴定
分别对样品游离INS和FITC-INS进行质谱分析,通过对比以鉴别INS是否连接上FITC分子。
2.3 FITC-INS活性鉴定
2.3.1 糖尿病大鼠模型的建立
取雄性健康SD大鼠实验前禁食24h,按40mg/kg剂量给大鼠尾静脉注射1%四氧嘧啶溶液,正常饲养48h,从眼静脉丛取血约0.5mL,3000rpm,离心15min。取血清20μL,葡糖氧化酶法测定血糖,选用血糖范围为13.89~16.67mmol/L大鼠为高血糖模型大鼠。
2.3.2 血糖值的测定
2.3.2.1 测定原理
葡萄糖氧化酶是一种需氧脱氢酶,能催化葡萄糖生成葡萄糖酸和过氧化氢,后者在过氧化物酶的作用下放出氧,使4-氨基安替吡啉与酚氧化缩合,生成红色醌亚胺染料,可在505nm比色测定。
2.3.2.2 样品的采集
正常大鼠15只,分为3组,实验前禁食12h,以乙醚麻醉后,皮下注射给予游离INS溶液(2IU/kg,阳性对照组)及FITC-INS溶液(2IU/kg),并设置生理盐水空白对照组。各组动物实验前24h禁食不禁水,自由活动,给药后于0、1、2、4、6、8、12、16、24h眼眶取血,离心得血清,测定血糖值。
2.3.2.3 样品处理及测定
将收集的血样于3000rpm离心10min,准确取血浆10μL,测定血糖值。按表1中所示加样混匀后,37℃水浴保温15min,505nm波长下测定各管的吸光度值(A),计算血糖含量(mg/dL)。

表1 测定血糖样品的制备
血糖含量(mg/dL)=A样品/A标准×C标准
血糖下降百分率(%)=(给药前血糖值-给药后血糖值)/给药前血糖值×100%。
2.3.2.4 数据处理
实验数据以mean±SD表示,各组间比较采用t检验。
3 结果与讨论
3.1 FITC-INS标记及纯化
FITC具有异硫氰基(-N=C=S),在适当的条件下,它与INS所含氨基酸的自由氨基(主要是赖氨酸的ε-氨基)结合,形成荧光色素-蛋白质结合物。由于FITC的异硫氰基以共价结合的方式连接到INS分子的氨基上,所以结合比较牢固而稳定。二者的投料比为3∶1,所得反应物为混合产物,由标记产物FITC-INS、游离INS及过剩FITC组成。
标记混合物在凝胶滤过色谱柱上呈现两条色带,即FITC-INS和过剩FITC,而游离INS不显色,由于凝胶滤过色谱柱的分子筛原理,洗脱的第一条色带为荧光标志物FITC-INS,洗脱的第二条色带为游离INS。收集第一条色带的洗脱物进行质谱鉴定。
3.2 FITC-INS质谱测定结果
FITC-INS质谱测定结果见图1,游离INS的质谱图见图2。从质谱图1和2分析,该物是一个混合物,由两个组分构成:其中一个相对分子质量为5778.1,另一个相对分子质量为6167.7。相对分子质量为5778.1的质谱峰代表INS分子,这与文献所报道的猪结晶胰岛素的数值5777.6几乎相等。与6167.7的差值为389.6,恰好是一个FITC分子的分子量(389),说明在INS分子上连接有1个FITC分子。
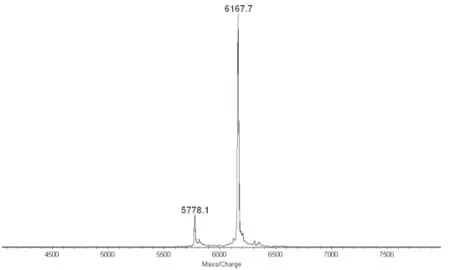
图1 FITC-INS质谱图
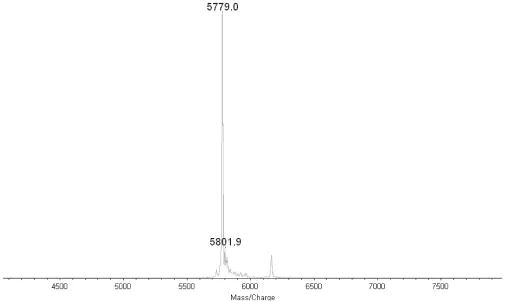
图2 INS质谱图
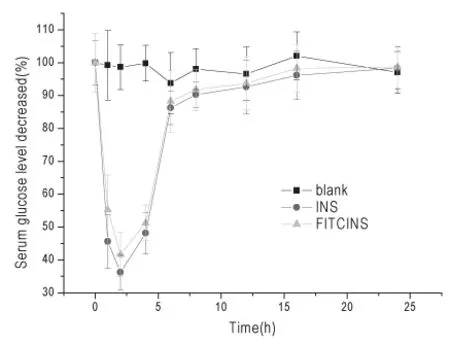
图3 糖尿病大鼠皮下注射荧光标志物FITC-INS的血糖降低值,以INS皮下注射为阳性对照组,生理盐水为空白对照组(mean±SD,n=5)
因为胰岛素分子中有3个游离氨基可以被FITC标记,所以在某些条件下会出现多种标记产物。为了尽量减少标志物对药物性质的影响,最好能获得只有一个氨基被标记的单一标志物,而且尽量保持胰岛素的活性。本研究在相关文献的调研基础上,经过反应条件的筛选,最终合成了单一FITC标记的荧光标志物。
3.3 FITC-INS活性鉴定
糖尿病模型大鼠皮下注射胰岛素荧光标志物后的血糖降低值如图3所示。
由图3可见皮下注射组(游离INS组和荧光标记FITC-INS组)与生理盐水空白组相比具有显著性差异(P<0.05)。此外,与游离INS皮下注射组相比,荧光标记FITC-INS组的降低血糖作用无显著性差异(P>0.05),表明了标志物FITC-INS保留了原药INS的生物活性。
皮下注射游离INS组和皮下注射FITC-INS组二者的达峰时间一致,皮下注射2h时,大鼠血糖降至最低值,游离INS组和FITC-INS组分别达到36.21%±5.31%、41.67±6.77%,二者之间无限制性差异。由图3可见,皮下注射6h后大鼠血糖逐渐恢复正常值。
[1] Sonaje K,Lin YH,Juang JH,et al.In vivo evaluation of safety and efficacy of self-assembled nanoparticles for oral insulin delivery[J].Biomaterials,2009,30(12): 2329-2339.
[2] Avadi MR,Sadeghi AMM,Mohammadpour N,et al.Preparation and characterization of insulin nanoparticles using chitosan and Arabic gum with ionic gelation method[J].Nanomedicine,2010,6(1):58-63.
[3] Sonaje K,Chen YJ,Chen HL,et al.Enteric-coated capsules filled with freeze-dried chitosan/poly(γ-glutamic acid) nanoparticles for oral insulin delivery[J].Biomaterials,2010,31(12): 3384-3394.
[4] Stephan AM,Ulrich FS,Stefan B,et al.Pharmacokinetics of amino acid ester prodrugs of acyclovir after oral administration: Interaction with the transporters on Caco-2 cells[J].Int J Pharm,2008,362(1/2):93-101.
[5] Suresh K,Ritesh J,Deep K,et al.Quantitative prediction of oral absorption of PEPT1 substrates based on in vitro uptake into Caco-2 cells[J].Int J Pharm,2008,354(1/2):104-110.
[6] Rikako S,Tomomi S,Yasuyuki T,et al.Novel oral absorption system containing polyamines and bile salts enhances drug transport via both transcellular and paracellular pathways across Caco-2 cell monolayers [J].Int J Pharm,2009,367(1/2):103-108.
[7] Fuyuki M,Koji T,Masateru M,et al.Development of a highthroughput in vitro assay using a novel Caco-2/rat hepatocyte system for the prediction of oral plasma area under the concentration versus time curve (AUC) in rats[J].J Pharm Toxic Meth,2006,53(3):215-218.
[8] Cheng KC,Li C,Hsieh YS,et al.Effect of oral contraceptives on the transport of chlorpromazine across the CACO-2 intestinal epithelial cell line[J].Eur J Pharm Biopharm,2003,56(2):159-165.
[9] Bromer WW,Sheehan SK,Rerns AW,et al.Preparation and properties of fluoresceinthiocarbamyl insulin[J].Biochemistry,1967,6(8):2378-2388.

