正交试验法优选连翘酯苷硅胶柱层析提取工艺
王科蕊,杨 骏,黄孝春,玄振玉*
(1.上海交通大学医学院附属第三人民医院药剂科,上海201900;2.上海卢湾区香山中医医院药剂科,上海200020;3.上海玉森新药开发有限公司研发部,上海201203)
连翘的药用价值日益引起重视,其有效成分主要是连翘苷、连翘酯苷、齐墩果酸、熊果酸、芦丁、木脂素和挥发油等。研究认为,连翘中真正具有抗菌功效的成分为连翘酯苷。连翘酯苷具有抗病毒、抗菌作用[1],抑制弹性蛋白酶[2]及抗氧化等多方面药理学活性。连翘酯苷为水溶性成分,其富集纯化主要采用有机溶剂萃取法和大孔树脂吸附法。有机溶剂萃取法多以正丁醇作为提取剂,由于正丁醇的价格高而且浓缩困难,工业生产时成本太高,很难大规模应用。大孔树脂吸附法纯化得到的样品含有多种成分,纯度达不到要求。为得到纯度更高的连翘酯苷,本研究采用正交试验法优选出硅胶柱层析提取连翘酯苷的最佳提取工艺。
1 材 料
1.1 仪器 1100型HPLC仪,G1314VWD检测器,Agilent色谱工作站(美国Agilent公司);Mettler Toledo AX天平[梅特勒-托利多仪器(上海)有限公司];KQ600B超声仪(上海慧杰科技发展有限公司);RE2000旋转蒸发仪(上海亚荣生化仪器厂);恒温水浴锅(湖北省黄石市恒丰医疗器械有限公司);ZKD-4025A真空干燥箱(上海智城分析仪器制造有限公司)。
1.2 药材和试剂 连翘叶(购自河南省卢氏县中药材公司,批号20050802),经上海中医药大学教学实验中心可燕副研究员鉴定为木樨科植物连翘[Forsythia suspensa(Thunb.)Vahl]的干燥叶子;连翘酯苷对照品(纯度98.1%,上海诗丹德生物技术有限公司,批号11/080522);甲醇(色谱纯,美国Tedia公司);冰乙酸、乙酸乙醇、丙酮、乙醇(分析纯,国药集团化学试剂有限公司);纯净水(杭州娃哈哈集团有限公司);柱层析硅胶(100~200目,上海满贤经贸有限公司);AB-8大孔吸附树脂(天津南开大学化工厂)。
2 方法和结果
2.1 溶液的配制 (1)对照品溶液:精密称取干燥至恒重的连翘酯苷对照品适量,加50%甲醇水溶液制成约含连翘酯苷0.02mg/ml的溶液。(2)供试品溶液:精密称定约50mg待测样品,置50ml量瓶中,以50%甲醇水溶液溶解并定容至刻度,摇匀。精密量取1ml置50ml量瓶中,加50%甲醇水溶液稀释至刻度,摇匀,用0.22μm微孔滤膜滤过,取续滤液,即得[3]。
2.2 色谱条件 色谱柱:ODS-C18色谱柱(250mm×4.6mm,5μm);流动相:甲醇∶水∶冰乙酸(33∶67∶0.2);检测波长:332nm;流速:1.0ml/min;柱温:30℃;进样量:20μl。取对照品和供试品溶液进样,得到色谱图见图1。理论塔板数按连翘酯苷峰计算应不低于8 000[4]。
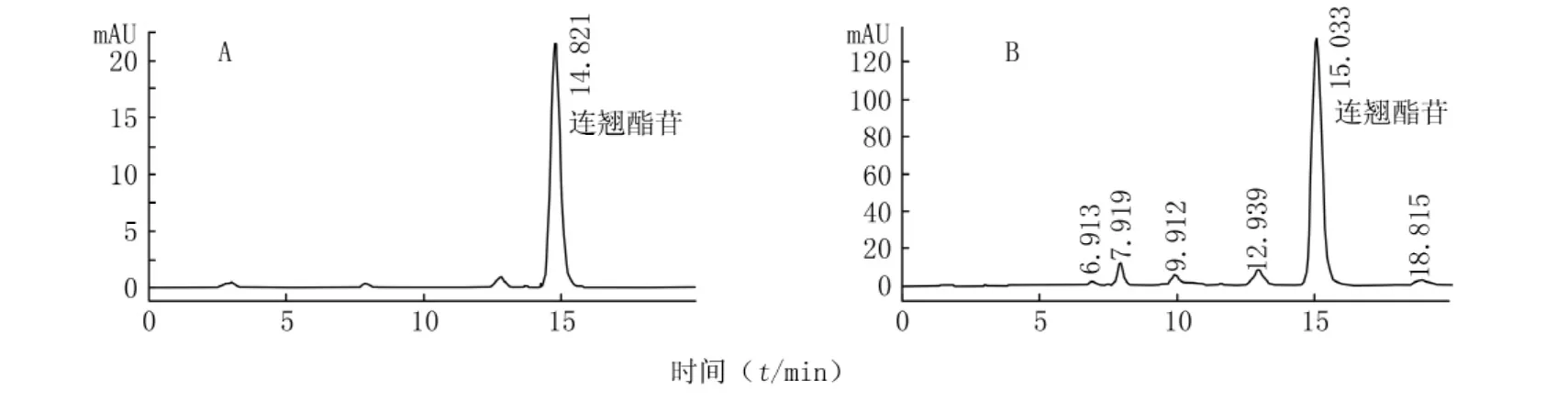
图1 连翘酯苷的HPLC谱图Figure 1 HPLC photograms of forsythiaside
2.3 浸膏的制备 取连翘叶200g,加入16倍量(v/w)去离子水,温浸法(60℃)提取3次,每次1h。合并水提液,滤过,在60℃时减压浓缩至含生药2.0g/ml,相对密度为1.20~1.25的浓缩液,3 773 g离心30min。将上清液放冷后,上AB-8大孔吸附树脂。树脂用量为药材重量的1倍,柱床径高比为1∶10,控制吸附流速为0.25BV/h,洗脱时先用水以6BV/h的流速进行除杂,继用60%乙醇水溶液以流速4.0BV/h洗脱。收集洗脱液,减压浓缩,真空干燥,得干浸膏。
2.4 硅胶柱层析工艺的优化 大孔吸附树脂纯化后得到的干浸膏中仍含有多种成分,用100~200目的层析用硅胶进一步纯化。纯化过程中,上样量、洗脱液流速、柱床径高比等因素均会对纯化效率产生影响。本研究采用3因素3水平[L9(34)]正交试验,考察上述3个因素对纯化效果的影响。正交试验的因素和水平设计见表1[5]。
按照正交试验水平表安排试验,取适量干浸膏(连翘酯苷含量为31.9%),用乙醇溶解后拌入2倍量100~200目硅胶,挥干溶剂后,取适量的100~200目硅胶,干法装柱,干法上样,用乙酸乙酯-丙酮-水(8∶2∶0.5)溶液洗脱,用恒流泵控制洗脱液流速,以薄层色谱法(TLC)检测目标流份。收集目标流份,减压浓缩,干燥,测定干浸膏得量和浸膏中连翘酯苷的百分含量。连翘酯苷得率=[(干浸膏得量×干浸膏中连翘酯苷百分含量)/(上样量× 31.9%)]×100%。以连翘酯苷的得率为评价指标,考察各因素对提取效率的影响。正交试验的设计及结果见表2,方差分析结果见表3。

表1 正交试验的因素和水平表Table 1 Factors and levels of the orthogonal test
由表3可见,三种因素对提取率的影响从大到小依次为:C>A>B,最优组合为A3B2C3,即上样量为1∶50,洗脱液流速为1.0BV/h,柱床径高比为1∶10。由于上样量为1∶50和1∶20时实验结果差别较小,从节约成本角度考虑,确定样品和硅胶用量比为1∶20。B因素对实验结果影响较小,为了缩短生产周期,确定洗脱液流速为1.5BV/h。综合以上直观和方差分析结果,确定硅胶柱层析纯化连翘酯苷样品的最佳工艺为:样品与硅胶用量比为1∶20,洗脱液流速为1.5BV/h,柱床径高比为1∶10。2.5 验证实验 为了验证最佳提取工艺的可行性与合理性,按照上述A2B3C3工艺进行3次验证实验。每次提取连翘叶药材150g,分离纯化得到干浸膏5.8g,其中连翘酯苷的含量占(68.73±3.67)%(n=3)。结果表明,采用最佳工艺纯化大孔树脂提取的浸膏,连翘酯苷在浸膏中含量大幅提高,而且洗脱物得率以及连翘酯苷含量稳定,表明本工艺可行,效果理想。
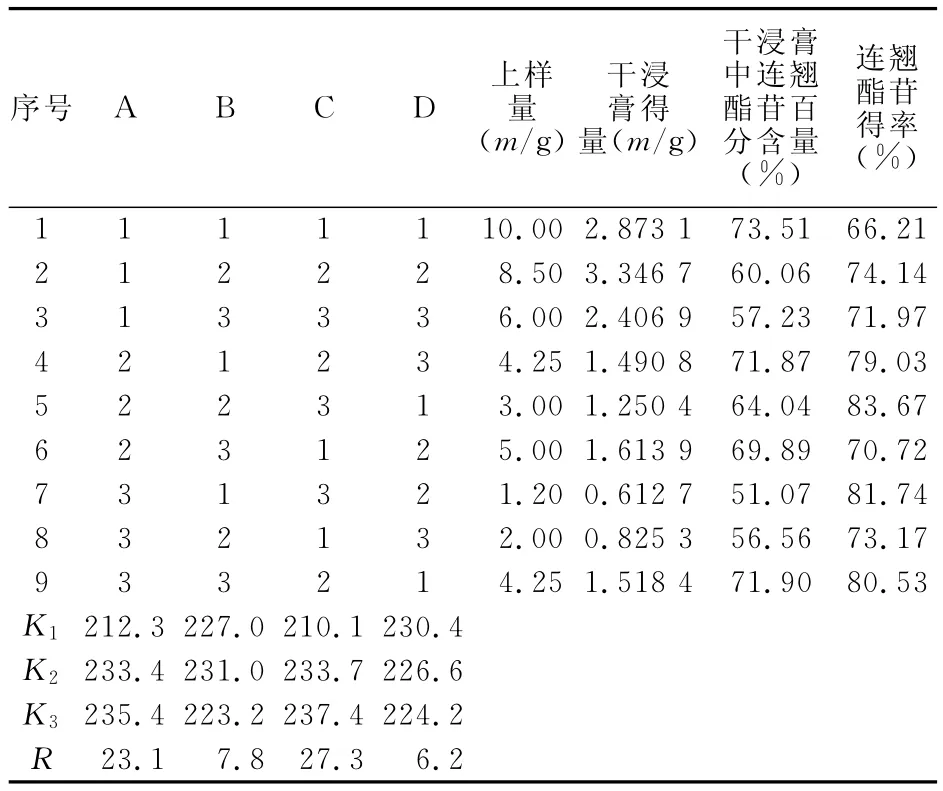
表2 正交试验设计及结果Table 2 Design and results of the orthogonal test

表3 方差分析结果Table 3 The results of variance analysis
3 讨 论
经大孔树脂纯化后的连翘叶提取物仍然含有多种成分,其中连翘酯苷的含量约为30%,需进一步纯化。连翘酯苷常温下为浅黄色无定型粉末,作者试用了甲醇、乙醇、丙酮等溶剂及甲醇-水、丙酮-水混合溶剂重结晶,均不能得到固定晶型,因此不能以常用的重结晶方法对其进行纯化。另外,连翘酯苷在酸、碱条件下均易发生水解,因此也不能通过衍生化成盐的方式进行重结晶纯化。用硅胶柱层析对天然单体成分进行纯化是实验室及工业生产中常用的方法,因此本研究对大孔树脂纯化后的连翘提取物用硅胶柱层析进一步纯化,确定了最优提取工艺条件。在该条件下,得到连翘叶提取物中连翘酯苷的纯度大幅度提高,可达到65%以上。
[1] 张立伟,赵春贵,王进东,等.连翘酯甙分离提取及抑制弹性蛋白酶活性研究[J].化学研究与应用,2002,14(2):219-221.
Zhang LiWei,Zhao ChunGui,Wang JinDong,et al.Study of separation,extaction and inhibiton of elastase activity of forsythiaside[J].Chem Res Appl,2004,14(2):219-221.Chinese.
[2] 杨建雄,柴渭莉,邱 娟,等.连翘叶中苷类成分的分离与HPLC鉴定[J].中成药,2007,29(7):1086-1087.
Yang JianXiong,Chai WeiLi,Qiu Juan,et al.Seperation and determination of glucosides in leaves of Forsythia suspensa by HPLC method[J].Chin Tradit Patent Med,2007,29(7):1086-1087.Chinese.
[3] 方翠芬,靖 会,李教社,等.HPLC法测定市售连翘中连翘酯苷的含量[J].中国药事,2003,17(12):760-761.
Fang CuiFen,Jing Hui,Li JiaoShe,et al.Determination of forsythoside A in merchant Forsythia suspensa by HPLC[J].Chin Pharm Aff,2003,17(12):760-761.Chinese with abstract in English.
[4] 张 炜,张汉明,郭美丽,等.HPLC法测定感冒退热颗粒(冲剂)中连翘酯苷A的含量[J].中草药,1999,30(4):268-270.
Zhang Wei,Zhang HanMing,Guo MeiLi,et al.Determination of the content of forsythiaside A in Ganmaotuire granules by HPLC method[J].Chin Tradit Herb Drug,1999,30(4):268-270.Chinese.
[5] 任延久,林秋梅,康 莉,等.连翘的提取工艺及有效成分的研究[J].黑龙江医药,1995,8(6):308-310.
Ren YanJiu,Lin QiuMei,Kang Li,et al.Research on the extraction and active components of Forsythia suspensa[J].Heilongjiang Med J,1995,8(6):308-310.Chinese.

