COX-2诱饵载体的构建及其在酵母双杂交系统中自激活作用的检测
贺凌婕 张澍田 朱圣韬
(1.首都医科大学附属北京友谊医院急诊科;2.首都医科大学附属北京友谊医院消化内科,北京市消化疾病中心)
环氧化酶-2(cyclooxygenase-2,COX-2)是细胞受到各种刺激时迅速合成的一种酶,以前被认为是炎性反应的一个主要标志,近年来医学界发现它参与多种肿瘤的发生和发展,因此也被认为是癌症病情的指标。近年来有研究[1-3]表明,在食管鳞癌和食管腺癌中都发现COX-2表达增加。利用RT-PCR、Western blotting、原位杂交技术等方法均证实COX-2在食管癌组织中的阳性表达率明显高于相对应的癌旁组织及正常组织[4],张强等[5]用原位杂交技术检测患者食管癌组织中COX-2mRNA的表达,发现食管癌组织中COX-2 mRNA阳性表达率为 80%,明显高于正常食管黏膜。Takatori H等[6]对手术切除的 228例食管鳞癌组织切片用免疫组织化学技术进行分析,发现 COX-2阳性表达率为91%,且和肿瘤浸润深度、临床分期以及生存率等临床病理特征密切相关。在食管癌中,随着肿瘤浸润深度的增加、鳞癌分化程度的减低,COX-2的表达亦相应增强[7]。此外,COX-2在食管癌前病变中也呈过表达,如鳞状上皮发育不良和 Barrett’s食管[8-9]。Ling F C等[10]发现,COX-2在食管炎-Barrett’s食管-食管癌的发展过程中表达逐渐增高。这些研究都表明 COX-2可能与食管癌的发病相关。为进一步了解 COX-2的功能、作用机制和相互作用蛋白,我们拟采用酵母双杂交系统进行研究,构建诱饵载体 pG BKT7-COX-2,并转化酵母菌 Y190,观察其是否具有自激活作用。
1 材料和方法
1.1 材料
COX-2质粒由美国密歇根大学的 W illiam Smith教授惠赠,酵母菌 (Saccharom yces cerevisiae)Y190、质粒 pGBKT7、pGADT7,对照质粒 pGBKT7-lam、pGBKT7-53、YEAST MAKER Yeast Transformation System、YEAST MAKER Yeast Plas mid Isolation kit,以及酵母菌培养基和 X-Gal等,均购自 Clontech公司。DNA重组的各种限制性内切酶及 PCR反应系统的 LA Taq DNA聚合酶、dNTP、10×buffer缓冲液等购自 TaKaRa公司。大肠杆菌 DH5α为本室保存。其他试剂均为国产分析纯。
1.2 方法
1)做 PCR扩增 COX-2质粒:将 COX-2质粒转化DH5α感受态细胞,挑取单克隆作为 PCR反应模板,用PCR的方法扩增出目的基因。引物设计如下:COX-2 F 5′-GG A ATT CAT GCT CGC CCG CGC CCT-3′;COX-2 R 5′-CGG G AT CCC TAC AGT TCA GTC GAA CGT TCT TTTAGT AGT ACT G-3′,分别在 5′端引入酶切位点EcoRⅠ和 BamHⅠ。反应总体积为 50μL,其中包括:COX-2 F 0.5μL,COX-2 R 0.5μL,2×bufferⅠ25μL, dNTP 5μL,COX-2 1μL,LA Tag E 0.5μL,ddH2O 18 μL,反应程序为:94℃预变性 5 min,94℃变性 30 s, 68℃退火30 s,72℃延伸 90 s,循环30次 ,最后72℃10 min。将获得的 PCR产物电泳,切胶回收,连接 T-easy载体,将连接产物转化DH5α感受态细胞,进行蓝白斑筛选,取白色菌斑摇菌、提质粒。质粒测序正确后,用 EcoRⅠ和BamHⅠ酶切 COX-2-T-easy质粒,将酶切产物电泳鉴定后切胶回收,保存备用。
2)构建 pGBKT7-COX-2诱饵载体:设计 20μL体系,用 EcoRⅠ和 BamHⅠ酶切载体 pGBKT7,用 T4 DNA连接酶连接 pGBKT7酶切质粒及 COX-2酶切产物,4℃过夜。将连接产物转化DH5α感受态细胞,涂布于卡那抗性 LB琼脂板上,倒置于 37℃恒温箱过夜。挑取生长出的阳性克隆作为 PCR反应的模板,以COX-2 F、COX-2 R作为引物,将连接产物菌斑做鉴定 PCR。将 PCR鉴定后的阳性克隆菌斑摇菌、提质粒,将所得质粒进行电泳鉴定及酶切鉴定。
3)制备酵母感受态:将酵母菌 Y190菌种划线接种于 YPD平板上,30℃孵育 2~3 d后,沿划线长出白色克隆。挑取单个酵母菌菌落,接种于 5 mL YPD液体培养基中,充分振荡之后加 YPD液体培养基至40 mL,30℃320 r/min震荡培养 16~18 h。取摇菌后的酵母菌液适量,加至 10 mL YPD液体培养基中, 30℃320 r/min培养 3 h。将培养后的菌液 1 000 r/ min离心 5 min,弃上清,用适量 TE/LiAC溶解沉淀。再次离心、弃上清,用 TE/LiAC溶解沉淀后,再离心,取沉淀,用 TE/LiAC将沉淀悬起至 200μL,即成为酵母感受态细胞。
4)将 pGBKT7-COX-2连接产物转化酵母感受态:将鲑精DNA加热使之变性,取30μL变性鲑精DNA分装于 3个微量离心管中,分别加入已构建好的“诱饵”质粒 pG BKT7-COX-2、阳性对照质粒 PG BKT7-53+ PG ADT7-T(53+T)、阴性对照质粒 PGBKT7-lam+ PG ADT7-T(lam+T),每管中加入 100μL酵母感受态细胞,轻摇后,各加入 600μL PEG/LiAC混合液,轻柔振荡 10 s,于 30℃,200~250 r/min振荡培养 30 min。之后于每管中加入 70μL DMSO,轻柔混匀,42℃水浴热击 15 min,冰浴 1~2 min。14 000 r/min离心 5 min后弃上清,用 500μL ddH2O将沉淀重悬。取 100μL pG BKT7-COX-2菌液涂布于营养缺陷平板 SD/-Trp上,取 53+T、lam+T菌液分别涂布于 SD/-Trp/-Leu板上,倒置放入 30℃孵箱中,培养 1~2 d。
5)pGBKT7-COX-2自激活检测(检测β半乳糖苷酶活性):待 3个平板长出阳性克隆后,挑取含有阳性对照质粒、阴性对照质粒和重组质粒的 Y190酵母菌落,将其印迹到无菌的滤纸上。将滤纸上菌落经液氮冻融 3次,使菌体充分破裂。将经液氮冻融的滤纸菌落面朝上置于被 Z buffer/X-gal浸透的另一张滤纸上,30℃放置。前2 h内每隔 30 min观察菌斑是否变蓝,之后第 4 h、第 6 h、第 8 h、第 12 h和第 24 h再次观察菌斑颜色。
2 结果
做 PCR扩增COX-2质粒,将获得的 PCR产物于1%的琼脂糖凝胶上电泳,在 1 800 bp处有一明亮的条带,与 COX-2的大小一致(图 1)。
COX-2质粒测序后与www.NCB I.com网上 COX-2基因比对,符合率为 99%(图 2),提示 COX-2基因扩增正确。
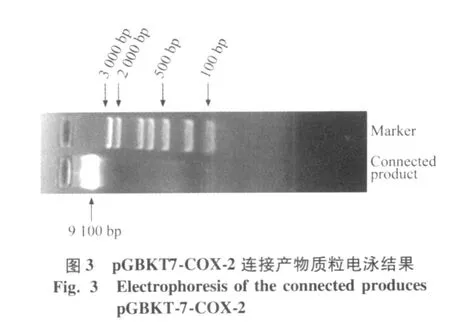
将测序正确的 COX-2基因与载体 pGBKT7连接,构建诱饵载体 pGBKT7-COX-2,将连接产物转化DH 5α感受态细胞,摇菌提取质粒,电泳鉴定,可见大小约9 100 bp左右的pG BKT7-COX-2连接产物(图3)。
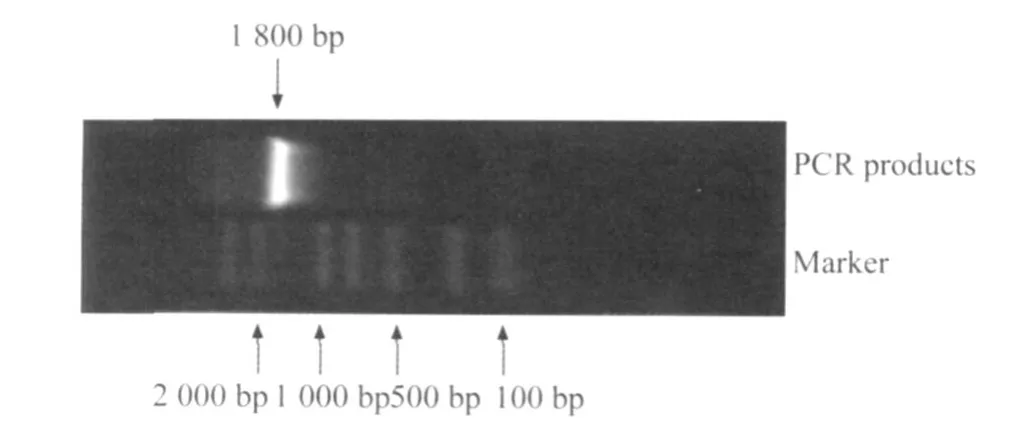
图1 COX-2扩增产物电泳结果Fig.1 Electropho resis of COX-2 amplified p roducts
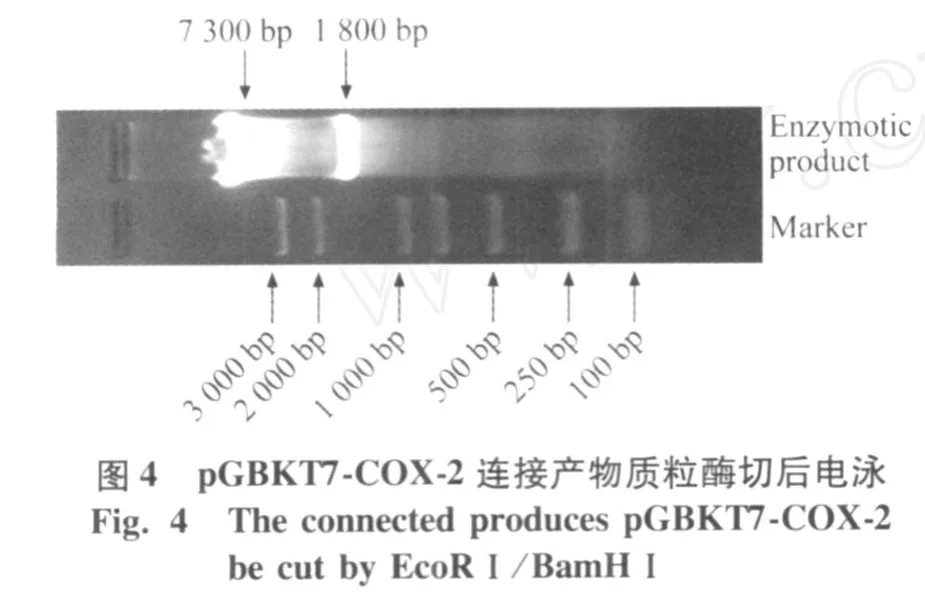
用 EcoRⅠ和 BamHⅠ进行酶切鉴定,可见 1 800 bp左右的 COX-2质粒与 73 000 bp的 pGBKT7(图4),鉴定正确,正确构建了诱饵载体 pGBKT7-COX-2。

图2 COX-2基因网上比对结果Fig.2 Result of the COX-2 gene online comparison
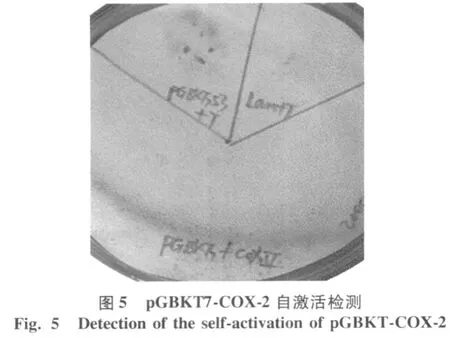
用pGBKT7-COX-2转化酵母菌 Y190,涂布于 SD/ -Trp平板上,并将 53+T、lam+T分别作为阳性和阴性对照,转化酵母菌 Y190,涂布于 SD/-Trp/-Leu板上,30℃培养2 d后,可见3个平板长出阳性克隆,挑取含有阳性对照质粒、阴性对照质粒和重组质粒的Y190酵母菌落,将其印迹到无菌的滤纸上。用液氮冻融 3次,使菌体充分破裂,将经液氮冻融的滤纸菌落面朝上置于被 Z buffer/X-gal浸透的另一张滤纸上,30℃放置。观察 24 h,可见阳性对照 53+T菌斑显蓝色,阴性对照 lam+T及 pGBKT7-COX-2菌斑未变色(图5)。
3 讨论
酵母双杂交系统 (yeast two hybrid system)是Fields S等[11]提出并建立的一种直接于细胞内检测蛋白-蛋白之间相互作用的遗传学方法,其最突出的特点是能够在酵母这种繁殖迅速、遗传背景清楚且操作简便的体系中研究真核细胞的蛋白质之间的相互作用,并通过cDNA文库的筛选可以直接找到与未知蛋白质相互作用的 DNA序列[12];此外,利用酵母双杂交技术可确定蛋白间的相互作用位点及结构域。但是,由于某些蛋白本身具有激活转录功能或在酵母中表达时发挥转录激活作用,酵母双杂交系统的一个重要的问题是“假阳性”。在应用酵母双杂交系统进行筛选 cDNA文库之前,首先要排除“诱饵”蛋白的自激活作用,否则过多的假阳性克隆将严重影响实验结果的准确性,使后续的分析工作量大大增加。
本实验成功构建了 pGBKT7-COX-2诱饵载体,并检测了其自激活作用。结果表明,构建的 pGBKT7-COX-2诱饵载体对报告基因 lacZ无自激活作用,为下一步筛选 cDNA文库实验奠定了基础,也为阐明食管鳞癌发病机制提供了线索。
[1] Z immer mann K C,SarbiaM,WeberA A,et al.Cyclooxygenase-2 expression in human esophageal carcinoma[J]. Cancer Res,1999,59:198-204.
[2] W ilson K T,Fu S,Ramanujam K S,et al.Increased expression of inducible nitric oxide synthase and cyclooxygenase-2 in Barrett’s esophagus and associated adenocarcinomas[J].Cancer Res,1998,58:2929-2934.
[3] RistimakiA,Honkanen N,Jankala H,et al.Expression of cyclooxygenase-2 in human gastric carcinoma[J].Cancer Res,1997,57:1276-1280.
[4] Zhi H Y,WangL,Zhang J,et al.Significance of COX-2 expression in human esophageal squamous cell carcinoma [J].Carcinogenesis,2006,27:1214-1221.
[5] 张强,穆玉恕,王宗福,等.COX-2 mRNA表达与食管癌发生发展关系的研究[J].中华肿瘤防治杂志,2008,15:178-179.
[6] Takatori H,Natsugoe S,Okumura H,et al.Cyclooxygenase-2 expression is related to prognosis in patients with esophageal squamous cell carcinoma[J].Eur J Surg Oncol, 2008,34:397-402.
[7] 于钟,袁宇红,詹俊,等.食管癌中 COX-2表达与其临床病理特征及预后的关系 [J].中国病理生理杂志,2006, 22:2216.
[8] KaurB S,Khamnehei N,IravaniM,et al.Rofecoxib inhibits cyclooxygenase-2 expression and activity and reduces cell proliferation in Barrett’s esophagus[J].Gastroenterology,2002,123:60-67.
[9] Shamma A,Yamamoto H,Doki Y,et al.Up-regulation of cyclooxygenase-2 in squamous carcinogenesis of the esophagus[J].Clin Cancer Res,2000,6:1229-1238.
[10]Ling F C,Baldus S E,Khochfar J,et al.Association of COX-2 expression with corresponding active and chronic inflammatory reactions inBarrett’smetaplasia and progression to cancer[J].Histopathology,2007,50:203-209.
[11]Fields S,SongO.A novel genetic system to detect proteinprotein inter-actions[J].Nature,1989,340:245-246.
[12]徐东刚,王嘉玺.酵母双杂交系统的应用研究进展.国外医学[J].临床生物化学与检验学分册,2001,22:281-282.

