2型糖尿病患者并发糖尿病视网膜并发症多重危险因素分析*
张新焕 宋 晓 陈圆圆 邓仰欣
(泰山医学院临床学院,山东 泰安 271000)
糖尿病视网膜病(diabetic retinopathy, DR)是糖尿病患者最常见,最严重的微血管并发症,已成为西方国家成人致盲的首要原因,在我国,发病15年后糖尿病患者并发视网膜病变的比率可高达75%~80%, DR的病因和发病机制至今尚未完全阐明,大规模流行病学的调查研究认为,DM长期代谢控制不良是DR发生发展的主要危险因素。本研究采用大样本病例-对照研究,探讨了促进糖尿病视网膜病变发生的可能危险因素,为尽早干预DR发生的可控危险因素,提高DR防治水平提供了理论基础。
1 材料与方法
1.1材料 按 1999 年 WHO[1]提出的 DM诊断和排除标准及其分型标准,随机选择无亲缘关系的2型糖尿病患者274例(男136例,女138例)分为3组:单纯糖尿病 (DM)组:无眼底病变及其他微血管并发症患者92例入选(男44例,女48例),平均年龄(61.55±10.40)岁,病程(9.61±4.48)年,根据眼科会诊及眼底镜检查眼底改变筛选出视网膜病变(diabetic retinopathy ,DR)组182例入选(男92例,女90例),平均年龄(60.88±11.36)岁,病程(9.69±4.59)年。健康对照组(NC):选择同期在泰山医学院附属医院体检的健康个体120例(男56例,女64例),平均年龄(59.65±8.93 )岁。据 WHO的 DM诊断和排除标准及其分型标准,所有入选对象均为中国汉族人,彼此间无血缘关系,无脑梗死,冠心病,心功能不全病史,无慢性肾功能不全及慢性肺脏疾病史。
1.2临床资料收集及生化指标检测 所有受试对象均经 12h 空腹后使用校正的身高体重仪测量身高、体重,受试对象脱鞋,穿单衣测量,并计算体重指数(Body mass index ,BMI = 体重(kg) / 身高(m2));在受试者安静状态下,取坐位连续3次测量其右上臂血压值,取平均值。空腹抽取肘静脉血。采用葡萄糖氧化酶法测空腹血糖(草酸钾氧化钠抗凝:2 mg/ml血液);全自动生化分析仪测血脂、肝功、肾功、电解质;低压液相层析柱法测糖化血红蛋白(Glycohemoglobin, HbA1c)(Ethylenediamine tetraacetic acid , EDTA抗凝全血,EDTA:血量=1.5 mg/ml);ELISA法检测血清中VECF的水平(试剂盒购自武汉博士德生物工程有限公司。化学发光法测定UAER,3到6个月内连续 3 次检测尿微量白蛋白排泄率取平均值,同时排除其他急慢性肾病和运动、感染、发热、充血性心衰、高血压、脓尿和血尿对尿蛋白的影响;由专科眼科医师行眼底镜或眼底荧光素造影检查,根据1985年第三届全国眼科学术会议通过的《糖尿病视网膜病变分期标准草案》[2]诊断。
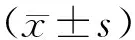
2 结 果
2.1各病例组间临床及生化指标的比较 NC组、DM组及DPN组之间的性别构成比、年龄、血压、BMI无统计学差异(P>0.05),DM组与DR组病程和血压水平无显著差异(P>0.05);而血糖、HbA1c、TC、TG,VEGF和HCY水平DM和DR组显著高于NC组(P<0.05),DR组显著高于DM组(P<0.05);而空腹C肽(FCP)和餐后C肽(PCP)水平DR组显著低于DM组和NC组(P<0.05),DM组显著低于NC组(P<0.05)。伴发肾脏病变的比率DR组(64.17%)显著高于DM组(38.64%)(χ2=15.342,P<0.05),糖尿病家族史比率DR组(17.89%)显著高于单纯组糖尿病 (3.26%),(χ2=7.568,P<0.05)。(见表1)。
2.2糖尿病视网膜病变发病的多重危险因素分析 以有无 DR 为因变量,选择糖尿病视网膜病变可能的危险因素先进行单因素Logistic 回归分析,分别研究各种生化及临床指标对 DR发病的影响,结果显示HbA1c、TC、LDL-C、VEGF水平,伴发肾脏病变与 2型糖尿病视网膜病变成正相关,为了去除交互作用的影响,筛选出影响DR发病最有意义的指标,进行多个因素对DR发生危险性的综合估计,我们采用forward conditional逐步回归法将单因素回归有意义的变量逐个引入多因素条件Logistic 回归方程,结果显示: HbA1c,LDL-C、TC、合并肾脏病变、VEGF水平进入回归方程,OR值均大于1(见表 2)。多因素综合估计DR发生危险度的公式如下:Logistic回归预测DR发病风险的方程为:
P=1/[1+
e-(-8.825+0.316*A+0.589*B+0.602*C+0.398*D +1.496*E)]
(方程中A代表HbA1c、B代表LDL-C、C代表肾脏病变、D代表TC 、E代表VEGF)(见表2)。
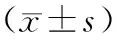
表1 不同病例组间临床及生化指标的比较
与NC组相比, Compared to NC genotype,aP<0.05,bP<0.01;与DM组相比,ComparedtoDMgenotype,cP<0.05,dP<0.01.
(Duration:病程; FBG , Fasting blood glucose: 空腹血糖;PBG , Postprandial blood glucose:餐后2小时血糖;HbA1c , Glycohemoglobin: 糖化血红蛋白;BMI , Bodymass index: 体重指数;TC ,Total cholesterol :总胆固醇;TG , Triglyceride:甘油三酯;HDL-c , High-density lipoprotein cholesterol:高密度脂蛋白胆固醇;LDL-c , Low density lipoprotein cholesterol:低密度脂蛋白胆固醇;SBP ,Systolic blood pressure :收缩压;DBP , Diastolic blood pressure: 舒张压;FCP , Fasting c-peptide:空腹C肽;PCP , Postprandial c-peptide:餐后C肽;VEGF,Vascular endothelial growth factor:血管内皮生长因子)

表2 糖尿病视网膜病变各危险因素的Logistic回归分析结果
(β:回归系数,Regression coefficient;SE:Standard deviation,标准差;CI:The 95% confidence interval,95%的置信区间)
3 讨 论
3.1糖、脂代谢紊乱与糖尿病视网膜病变的关系 多元回归显示:代表血糖控制情况的HbA1c与DR成正相关,提示高糖可能是DR发生发展中的一个重要危险因素。虽然本研究中血糖的差异不明显,而HbA1c在两组间的差异是显著的,可能与我们的样本量不够大有关,HbA1c更能代表一种长期的血糖控制水平,而DR的发生同样是一个漫长的过程。动物实验及体外培养研究发现:高血糖可激活脏器局部内分泌激素(或细胞因子),如血管紧张素及其受体以及NO、内皮素、血管内皮生长因子的表达均可增加,这些激素水平的增加加重了脏器局部的血流动力学紊乱,促进了DR的发生发展;此外,在高糖作用下,多元醇代谢旁路的激活,红细胞携氧功能障碍,以及糖基化终产物作用下诱发的基因表达异常也参与了DR的进展[3],以上的研究与本研究结果是相符的。本研究还发现:TC、LDL-C等代表脂代谢紊乱的指标与DR发生呈正相关。且多元回归进入回归方程,提示高脂血症可能是糖尿病视网膜病的独立危险因素。以往的研究认为,高脂血症可能促进了DN的发生与发展,其机制可能为:高血脂可通过影响凝血及纤溶系统的活性,产生大量的脂质氧化物,沉积于血管内皮,造成内皮细胞的破坏,加速了动脉硬化等机制[4],与本研究结果是一致的,因此,加强血脂控制不仅可以减少糖尿病大血管病变,也可以减少糖尿病视网膜病变的发生率。
3.2糖尿病视网膜病变与细胞因子VEGF的关系 以往的研究表明许多生长因子参与了新生血管的形成, 本研究针对近年讨论较多的VEGF与视网膜病变的关系进行了研究, VEGF具有促进内皮细胞增殖,增加血管通透性,诱导血管生成等多种生理功能。国内外已有一些实验证明在增殖型糖尿病视网膜病变的玻璃体、视网膜中VEGF的含量和表达是增加的,提示VEGF在增殖型糖尿病视网膜病变中有重要作用。众多的体内体外研究发现VEGF高表达与DR发病危险呈正相关[5,6],和我们的研究是一致的。
3.3眼底病变与糖尿病肾病的关系 本研究中发现:DR与DN有显著统计学关联,说明二者在发病机制上具有相通性,这与大量前人的研究结果是一致的。Gilbert RE[7]的研究认为:二者同属糖尿病微血管病变,具有相似的发病机理,糖尿病肾病可通过血压、纤维蛋白原和脂蛋白的升高加速糖尿病视网膜病变的进展,如果终末期肾病患者接受肾移植而不是透析治疗,视力的预后较好[8]。Jensen T[9]的研究发现:并发早期肾病的糖尿病患者增殖性视网膜病变的年发生率是10%~15%,而在无肾病的人群中糖尿病视网膜病变发生率仅1%, 临床上,眼底改变轻者,糖尿病肾病亦轻,有增殖性视网膜病变者,其肾病也重。糖尿病患者无论存在单纯型或增殖型视网膜病变,肾血流速度、肾脏排泄和肾小球滤过率均较眼底正常的糖尿病患者明显降低, Klein R[10]的研究发现在出现明显蛋白尿之前,肾小球基底膜厚度与糖尿病视网膜病变程度呈正相关。提示糖尿病视网膜病变患者易于并发糖尿病肾病,二者密切相关,对有糖尿病肾病的患者均应列为视网膜病变的高危患者。
总之,DR是一种多基因遗传异质性疾病,高血糖及代谢紊论是最重要的始动因素,提示我们及早改善 DM 时引起的高血糖,高血脂和贫血缺氧状态,有可能减少一些有害因子的表达水平,降低 DR 发生的危险参考文献
[1] Definition, Dignosis and Classification of Diabetes Mellitus and it's Complicatio- ns.World Health Organization. WHO/NCD/NCS/99.2.
[2] 第三届全国眼科学术会议.糖尿病视网膜病变分期标准[J].中华眼科杂志,1985,21:113.
[3] [1]Duh EJ, Yang HS, Haller JA, et al. Vitreous levels of pigment epithelium-derived factor and vascular endothelial growth factor: implications for ocular angiogenesis[J]. Am J Ophthalmol, 2004?,137(4):668-674
[4] Misra A, Kumar S, Kishore Vikram N, Kumar A,et al. The role of lipids in the development of diabetic microvascular complications: implications for therapy[J]. Am J Cardiovasc Drugs, 2003; 3:325-338.
[5] 史煜,陈春生,唐仕波,等.核运输因子2在糖尿病大鼠视网膜的时空表达及其意义[J] .中国病理生理杂志,2010,26(7):1375-1379.
[6] Mahdy RA, Nada WM. Evaluation of the role of vascular endothelial growth factor in diabetic retinopathy[J]. Ophthalmic Res, 2011, 45(2):87-91.
[7] Gilbert RE, Tsalamandris C, Allen TJ, et al. Early nephropathy predicts vision-threatening retinal disease in patients with type 1diabetes mellitus[J]. J Am Soc Nephrol, 1998;9: 85-89.
[8] Chow VC, Pai RP, Chapman JR,et al.Diabetic retinopathy after combined kidney- pancreas transplantation[J]. Clin Transplant,1999 ;13(4):356-62.
[9] Jensen T,Deckert T. Diabetic retinopathy, nephropathy and neuropathy. Generalized vascular damage in insulin-dependent diabetic patients[J]. Horm Metab Res Suppl,1992;26:68-70.
[10] Klein R,Zinman B, Gardiner R,et al. The relationship of diabetic retinopathy to preclinical diabetic glomerulopathy lesions in type 1 diabetic patients: the Renin-Angiotensin System Study[J]. Diabetes, 2005;54(2):527-33.

