莽山烙铁头蛇粗毒的生物学活性
刘 宇, 聂东宋, 吴 喆, 刘立超, 朱政斌
(湖南理工学院 化学化工学院, 湖南 岳阳 414006)
蛇毒的研究是天然动物毒素研究的一个重要领域, 也是潜在的发现新的生物活性分子的重要资源[1].国内外的研究表明, 无论在基础理论还是应用研究上, 蛇毒作为新型生物医药的分子模板、神经生物学研究的工具试剂、新型生物杀虫剂的先导分子和蛋白质工程的框架分子等方面的研究均有不可替代的作用[2~4].
莽山烙铁头蛇是是蝰科腹亚科烙铁头蛇属的一个新种, 同时也是我国濒临灭绝的物种. 根据莽山国家自然保护区陈远辉的调查[5], 现今只在莽山国家自然保护区发现, 并且数量只有大概 300~500条. 目前只有Murakami对莽山烙铁头蛇毒素中的PLA2成分进行了部分研究[6~8], 而对莽山烙铁头蛇毒毒液的生物学功能的研究尚未见报道.
本研究对莽山烙铁头蛇毒液的半致死量进行了初步研究, 并采用膜片钳全细胞记录技术, 研究了莽山烙铁头蛇粗毒对大鼠背根神经节神经元TTX-R钠离子通道、TTX-S型钠离子通道、HVA型钙离子通道和LVA型钙离子通道的作用.
1 材料与方法
1.1 粗毒与动物
莽山烙铁头蛇粗毒由湖南省宜章县境内莽山自然保护区陈远辉提供, 冷冻干燥后使用.Sprague-Dawley(SD)大白鼠由本院动物房提供.
1.2 实验试剂与所需设备
细胞外液(mmol/L): TEA-Cl 160, HEPES 10, BaCl22, glucose 10, 用KOH和HCl调节pH到7.4; 细胞内液(in mM): CsCl 120, Mg-ATP 5, Na2-GTP 0.4, EGTA 10, HEPES-CsOH 20, 用KOH和HCl调节pH到7.2.
台式液(mmol/L): NaCl 137, KCl 5. 4, MgCl21, NaH2PO40.33, Hepes 10, Glucose 10, CaCl21. 8, 用氢氧化钠调pH值至7.35. 无钙台式液为台式液去CaCl2. 记录钙电流的电极内液CsCl 120, CaCl21, MgCl25,Na2ATP 5, EGTA 11, Hepes 10, Glucose 11用氢氧化铯调pH值至7.3. 记录钙电流的细胞外液即正常台式液.膜片钳放大器EPC9为HEKA公司产品(Electronid, Lambrecht, German), 抛光仪购自日本Nari 公司(Narishige, Japan).
1.3 毒液对小鼠LD50测定
取体重18~22g的昆明白小鼠30只, 雌雄不分, 随机分成5组, 每组6只. 初毒用生理盐水溶解, 按每公斤体重8、6.4、5.2、4.0 mg剂量腹腔注射, 对照组注射等体积的生理盐水, 观察24h. LD50的计算按照改进寇氏法公式:其中Xm为最大剂量的对数; p为各组动物的死亡率, 以小数表示(如 80%写作 0.8);为各组动物死亡率的总和( p1+p2+p3+p4+p5); I为相邻两组剂量( D )对数值之差.

1.4 细胞急性分离
大鼠背根神经节(DRG)神经元细胞的急性分离与培养基本按Wang等[9]报道的方法进行, 简述如下:将 4~8周龄Sprague-Dawley大鼠(雌雄不拘)击昏后断头, 迅速取出胸腰段脊柱, 放入氧气饱和的DMEM培养液中. 由剖开的椎管内侧取出神经节, 并在体视显微镜下用剪除DRG相连的神经和周围的结缔组织被膜, 然后将分离得到的DRG尽量剪碎, 置于消化试管中. 消化液配方为: 1.5mg胰蛋白酶, 3.5mg胶原酶,0.3mg DNA酶, 溶于5ml 氧气饱和的DMEM培养液中, 34℃消化30 min, 其中每间隔 10 min 左右吹散组织块一次, 消化完毕后用 7.6mg胰蛋白酶抑制剂中止酶反应. 将消化得到的细胞液经 800 rpm低速离心5min, 使细胞沉于离心管底, 小心吸去大部分消化液; 加入5ml 原代细胞培养液(95% DMEM培养液, 5%新生牛血清, 次黄嘌呤-氨喋呤胸-腺苷补充液洗一次, 吹散沉于底部的细胞, 再经800 rpm低速离心5min,去培养液. 加入5ml细胞培养液, 将沉于底部的细胞吹散均匀后, 以每皿1~1.2ml细胞液的量分装到35mm培养皿中, 共分成4或5 皿, 置于CO2培养箱中, 在5% CO2和 95%空气的湿润环境中37℃培养, 经2 hr培养, 细胞贴壁后即可进行膜片钳实验.
1.5 全细胞记录
电流记录通过全细胞膜片钳技术利用放大器 EPC9在电脑上进行. 计算机记录和分析系统采用Pulse+Pulsefit 8.0软件. 玻璃电极管为 100μL硼硅酸盐玻璃毛细管. 玻璃电极两步拉制而成, 经抛光仪(Nari- shige, Japan)抛光后电极尖端直径约为3μm, 充灌电极液后电极电阻为1~3 MΩ. 膜片钳实验要在室温条件下进行, 整个实验过程中温度的变动最多上下不超过2℃.
使用Ba2+作为Ca2+的电荷替代物, 钙通道电流(ICa)的大小通过测得IBa值来确定. 实验中的细胞外液(in mM): 160 TEA-Cl, 10 HEPES, 2 BaCl2, 10 glucose和200 nM TTX, 用TEA-OH调节 pH到7.4; 细胞内液(in mM): 120 CsCl, 5 Mg-ATP, 0.4 Na2-GTP, 10 EGTA, 20 HEPES-CsOH, 调节pH到7.2. 当DRG细胞形成全细胞记录模式后, 将膜电位钳制在−90mV或−40mV, 然后去极化到−40mV或+60mv, 记录到IBa. 测定钠电流的细胞外液(in mM): 50 NaCl, 90 choline chloride, 20 TEA-Cl, 5 D-glucose, 5 HEPES, 1 MgCl2, 1 CaCl2,调pH到 7.4, 再在其中加入 10μM NiCl2, 用来阻断Ca2+电流. 细胞内液: 125 CsCl, 20 NaF, 5 HEPES, 5 EGTA, 用1M CsOH调pH到7.2. 采用SigmaPlot 8.0软件分析试验结果.
2 结果与讨论
2.1 毒液对小鼠LD50测定
利用 Bradfordf 法测得粗毒的蛋白质含量为 38.60 %, 而莽山烙铁头蛇粗毒对小鼠的半致死量 LD50值为4.3 mg/kg, 提示粗毒对小鼠具有较强的毒性. 此外, 经腹腔注射后, 小鼠随即出现畏冷、全身震颤的现象; 不进食, 呼吸急促, 眼睛睁不开, 四肢瘫软, 出现爬行困难, 产生麻痹作用, 皮毛因大量出汗而聚结,失去光泽, 严重者出现全身抽搐、尿失禁等症状. 高剂量组小鼠全部死亡. 这提示粗毒中有神经毒素成分, 解剖死亡小鼠尸体, 发现肝脏、脾脏有大量淤血,提示粗毒中可能含有纤溶酶等溶血毒素成分.
2.2 莽山烙铁头蛇粗毒对DRG 细胞膜上钠电流的影响
背根神经节(DRG)细胞膜上 2 种钠通道(TTX-S 型和TTX-R 型)所占比例与细胞大小有关.一般认为直径为 20~40 μm的细胞几乎只含有TTX-S钠通道, 而 TTX-R 钠通道主要分布于直径小于20μ m的细胞上[10]. 为观察毒素对 2 种钠通道的影响, 我们分别选用相应大小的DRG 细胞作为实验对象, 在全细胞记录模式下, 将膜电压维持在−80mV, 以+10 mV 步幅、50 ms 时程去极化至+50mV, 分别诱导出加毒素前后的TTX-S (图 1)和TTX-R 钠电流(图 2). 再根据去极化的电压和相应诱导电流的大小作出TTX-S 和TTX-R 钠电流的I-V曲线图. 图1表明, 加粗毒100 mg/L 4min 后电流幅度没有变化, 其激活阈值和峰值电压没有改变, 逆转电压也没有发生明显漂移, 说明粗毒不影响TTX-S 钠通道的离子选择透过性. 图2 表明, 加10 mg/L 粗毒后电流立即开始减小, 加 100 mg/L和1000 mg/L粗毒后电流的抑制现象有所加强, 表明粗毒对TTX-R钠电流的抑制效应具有浓度依从性,上述结果表明莽山烙铁头蛇毒素是一种TTX-R型钠通道阻断剂, 而对TTX-S型钠通道无明显影响.

图1 毒粗毒对TTX-S型钠通道的阻断作用分析

图2 粗毒对TTX-R型钠通道的阻断作用分析

图3 粗毒对HVA型钙通道的阻断作用分析
2.3 莽山烙铁头蛇粗毒对DRG细胞膜上钙电流的影响
采用全细胞膜片钳记录技术观察了莽山烙铁头蛇粗毒对HVA和LVA型钙通道离子电流变化,大鼠背根神经节神经元细胞在 100mg/L和1000mg/ L作用10 min 后的Ica的I-V 曲线表明:粗毒对HVA型(图3)和LVA(图4)钙通道具有明显抑制作用, 100 mg/L和1000 mg/ L的粗毒浓度依赖性地减少 ICa. 提示粗毒中含有 HVA和LVA型钙通道离子的抑制成分.
电压门控性钠通道是调节此类神经元兴奋性和动作电位产生和传播的重要离子通道[10].莽山烙铁头蛇毒素能浓度依赖地抑制DRG细胞膜上TTX-R钠通道电流峰值, 中、高浓度的莽山烙铁头蛇毒素溶液还电压依赖地影响通道的激活过程, 使通道电流的半激活电压向去极化方向偏移, 导致TTX-R钠通道必须达到更大的去极化程度方可最大激活TTX-R钠电流, 延缓了其激活过程. 由此我们推断, 莽山烙铁头蛇毒素对TTX-R钠通道的调节可能直接干预痛觉信息中枢传入的过程.
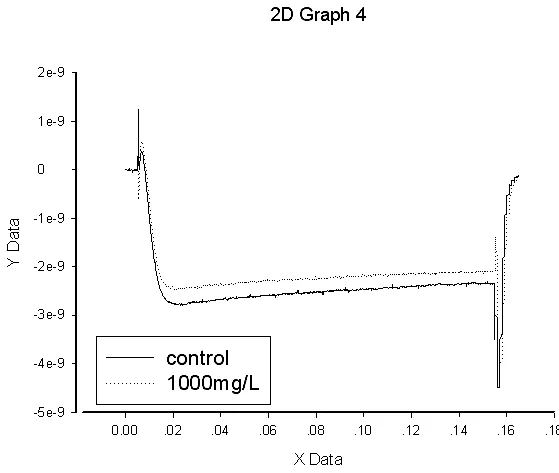
图4 粗毒对LVA型钙通道的阻断作用分析
3 结束语
本文对莽山烙铁头蛇粗毒的生物学活性进行了初步研究, 确定了其对小鼠的半致死量, 同时采用膜片钳全细胞记录技术, 研究了莽山烙铁头蛇粗毒对大鼠背根神经节神经元河豚毒素不敏感(TTX-R)钠通道、河豚毒素敏感(TTX-S)钠通道、低电压激活(LVA)电压依赖性钙离子通道和高电压激活(HVA)钙离子通道的影响. 下一步我们将通过分离粗毒中的各种有效成分, 并进一步确定其生物学功能.
[1]Geoff W. Birrell, Stephen T. H. Earl, Tristan P. Wallis, et al. The Diversity of Bioactive Proteins in Australian SnakeVenoms[J]. Mol. Cell. Proteomics,2007, 6: 973~986
[2]Solange M. T. Serrano, John D. Shannon, DeyuWang, et al. A multifaceted analysis of viperid snake venoms by two-dimensional gel electrophoresis: An approach to understanding venom proteomics [J]. Proteomics, 2005, 5(2):501~10
[3]Bryan G. Fry. From genome to “venome”: Molecular origin and evolution of the snake venom proteome inferred from phylogenetic analysis of toxin sequences and related body proteins [J]. Genome Research, 2005, 15(3): 403~420
[4]Shuting LI, Jingqiang WANG, Xumin ZHANG, et al. Proteomic characterization of two snake venoms: Naja naja atra and Agkistrodon halys [J]. Biochem.J, 2004, 384:119~127
[5]陈远辉. 莽山烙铁头蛇的资源调查报告[J]. 蛇志, 2003(01): 62~64
[6]Murakami MT, Kuch U, Betzel C, Mebs D, Arni RK. Crystal structure of a novel myotoxic Arg49 phospholipase A2 homolog (zhaoermiatoxin)from Zhaoermia mangshanensis snake venom: insights into Arg49 coordination and the role of Lys122 in the polarization of the C-terminus [J].Toxicon, 2008,51(5): 723~35
[7]Murakami MT, Kuch U, Mebs D, Arni RK.. Crystallization and preliminary X-ray diffraction analysis of a novel Arg49 phospholipase A2 homologue from Zhaoermia mangshanensis venom [J]. Acta Crystallogr Sect F Struct Biol Cryst Commun, 2007, 1(7):605~7
[8]Mebs D, Kuch U, Coronas FI, Batista CV, Gumprecht A, Possani LD. Biochemical and biological activities of the venom of the Chinese pitviper Zhaoermia mangshanensis, with the complete amino acid sequence and phylogenetic analysis of a novel Arg49 phospholipase A2 myotoxin[J].Toxicon,2006, 47(7): 797~811
[9]Wang Q W, Li Q, Li Z W. Inhibitory effects of clonidine on GA2BA-activated currents in DRG neurons [J]. Acta Physiologica Sinica, 1998, 50 (1): 19~27
[10]Su X , Ruth E W, Gebhart G F. Capsaicin sensitivity and voltage-gated sodium currents in colon sensory neurons from rat root ganglia [J]. Am. J .Physiol, 1999, 277 ( 40): 1180~1188
[11]Song J, Jang YY, Shin YK, Lee C, Chung S. N-Ethylmaleimide modulation of tetrodotoxin-sensitive and tetrodotoxin-resistant sodium channels in rat dorsal root ganglion neurons [J]. Brain Research, 2000, 855: 263~273

