长角血蜱感染汉赛巴尔通体后血淋巴超氧化物歧化酶变化的初步研究*
李志芳,刘起勇,张卫东,宋秀平,栗冬梅,马怀雷,赵 帆,孟凤霞,任东升,靳建超,林 杰,吴海霞
长角血蜱感染汉赛巴尔通体后血淋巴超氧化物歧化酶变化的初步研究*
李志芳1,2,刘起勇2,张卫东1,宋秀平2,栗冬梅2,马怀雷2,赵 帆2,孟凤霞2,任东升2,靳建超2,林 杰2,吴海霞2
目的 测定长角血蜱(Haemaphysalis longicornis)感染汉赛巴尔通体(Bartonella henselae)后不同时间段超氧化物歧化酶的活性。方法用 Hamilton 10μL微量进液器将汉赛巴尔通体菌液悬浮液(浓度为105cfu/μL),通过假头与盾板间缘凹处注入已部分吸血的未交配的长角血蜱成蜱血腔内,在染毒后1 h,6 h,12 h,24 h及48 h后收集长角血蜱的血淋巴,使用南京建成超氧化物歧化酶(SOD)试剂盒测定其血淋巴中SOD的活性。同时设立生理盐水对照组,对比两组之间及两组内各时间点是否存在差异。结果对收集到的不同时间段的血淋巴测定超氧化物岐化酶的活性后发现,实验组在感染后48 h内,酶活性一直处在平稳的水平;生理盐水对照组SOD酶活性随着时间的延长先升高后又降低,在12 h达到(11.1999±1.3248)U/mL,并且与实验组此时间段的酶活性相比有统计学差异(P=0.036);而在48 h降为最低,与1 h的酶活性相比有统计学差异(P=0.000)。结论长角血蜱受到一定浓度的汉赛巴尔通体攻击后,血淋巴SOD酶活性在一段时间内受到了抑制。
汉赛巴尔通体;长角血蜱;超氧化物歧化酶
巴尔通体(Bartonella)由秘鲁细菌学家A lberto Barton,1909年首次从O roya热病人的红细胞中发现,它是一种革兰染色阴性,营养条件要求苛刻,兼性细胞内寄生的需氧杆菌,与一类新发的人兽共患性疾病密切相关。其中汉赛巴尔通体(B.henselae)是目前已知的致病种类最多的巴尔通体[1],引起的最常见的疾病如猫抓病(cat scratch disease,CSD)等。巴尔通体可以通过吸血节肢动物如蚤[2]等叮咬而引起人兽共患病。蜱类是专性吸血的节肢动物,可以传播多种病原体,如伯氏疏螺旋体,森林脑炎病毒等[3]。目前有很多报道显示在蜱中也检测到了巴尔通体[4-5],而对于巴尔通体血清学阳性的人或动物大部分有蜱类叮咬的病史[6-8],虽然现在有很多媒介生物学家和流行病学家都认为蜱在巴尔通体的传播过程中发挥着很大的作用[9],但究竟蜱能否传播巴尔通体?哪些蜱种可以传播巴尔通体?其机制如何?本实验就长角血蜱在受到汉赛巴尔通体的攻击之后体内防御酶活性的变化进行研究,希望可以从免疫学的角度为蜱类传播巴尔通体提供一定的实验基础。
1 材料与方法
1.1 实验用蜱 实验室饲养的长角血蜱(Haem aphysalis longicornis),同一代次,雌性成蜱,并由同一雌蜱产卵孵化而成,随机抽取20%,PCR检测不含汉赛巴尔通体。所需的长角血蜱均是在 ICR小鼠上吸血饲养,ICR小鼠为清洁动物,按照20%的比例随机抽取并经 PCR检测不含汉赛巴尔通体。实验所用蜱为吸血5~6 d未进行交配过的雌性成蜱。
1.2 菌液悬浮液的配制 汉赛巴尔通体A TCC○R49882(Houston-1),购自美国标准生物制品收藏公司(A TCC)。复苏及传代时,均混合营养肉汤涂布于含5%去纤维羊血的胰酶大豆琼脂培养基上,在含5%CO2,37℃的培养箱中生长,传代至3~4代,生长5~6 d时使用。首先用无菌接种环从胰酶大豆琼脂培养基上刮取适量的汉赛巴尔通体,用无菌生理盐水在常温下离心洗涤2遍(5 000×g,10 min),然后使用比浊仪 (Densimat,Biomérieux SA France.)测定浊度,并进行稀释,使最后菌液的浓度为1×105cfu/μL。
1.3 长角血蜱的感染 试验分2组,实验组(生理盐水+汉赛巴尔通体组)以及生理盐水对照组(简称对照组)。实验组和对照组各设立3个平行对照。首先准备一块干净的载玻片,用双面胶粘在正中央,放在显微镜下。取出一只饲养5~6 d呈半饱血的长角血蜱,放在双面胶上,使其背部朝上。用镊子轻压蜱的头部,使用10μL的 Hamilton注射器及33G针头,将已配制好的菌液悬浮液(实验组)或无菌生理盐水(对照组)通过假头与盾板间缘凹处注入已部分吸血的未交配的成蜱血腔内[10],每只注射5μL。
1.4 采集血淋巴 根据王平等[11]的方法采集血淋巴。在感染后不同时间(1 h、6 h、12 h、24 h和48 h)用眼科剪切断雌蜱附肢基部,定量毛细管收集血淋巴后,迅速打入预冷的缓冲液(1%肝素钠,PBS(p H7.4),PMSF(100 mmol/L)及少量的苯基硫脲)中,-20℃保存备用。
1.5 SOD活性测定 将采集得到的血淋巴隔夜放置,次日于4℃,3 000r/min,离心15 min,取上清作为受试样品。测定步骤按照南京建成SOD测试盒的步骤进行,确定最佳取样量,使用7230G型可见分光光度计(上海精密科学仪器有限公司),在550 nm波长处读取吸光度(A)值,测定总SOD活力。
2 结 果
2.1 不同时间段实验组与对照组SOD酶活性水平(图1)
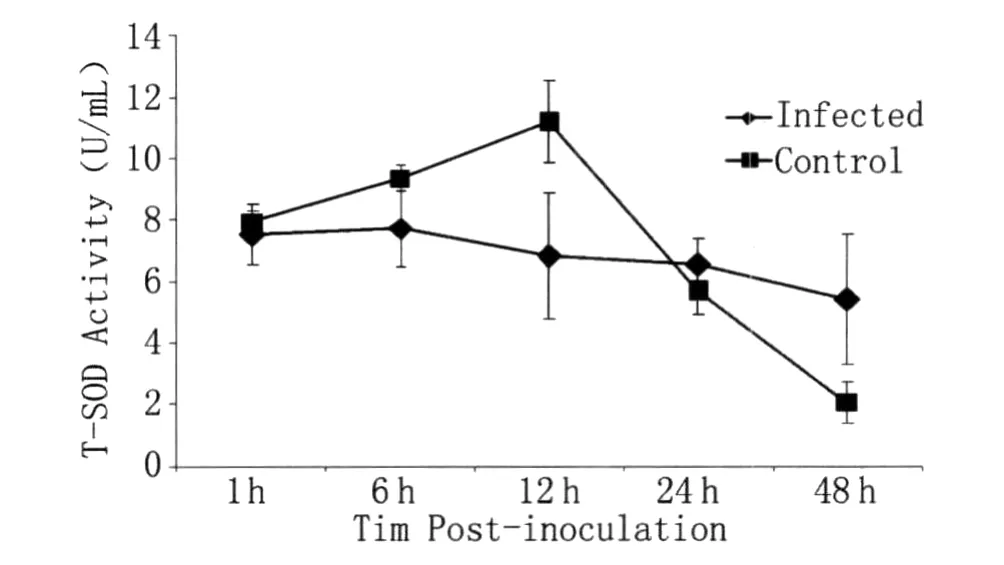
图1 汉赛巴尔通体(105 cfu/μL)接种到长角血蜱未饱血雌蜱体内后总SOD酶活性的变化(n=103)Fig.1 Following changes on T-SOD activity in Haem aphysalis longicornis hemolym ph inoculation of Bartonella henselae(105 cfu/μL)into partially fed virgin females(n=103)
2.2 两组之间各时间段的比较 通过对比以上的酶活性结果我们可以看出,在实验组SOD酶活性一直处在一个较平稳的状态,而对照组SOD酶活性先上升,12 h时达到高峰后降低。在酶活性最高时间段12 h时实验组 SOD的酶活性值为(6.8365±2.0328)U/mL,对照组为(11.1999±1.3248)U/mL,两组的差异有统计学意义(t=3.115,d f=4,P=0.036<0.05)。而到48 h时对照组的SOD酶活性下降到很低的水平,仅为(2.0611±0.6947)U/mL。
2.3 两组组内各时间点的比较 通过对实验组5个不同时间点酶活性的比较我们了解到,酶活性在各个时间点均处于稳定的状态,各时间点间没有统计学差异(F=1.065,d f=4,P=0.423);而对照组酶活性的变化出现很大的波动,12 h时酶活性达到最高水平,并且与1 h(P=0.005),24 h(P=0.000)及48 h(P=0.000)的酶活性均有统计学差异,在48 h时降为最低,与1 h时的酶活性相比有统计学差异(P=0.000)。
3 讨 论
SOD是由 M cCord和 Fridovich等人在1969年首次从牛红血球中分离得到的[12]。它普遍存在于生物体内,能清除超氧阴离子自由基,是生物体防御氧化损伤的重要金属酶系之一。在生物体受到外来物质的刺激时,会产生活性氧(reactive oxygen species,ROS),此时生物体内的 SOD清除O2-·而产生 H2O2,过氧化氢酶和过氧化物酶又可以将 H2O2分解为 H2O和O2,从而使细胞内的自由基处于较低的水平,保护细胞免受损伤[13]。因此研究在病原体感染机体之后SOD的活性变化对了解机体的免疫防御能力有重要的意义。
SOD的酶活性在受到外来的刺激时会相应升高,但是当外来刺激作用很强,活性氧大量积累造成氧化损伤时则会使SOD的酶活性相应降低[14]。此次试验我们观察到长角血蜱在感染汉赛巴尔通体后,SOD的酶活性在一定时间内受到了抑制,这可能与细菌的存活状态和机体受到的外界胁迫作用强度有关。实验组SOD的酶活性在12 h前没有像对照组那样明显升高,这可能是汉赛巴尔通体的侵染打乱了机体的氧化还原平衡状态,活性氧大量累积,反而抑制了SOD的大量产生,从而使得巴尔通体实验组SOD的酶活性在一段时间内仅微微升高,甚至在6 h时已开始下降,而对照组可能由于对机体的刺激适度,机体对其应激反应并不强烈,活性氧适量增加,诱导SOD酶大量增加,至12 h时与实验组有了明显的差异;而在12 h后,对照组随着机体的逐渐适应,活性氧含量下降,SOD的酶活性也逐渐降低,至48 h时明显低于1 h时的水平,而实验组SOD可能由于汉赛巴尔通体尚未完全清除或在蜱体内存活下来,胁迫作用仍较强,使得SOD的酶活性并没有明显变化,至24 h后相对于对照组反而处于较高的水平。
本实验仅记录了蜱感染汉赛巴尔通体后48 h内的SOD酶活性变化结果,48 h之后实验组的酶活性是持续降低还是会阶段性上升,这种降低或升高与蜱体内汉赛巴尔通体的含量和生存状态是否相关,如何相关?这些变化是否是导致巴尔通体能否成功感染蜱或其他宿主的原因之一,这些都有待进一步研究。
目前关于巴尔通体侵染蜱类之后两者之间的生物学、病理学及生物化学的研究报道几乎没有,本实验通过观察汉赛巴尔通体进入蜱类体内之后其防御酶——超氧化物歧化酶(SOD)的活性变化,以期可以分析蜱媒的防御酶系及蜱媒与病原体之间的相互适应结果,同时也为探讨蜱媒对相关病原体的免疫应答机制提供线索。
(本研究得到本所碘缺乏病参照实验室李素梅主任及该室各位老师和同学在仪器和仪器使用方面的大力支持,在此表示感谢。)
[1]栗冬梅,孟凤霞,宋秀萍,等.从山东省家犬血液中分离出致病性巴尔通体—文森巴尔通体伯格霍夫亚种[J].中华流行病学杂志,2006,27(4):333-338.
[2]Kam rani A,Parreira VR,Greenwood J,et al.The prevalence of Bartonella,hemoplasma,and Rickettsia felis infections in domestic cats and in cat fleas in Ontario[J].The Canadian Journal of Veterinary Research,2008,72:411-419.
[3]孟阳克,吴光华,尹德铭,等.蜱螨媒性疾病[M].银川:宁夏人民出版社,1990:230.
[4]Chang CC,Chomel BB,Kasten RW,et al.Molecular evidence of Bartonella spp.in questing adult Ixodes pacificus ticks in California[J].Journal of Clinical Microbiology,2001,39(4):1221-1226.
[5]Halos L,Jamal T,Maillard R,et al.Evidence of Bartonellaspp.in questing adult and nymphal Ixodes ricinus ticks from France and co-infection with Borrelia burgdorferi sensu lato and Babesia spp[J].Veterinary Research,2005,36(1):79-87.
[6]Eskow E,Rao RV,Mordechai E.Concurrent infection of the central nervous system by Borrelia burgdorferi and Bartonella henselae:evidence for a novel tick-borne disease complex[J].A rchives of Neurology,2001,58:1357-1363.
[7]Podsiadly E,Chmielew ski T,Tylew ska-Wierzbanow ska S.Bartonella henselae and Borrelia burgdorferi infections of the central nervous system[J].Annnals of New York Academy Sciences,2003,990:404-406.
[8]Pappalardo BL,Correa M T,York CC,et al.Epidemiologic evaluation of the risk facto rs associated with exposure and seroreactivity to Bartonella vinsonii in dogs[J].American Journal of Veterinary Research,1997,58(5):467-471.
[9]Jacomo V,Kelly PJ,Raoult D.Natural history of Bartonella infections(an exception to Koch’s postulate)[J].Clinical and Diagnostic Laboratory Immunology,2002,9(1):8-18.
[10]Johns R,Sonenshine DE,Hynes WL.Control of bacterial infections in the hard tick Dermacentor variabilis(Acari:Ixodidae):evidence for the existence of antimicrobial proteins in tick hemolymph[J].Journal of Medical Entomology,1998,35(4):458-464.
[11]王平,王多,刘敬泽.蜱类血淋巴的收集方法[J].昆虫知识,2009,46(2):307-308.
[12]M cCord JM,Fridovich I.Superoxide dismutase.An enzymic function for erythrocup rein(hemocuprein)[J].The Journal of biological Chemistry,1969,244(22):6049-6055.
[13]刘井兰,于建飞,吴进才,等.昆虫活性氧代谢[J].昆虫知识,2006,43(6):752-756.
[14]樊甄姣,刘志鸿,杨爱国.氨氮对栉孔扇贝血淋巴活性氧含量和抗氧化酶活性的影响[J].海洋水产研究,2005,26(1):23-27.
Enzyme activity of SOD(Superoxide Dismutase)in Haemaphysalis longicornis ticksafter hemocoelic inoculation with Bartonella henselae
L IZhi-fang1,2,L IU Qi-yong2,ZHANGWei-dong2,SONG Xiu-ping2,L IDong-mei2,MA Huai-lei2,ZHAO Fan2,M ENG Feng-xia2,REN Dong-sheng2,JIN Jian-chao2,L IN Jie2,WU Hai-xia2
(1.Department of Epidemiology and Health Statistics,College of Public Health,Zhengzhou University,Zhengzhou 450001;2.Department of Vector Biology and Control,State Key Laboratory for Infectious Diseases Prevention and Control,National Institute for Comm unicable D isease Control and Prevention,Chinese Center for Disease Control and Prevention,Beijing 102206,China)
The aim of this experiment was to study enzyme activity of superoxide dismutase(SOD)in Haemaphysalis longicornis ticks and its change over time after Bartonella henselae had been inoculated into them.First,fivemicrolitres of B.henselae suspension(105cfu/μL)were injected into the hemocoelic cavity of partially fed virgin female H.longicornis using a 10μL Hamilton syringe.Then hemolymph samples were collected at 1 h,6 h,12 h,24 h and 48 h after inoculation.Finally,the activity of SOD was determined with the SOD detection kitmanufactured by Jiancheng,Nanjing.Theme thod was also repeated by using saline solution as control.The enzyme activity of SOD remained steady for 48 h in infected group.Whereas the control group,the enzyme activity peaked at 12 h(11.1 999±1.3 248U/m L)and higher than infected group,there was a difference between the two groups at 12 h(P=0.036);then the activity decreased at 48 h,and lower than that at 1 h(P=0.000).The result showed that the enzyme activity of SOD would be inhibited w hen H.longicornis was attacked by B.henselae in a certain period,which suggests that the B.henselae stress might be a supp ression factor with the enzyme activity of SOD over time o r concentration.
Bartonella henselae;Haem aphysa lis longicornis;Superoxide Dismutase
1.郑州大学公共卫生学院流行病与卫生统计学教研室,郑州 450001;2.传染病预防控制国家重点实验室,中国疾病预防控制中心传染病预防控制所,北京 102206
R376
A
1002-2694(2011)06-0492-03
*国家自然科学基金项目(No.30600513)资助
吴海霞,Email:w uhaixia@icdc.cn
2011-01-04;
2011-03-08

