人伤寒沙门菌Ty21a菌蜕的制备*
温 晶 ,寇志华 ,于 虹,吕兴茹,王 欣,郭 彦,俞建萍,赵光宇 ,周育森
人伤寒沙门菌Ty21a菌蜕的制备*
温 晶 ,寇志华 ,于 虹,吕兴茹,王 欣,郭 彦,俞建萍,赵光宇 ,周育森
目的 探讨利用噬菌体PhiX174 E基因制备人伤寒沙门菌 Ty21a菌蜕的可行性以及适当制备条件。方法将PhiX174 E基因克隆至温控表达系统,筛选获得裂解效率较高的质粒pMBE,通过优化转化方法将pMBE导入 Ty21a,利用温控表达系统进行 Ty21a菌蜕制备。菌落计数计算菌蜕裂解效率,并通过扫描电镜和透射电镜观察其形态结构。结果裂解质粒pMBE介导大肠杆菌DH5α的裂解效率达99.99%;通过电击转化方法获得重组 Ty21a(pMBE),利用温控表达系统成功制备 Ty21a菌蜕,裂解效率达96.77%。电镜观察菌蜕结构完整并呈空泡状结构,并能看到溶菌孔道。结论PhiX174 E基因表达可实现人伤寒沙门菌 Ty21a裂解形成Ty21a菌蜕,为其作为疫苗和药物递送载体的研究奠定了基础。
Ty21a菌;细菌菌蜕;电击转化;噬菌体 PhiX174 E基因
细菌菌蜕(Bacterial Ghost)是在革兰氏阴性菌中诱导表达来自噬菌体PhiX174的 E基因,导致细菌裂解而形成的完整细菌空壳。PhiX174 E基因编码一个由91个氨基酸组成的疏水性蛋白质,E蛋白间寡聚化促使内、外膜在通道处融合,并形成一个直径介于200 nm和400 nm的特异性跨膜通道[1-3],胞内的物质在细胞内外渗透压的作用下由通道排出。由于制备过程较温和且无需变性作用,因此细胞壁在很大程度上被完整保存下来。细菌菌蜕本身可直接作为一种很好的疫苗,因为其保留了活菌状态下的包膜结构和相关抗原蛋白,如脂多糖、Cp G和菌毛等,从而能有效地被抗原递呈细胞吞噬、加工和递呈。实验已证明,菌蜕通过口服[4]、皮下、静脉、滴鼻[5]等途径免疫小鼠、兔子、猪[6]等动物,可诱导有效的免疫应答。另外,可将外源性抗原蛋白、核酸或药物等导入到菌蜕中,使细菌菌蜕成为一种新的疫苗和药物的递送体系。目前以细菌菌蜕作为DNA疫苗递送体系研究的仅限于大肠杆菌和曼海姆菌[7-9]。
减毒沙门菌能以自然感染的方式如胃肠道感染进入人体,是肠道免疫的有效细菌载体。目前减毒沙门菌已被用于多种人兽共患病的核酸疫苗载体[10],具有导入效率高,费用低,制备方法简便等特点。人伤寒沙门 Ty21a疫苗株是由 Germanier等于1975年将野生株Ty2经化学突变剂亚硝基胍处理而获得的突变株[11],实验证实,Ty21a疫苗株安全性好,并且以其作为疫苗递送体系可诱导产生较好的免疫保护作用,但存在潜在的毒力回复的可能。目前国内外尚没有 Ty21a菌蜕的相关研究。本研究首次利用温控诱导表达系统制备人伤寒沙门菌Ty21a菌蜕,成功获得了具有完整内膜结构的Ty21a菌蜕,有望成为疫苗和药物的新型递送系统。
1 材料与方法
1.1 材料
1.1.1 菌株及质粒 人伤寒沙门菌 Ty21a疫苗株,购自中国药品生物制品检定所;大肠杆菌 E.coli DH5α购自全式金公司;噬菌体 PhiX174购自美国典型培养物中心(A TCC13706-B1);质粒pBV 220为温控型表达载体,由病毒基因工程重点实验室张智清教授惠赠;裂解质粒pBVE和pMBE,由本实验室构建并保存。裂解质粒pBVE是将 PhiX174 E裂解基因克隆到温控表达质粒pBV 220中获得的;而裂解质粒pMBE是在pBVE的基础上引入了幽门螺杆菌Rep A复制调控元件而获得的重组裂解质粒。
1.1.2 主要试剂 胰蛋白胨、酵母提取物均购自Oxoid公司;质粒提取试剂盒购自 TIANGEN公司;各种限制性内切酶、PCR试剂盒和其它工具酶均购自大连宝生物有限公司;引物合成及测序服务由大连宝生物有限公司完成。
1.2 方法
1.2.1 裂解质粒pBVE和pMBE对大肠杆菌裂解效率的比较 取质粒转化菌 E.coli DH5α(pBVE)和 E.coli DH 5α(pMBE)单克隆分别接种到 LB(100μg/m L氨苄青霉素,AM P+)液体培养基,28℃、150 r/m in摇床培养过夜,次日分别转接于2份LB液体培养基,28℃、150 r/min培养至OD600值为0.5左右时,一份将培养温度迅速升高到42℃诱导E基因表达,另一份于28℃继续培养。每30 min取样,利用分光光度计测定OD600值并通过菌落计数法计算裂解效率。
1.2.2 人伤寒沙门菌 Ty21a感受态细胞的制备人伤寒沙门菌 Ty21a接种到LB液体培养基,37℃、200 r/min培养16 h,划线接种到LB固体培养基培养24 h,挑取单菌落经扩大培养转接到100 m L的LB液体培养基中,37℃培养至对数生长中期,4℃、4 000 r/min离心10 min收集菌体,预冷无菌PBS(p H7.4)洗涤2次,离心收集菌体;预冷电转培养基(0.5 mol/L山梨醇,0.5 mol/L甘露醇,10%葡萄糖,蒸馏水定容)洗涤2次,离心收集菌体;用1 m L预冷的电转培养基重悬菌体,100μL分装,保存于-70℃备用。
1.2.3 电击转化 Ty21a感受态细胞 取100μL Ty21a感受态细胞于冰浴中解冻,加入1μg质粒pMBE,充分混合后注入预冷的0.1 cm无菌电击杯(B IO-RAD)中,选择电击电阻与电容分别为200Ω与25μF,电击转化电压选择250 V、500 V和1 KV进行比较。电击仪(BIO-RAD Gene Xcell)内转化完成后,将转化菌迅速吸出并加入3 m L空白LB培养基中,28 ℃、100 r/min摇床复苏约 2 h,涂布AM P+抗性LB平板,28℃孵育培养24 h后进行菌落计数,并比较转化效率。转化子通过菌落PCR进行鉴定并测序。
1.2.4 人伤寒沙门菌 Ty21a菌蜕的制备 将重组Ty21a(pMBE)菌接种于AM P+抗性LB液体培养基中,28℃、150 r/min摇床培养过夜,次日转接于2份100 m L的LB液体培养基,28℃、150 r/min培养至OD600值为0.4左右时,一组将培养温度迅速升高到42℃诱导 E基因表达,另一组于28℃继续培养。每30 min取样测定OD600值,同时留取1 m L菌液用于裂解效率测定,培养3~4 h,至OD600值基本保持不变时,离心收集菌体,PBS洗涤后备用。
1.2.5 Ty21a菌蜕裂解效率测定 分别取裂解前,裂解后 1 h、2 h、3 h、4 h 和 5 h 的菌体(1 mL),用无菌生理盐水进行梯度稀释,涂布于AM P+抗性LB平板,28℃培养约22 h,计算各时间点、各稀释度下的活菌数(CFU),选择某一稀释度进行裂解效率的计算。裂解效率=[1-(诱导后的CFU/诱导前的CFU)]×100%。
1.2.6 Ty21a菌蜕的电镜观察 取 Ty21a菌蜕细胞经PBS洗涤3次,3%戊二醛重悬,4℃固定过夜,乙醇逐级脱水,乙酸戊二酯置换,干燥后喷金,扫描电镜(H ITACH I)下观察、照相。取 Ty21a菌蜕细胞经 PBS洗涤3次,经 3%戊二醛固定后,1/15 mol/L p H 7.2磷酸盐缓冲液洗涤3次,1%锇酸后固定,梯度乙醇脱水,Epon 812浸透包埋,制成常规超薄切片,经醋酸铀-柠檬酸铅染色后在透射电镜(Philip)下观察。
2 结 果
2.1 裂解质粒pBV E和pMBE介导大肠杆菌DH5α裂解效率比较 将质粒转化菌 E.coli(pBVE)和 E.coli(pMBE)在28℃培养至对数生长中期,温度迅速升至42℃诱导 E基因的表达,二者均于诱导后大约1 h时OD600值迅速下降,3 h后基本无变化。而28℃培养的 E.coli(pBVE)、E.coli(pMBE)和 E.coli DH 5α的OD600值均持续上升,见图1。其中 E.coli(pMBE)裂解前的菌液CFU为56×105,而裂解后的菌液 CFU为7×100,其裂解效率为99.99%;重组 E.coli(pBVE)裂解前的菌液CFU为72×105,而裂解后的菌液 CFU为 80×104,其裂解效率为88.89%。结果表明,重组裂解质粒pMBE介导的大肠杆菌DH5α的裂解效率较pBVE高,因此,我们选择裂解质粒pMBE用于人伤寒沙门菌Ty21a菌蜕的制备。

图1 裂解 pBVE和pM BE介导 E.coli HD5αFig.1 Growth and lysiscurves of E.coli DH5 harboring plasm id pBVEand pM BE A:pMBE、42℃;B:pMBE、28℃;C:pBVE、42℃;D:pBVE、28 ℃;D:E.coli DH5α、28 ℃
2.2 不同电击条件对人伤寒沙门菌 Ty21a转化效率的影响 采用不同的电击电压进行 Ty21a菌的转化,转化完成后将全部培养物涂布于AM P+抗性的LB平板,28℃孵育培养24 h后进行菌落计数,实验重复4次,计数结果见表1。结果显示,电压1 KV时,细胞大量死亡;电压250 V和500 V时,均能实现质粒顺利转化,然而后者转化效率稍高于前者,二者无显著差异。由此,电压500 V、电阻200 Ω、电容25μF应是最佳转化方案。
2.3 重组 Ty21a(pMBE)的鉴定 将电击转化后的重组 Ty21a(pMBE)经 PCR扩增 E裂解基因片段,1%琼脂糖凝胶电泳,条带大小约276 bp,见图2,测序结果显示序列正确,说明质粒pMBE已成功转入 Ty21a菌中。

表1 不同电击电压下转化效率比较Table 1 Effect of voltage on transformation efficiency
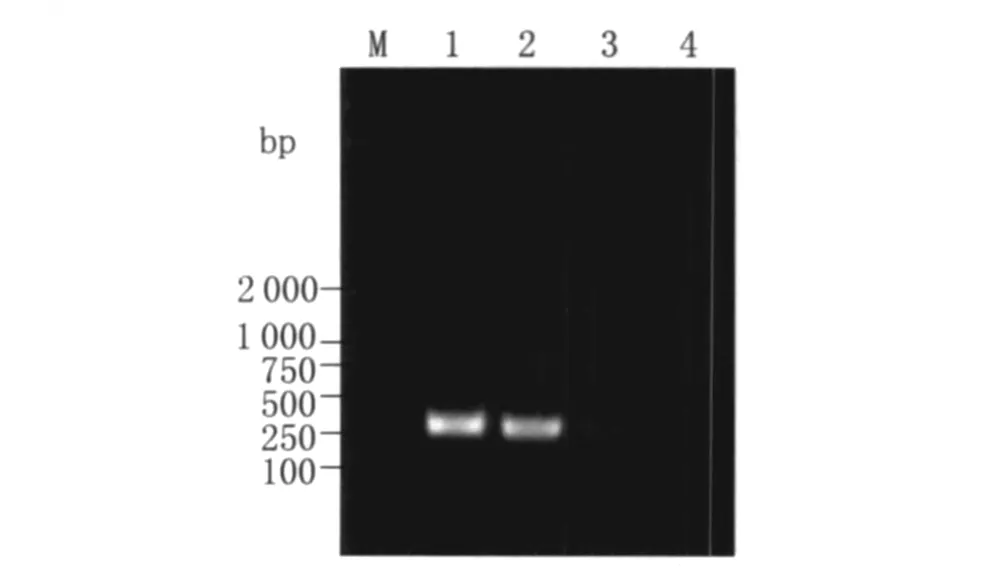
图2 重组Ty21a(pMBE)E基因PCR产物的琼脂糖凝胶电泳图Fig.2 Identification of Gene E from recombinant Ty21a(pMBE)by PCR M:DL2000 DNA;1-2:Samp le;3:pMBE;4:Negative control
2.4 Ty21a菌蜕裂解效率测定 经鉴定正确的重组 Ty21a菌(pMBE)在28℃培养至对数生长中期,将培养物分为两份,一份温度迅速升至42℃诱导细菌裂解,另一份于28℃继续培养。在42℃诱导下1 h已开始溶菌,4 h时裂解最充分,见图3。菌落计数结果显示重组 Ty21a菌(pMBE)裂解前的菌液CFU为90×105,而裂解后的菌液CFU为3×105,裂解效率达96.77%。
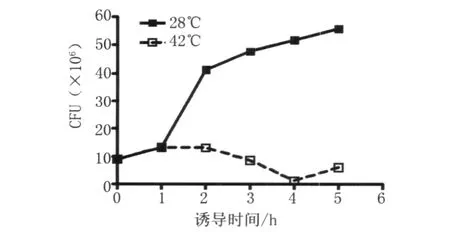
图3 Ty21a菌蜕的裂解曲线Fig.3 Growth and lysis curves of Ty21a harboring plasm id pMBE
2.5 Ty21a菌蜕扫描电镜及透射电镜观察 绝大多数细菌在诱导后形成菌蜕,呈空泡状结构,并能看到溶菌孔道,直径介于200~400 nm之间(图4-A和图4-B)。菌蜕保留了完整的细菌外膜,但因为胞内物质被释放出去,细菌发生明显皱缩(图4-C和图4-D)。

图4 Ty21a菌蜕的扫描电镜和透射电镜结果Fig.4 Scanning and transmission dlectron micrograph of Ty21a lysed by the introduction of the lysis gene E.A:Control SEM;B:BG TEM;C:Control TEM;D:BG TEM
3 讨 论
减毒沙门菌是一种具有宿主特异性的胞内侵袭菌,能穿过肠壁,进入肠道淋巴结,再由淋巴循环进入血液,并迅速感染单核细胞、巨噬细胞,并在包括肝、脾等组织内复制生长,是肠道免疫的有效细菌载体[12-15]。Levine MM等用人伤寒沙门 Ty21a疫苗株进行临床试验证实,人伤寒沙门 Ty21a疫苗株在人体试验中是安全的[16]。但其仍然存在一些不容忽视的问题,其中之一是存在毒力回复,从而对机体造成损伤[17]。因此,本研究通过温控诱导表达技术制备 Ty21a菌蜕,所制备菌蜕不但维持其完整的外膜结构,从而保留了其靶向到肠黏膜抗原递呈细胞的特性;而且,在菌蜕制备过程中,细菌中的大部分胞内物质尤其是核酸被释放,从而菌株毒力回复的可能性消除,使其安全性大大提高。
为了能够有效获得 Ty21a菌蜕,我们首先将不含RepA复制调控元件的裂解质粒pBVE转化Ty21a,结果表明,虽然裂解质粒pBVE成功地转化至 Ty21a,但诱导 Ty21a的裂解效率极低(数据未给出),不能用于 Ty21a菌蜕的制备。因此,我们在质粒pBVE的基础上引入了幽门螺杆菌RepA复制调控元件,构建重组裂解质粒pMBE。RepA复制调控元件所编码的 RepA蛋白,是pSC101等复制子的调节分子,是一种顺式作用蛋白,它对质粒复制的起始具有正向作用,而对其自身基因的转录具有负调控作用[18]。结果表明,裂解质粒pMBE不但介导大肠杆菌的裂解效率显著高于pBVE,并且能有效介导人伤寒沙门杆菌 Ty21a的裂解,保证了Ty21a菌蜕的成功制备。
制备 Ty21a菌蜕的另一关键因素是如何保证裂解质粒有效转化至菌体。虽然人伤寒沙门菌与大肠杆菌同为革兰氏阴性杆菌,但二者在结构上存在差别,我们尝试应用不同的化学转化方法均未能实现 Ty21a的成功转化(数据未给出)。因此本研究采用电击转化方法进行裂解质粒pMBE的转化。电击电压是电击转化的一个重要影响因素。电压过高,往往导致细胞过多死亡;电压不足,则细胞不宜极化产生微孔通道,无法实现转化[19]。在参考文献报道关于沙门菌相关电击转化电压的基础上[20],进行了不同电击转化条件的摸索。结果表明,电压500 V、电阻200Ω、电容25μF获得了理想的转化结果。
本研究运用温控表达系统控制噬菌体PhiX174 E裂解基因的表达,实现 Ty21a菌裂解,获得了稳定制备Ty21a菌蜕的方法。当诱导温度升至42℃时1 h已开始溶菌,4 h菌液开始变得澄清,经菌落计数显示裂解效率达96.77%。所制备的 Ty21a菌蜕经扫描电镜和透射电镜观察,菌蜕保留了完整的外膜结构,绝大多数呈空泡状结构,并且裂解通道清晰可见。从而为下一步以其作为疫苗和药物等递送体系的研究奠定了基础。
[1]Maratea A,Zillig W.Studieson lysis of Escherichia coliby bacteriophage PhiX174[J].Virology,1965,25:88-97.
[2]Witte A,Wanner G,Blasi U,et al.Endogenous transmembrane tunnel formation mediated by PhiX174 lysis protein E[J].JBacterial,1990,172:4190-4114.
[3]Witte A,Wanner G,Sulzner M,et al.Dynamics of PhiX174 protein E-mediated lysis of Escherichia coli[J].A rch Microbiol,1992,157:381-388.
[4]Wang XP,Lu CP.Mice orally vaccinated with Edwardsiella tarda ghosts are significantly protected against infection[J].Vaccine,2009,27:1571-1578.
[5]Mayr UB,Haller C,Haidinger W,et al.Bacterial ghosts as an oral vaccine:a single dose of Escherichia coli O157:H7 bacterial ghosts protects mice against lethal challenge[J].Inf Immun,2005,73:4810-4817.
[6]Katinger A,Lubitz W,Szostak MP,et al.Pigs aerogenously immunized with genetically inactivated(ghosts)or irradiated Actinobacillus pleuropneumoniae are protected against a homologous aerosol challenge despite differing in pulmonary cellular and antibody responses[J].JBiotechnol,1999,73(2-3):251-260.
[7]Walcher P,Mayr UB,Azimpour-Tabrizi C,et al.Antigen discovery and delivery of subunit vaccines by nonliving bacterial ghost system[J].Exp Rev Vaccines,2004,3:681-691.
[8]Ebensen T,Paukner S,Link C,et al.Bacterial ghostsare an efficient delivery system for DNA vaccines[J].J Immunol,2004,172:6858-6865.
[9]Huter V,Szostak MP,Gampfer J,et al.Bacterial ghosts as drug carrier and targeting vehicles[J].J Control Release,1999,61(1-2):51-63.
[10]Darji Azur,Lage AD,Garbe A I,et al.O ral delivery of DNA vaccines using attenuated Salmonella typhimurium as carrier[J].FEMS Immunology and Medical Microbiology,2000,27:341-349.
[11]Germanier R,F rer E.Isolation and characterisation of Gal E mutant Ty21a of Salmonella typhi:a candidate strain for a live,oral typhoid vaccine[J].J Infect Dis,1975,131:553-558.
[12]Vazquez-To rres A,Jones-Carson J,Baum ler AJ,et al.Extraintestinal dissemination of Salmonella by CD18 expressing phagocytes[J].Nature,1999,401:804-808.
[13]Vazquez-Torres A,Xu Y,Jones-Carson J,et al.Salmonella pathogenicity island 2 dependent evasion of the phagocyte NADPH oxidase[J].Scinece,2000,287:1655-1658.
[14]Zhang XL,Jeza V T,Pan Q.Salmonella Typhi:from Human pathogen to a Vaccine vector[J].Cell&Molecular Immunology,2008,5(2):91-97
[15]Shata M T,Reitz MSJr,DeVico AL,et al.Mucosal and systemic H IV-1 Env-specific CD8(+)T-cells develop after intragastric vaccination with a Salmonella Env DNA vaccine vector[J].Vaccine,2001,20(3-4):623-629.
[16]Levine MM,Ferreccio C,Black RE,et al.Large-scale field trial of Ty21a live o ral typhoid vaccine in enteric-coated capsule formulation[J].Lancet,1987,1(8541):1049-1052.
[17]Kopecko DJ,Sieber H,U res JA,et al.Genetic stability of vaccine strain Salmonella typhi ty21a over 25 years[J].Int J Med Microbiol,2009,299(4):233-246.
[18]Chattoraj DK,Snyder KM,Abeles AL.P1 plasmid replication:multiple functions of RepA protein at the origin[J].Proc Natl Acad Sci U S A,1985,82(9):2588-2592.
[19]Weaver JC,Chizmadzhev YA.Theory of electroporation:A review[J].Biochemistry and Bioenergetics,1996,41:135-160.
[20]O’Callaghan D,Charbit A.High efficiency transformation of Salm onella typhi-murium and Salmonella typhi by electroporation[J].Mol Gen Genet,1990,223(1):156-158.
Preparation and identification of Salmonella enterica Ty21a bacterial ghosts
WEN Jing,KOU Zhi-hua,YU Hong,LüXing-ru,WANG Xin,Guo Yan,YU Jian-ping,ZHAO Guang-yu,ZHOU Yu-sen
(State Key Laboratory of Pathogen and Biosecurity,Beijing Institute of Microbiology and Epidem iology,Beijing 100071,China)
In order to prepare Ty21a bacterial ghosts accomplished by the temperature-controlled expression of bacteriophage PhiX174 lys is gene E,two recombinant lysis plasmidswere constructed by cloning the lysis gene E into temperature-induced plasmid system,and their lysis efficiency to E.coli DH5αwas compared by counting the colony forming unit(CFU).Plasmid pMBE was transformed into bacteria Ty21a using imp roved transformation condition,then Ty21a bacterial ghosts(Ty21a BGs)were produced by shifting the temperature from 28℃to 42℃.Ty21a BGswere harvested by centrifugation,and the lysis rate was calculated.The characterization of BG was observed by scanning electron micrograph(SEM)and transmission electron micrograph(TEM).The lysis rate of E.coli ghosts which were induced by plasmid pMBE was about 99.99%.Bacteria Ty21a was efficiently transformed using optimal electro poration parameters(voltage 500V,electric resistance 200Ω,and capacitance 25μF),forming recombinant Ty21a(pMBE).Ty21a BGs were produced by controlled expression of PhiX174 lysis gene E,and the lysis rate was 96.77%.Ghosts show loss of cytoplasmic material and structural integrity.The Ty21a bacterial ghost was successfully produced by the controlled expression of PhiX174 lysis gene E,which provides an efficient delivery system for vaccine development.
Ty21a;bacterial ghost;electroporation condition;PhiX174 lysis gene E
R378.2
A
1002-2694(2011)06-0479-05
*国家自然科学基金(30872392)和863课题(2007AA02Z414)联合资助
寇志华,Email:zh_69kou@yahoo.com;周育森,Email:yszhou@nic.bmi.ac.cn
北京微生物流行病研究所,病原微生物生物安全国家重点实验室,北京 100071
2011-01-10;
2011-03-02

