人类白细胞介素10基因-592C/A多态性与SLE相关性研究
任小英 李 燕 任丽玲 王莉 武永康*
(1 成都市第一人民医院检验科,四川 成都 610041;2 四川大学华西医院实验医学科,四川 成都 610041;3 成都市老年病医院,四川 成都 611130;4 中国人民解放军第452医院妇产科,四川 成都 610041)
人类白细胞介素10基因-592C/A多态性与SLE相关性研究
任小英1李 燕2任丽玲3王莉4武永康2*
(1 成都市第一人民医院检验科,四川 成都 610041;2 四川大学华西医院实验医学科,四川 成都 610041;3 成都市老年病医院,四川 成都 611130;4 中国人民解放军第452医院妇产科,四川 成都 610041)
目的系统性红斑狼疮(SLE)是一种复杂的与遗传密切相关的免疫炎症性自身免疫疾病。而人类白细胞介素10(human interleukin-10,IL-10)被认为是体内最重要的抑炎细胞因子,其对炎性反应的调控起非常重要的作用,IL-10在SLE患者体内显著升高。本研究主要针对IL-10基因-592C/A多态性与SLE发病的关联性进行分析。方法抽取145例SLE患者和80例健康对照者全血标本,提取患者DNA,采用PCR和酶切、电泳的方法得到IL-10基因-592C/A位点多态性分布频率。结果SLE患者IL-10基因-592C/A位点基因型分布和基因型频率分布与健康对照者差异无统计学意义(P>0.05)。结论IL-10基因-592C/A多态性与SLE易感性无关。
IL-10;基因多态性;SNP;SLE
系统性红斑狼疮(systemic lupus erythematosus,SLE)是一种临床上常见的、复杂的自身免疫性疾病,被称为自身免疫性疾病的原型。患者突出表现为有自身抗体的产生并通过免疫复合物等途径造成周身多系统、多器官都可受累。肾功能衰竭、感染、中枢神经损伤是其死亡的主要原因,其病因、发病机制尚未完全清楚。目前普遍认为是环境因素(毒物、饮食、感染等)作用于一定的遗传背景的机体造成自身免疫损伤[1]。近年来虽有研究证实EB病毒[2]、吸烟和化学杀虫剂等有害环境以及药物[3]在SLE的发病过程中起一定作用,但普遍认为遗传因素起关键作用。SLE具有很强的遗传倾向,有研究表明,SLE的同胞患病率是一般人群的29倍[4],同卵双生子发病一致率为24%~58%,异卵双生子的发病一致率为2%~5%[5],流行病学显示:SLE患者一级亲属中的女性SLE患病率是2.64%,而正常人群为0.4%,SLE患者一级亲属中非SLE自身免疫性疾病发病率也明显高于正常人群[6]。
人类SLE致病因素涉及到多种基因和基因组结构的变化。基因组DNA随着细胞的增值过程不断被复制,其间DNA本身处于损伤和修复的动态变化中,其中未被修复而保留的突变构成了许多疾病的发病机制。大量存在于基因组的可遗传变异,有些可成为疾病的直接原因。随着人类基因组的最新发展及技术的出现,也为复杂特性的研究提供了新的工具,其中单核苷酸多态性(single nucleotide polymorphism,SNP)是人群遗传多态性的主要表达形式之一。
单核苷酸多态性(SNP)是人基因组内最广泛的遗传变异,它也是体现人群中个体差异的DNA序列变化中最基本和最常见的形式。SNP是指在基因组水平上由单个核苷酸的变异而引起的DNA序列多态性,即基因组内特定核苷酸位置上存在两种不同的碱基,其中一种在群体中的频率不小于1%,包括单个碱基的转换、颠换、插入或缺失,其在临床医学上主要应用于疾病的易感基因定位、器官的移植及药物基因组学等方面。人类绝大多数遗传变异是由SNP所致[7]。由于SNP分布广,数量多,遗传特性稳定,易于批量自动化检测。所以,SNP己经成为第3代遗传标记,广泛应用与多基因疾病如人类肿瘤、自身免疫性疾病等相关基因的研究。多种遗传基因与人类SLE相关,因此寻求SLE相关基因成为目前的一个研究热点。目前己知基因有免疫球蛋白Fc受体ⅡA、ⅡB、ⅢA和ⅢB,细胞毒性T淋巴细胞相关抗原4,胰脱氧核糖核酸酶Ⅰ,程序性细胞死亡1,单核细胞趋化蛋白1,酪氨酸激酶-,Toll-样受体9,干扰素调节因子5,蛋白酪氨酸磷酸酶22,血管紧张素转化酶,甘露糖结合凝集素,骨桥蛋白(osteopontin,OPN)等[8-20],通过基于基因组DNA序列变异的遗传学分析,有望为人类揭开复杂性状多基因疾病的分子机制。
近年来,白细胞介素10(interlenkin-10,IL-10)受到广泛关注,被认为是体内最重要的抑炎细胞因子,对炎性反应的调控起非常重要的作用。IL-10最初是由美国DNAX研究所Fiorentino在1989年发现鼠辅助性T细胞Th2亚型细胞分泌的一种细胞因子,能抑制Th1细胞株细胞因子RNA的转录,所以最初被称为细胞因子合成抑制因子(cytokinesynthesis inhibitory factor,CSIF),同年命名为IL-10。人IL-10含178个氨基酸残基,内有18氨基酸信号序列,相对分子质量为18.7×103。人IL-10基因定位于第1号染色体q31~32,其基因组包括5个外显子和4个内含子。在转录起始部位上游-1082(G/A)、-819(C/T)、-592(C/A)处有3个单核苷酸多态性位点,2个微卫星位点(IL-l0G和IL-10R,位于上游1.2kb和4kb处)[13,14]。研究表明,启动子多态性与IL-10表达水平有密切联系,-1082G、-819C、-592C相对于-1082A、-819T、-592A为高表达等位基因[15]。本文拟对SLE患者IL-10基因启动子区域-592A/C位点的多态性研究,以探讨SLE的发病机制。
1 材料与方法
1.1 研究对象
1.1.1 SLE患者组
选取2008年11月至2009年06月期间SLE确诊患者145例,年龄13~73岁,平均年龄34岁,男女比例为18∶127。所有SLE患者均符合1997的美国风湿病学会诊断和治疗标准委员会所制定的分类标准。
1.1.2 健康对照组
收集健康体检者80例,年龄21~70岁,平均年龄39岁,男女比例为9∶71。经询问病史、体格检查和常规生化化验、心电图及胸片等辅助检查,确认无器质性疾病,且既往无风湿病及其他自身免疫性疾病,近期无感染性疾病。
1.2 试剂与仪器
1.2.1 主要试剂
全血基因组DNA快速提取试剂盒(北京百泰克生物技术有限公司);Taq DNA Polymerase(TIANGEN BIOTECH);RsaI内切酶(纽英伦生物技术(北京)有限公司);引物;dNTP等。
1.2.2 主要仪器
Eppendorf高速离心机;基因扩增仪;pharmacia biotech电泳仪;电泳槽;Epson扫描仪等。
1.3 方法
1.3.1 DNA的提取
按试剂说明书进行提取。
1.3.2 PCR扩增
94℃反应5min,94℃反应35s→ 56℃反应40s→ 72℃反应50s→循环反应上述步骤34次。1.3.3 PCR扩增产物检测
1.3.3.1 聚丙烯酰胺凝胶电泳
1.3.3.2 染色
①电泳结束后取出凝胶,放置到染色盘中。②加入0.3%的硝酸银盖过胶,放到摇床上染色反应15min后用蒸馏水洗3次。③加2%NaON至盖过胶,放到摇床上反应15min,此时可以看到凝胶上显示出清晰的条带。④加少量冰醋酸终止显色。
1.3.3.3 采图
用扫描仪采图并保存。
1.3.4 扩增产物的限制性酶切
①酶切体系配制(10µL):水:7.8µL;10×NEB缓冲液:1µL;内切酶:0.2µL;PCR产物:1µL。②酶切:把配制好的扩增管放入37℃孵育6h。
1.3.5 酶切产物检测
方法同PCR扩增产物检测。
1.3.6 结果判读
综上所述,企业内部控制的发展对是企业财务胜仗的保障兵,科学化提高电算化的管理水平更是是重中之重在建立现代化企业制度的同时,更能够提高企业产品的竞争能力。同时,要充分考虑我国内外经济环境与企业实际情况,灵活把握管控的方式方法,力求摸索出一套完善灵活的成本管理和内控体系模式。
①PCR产物电泳出现一条412bp的条带。②酶切产物电泳出现三种情况:RsaⅠ内切酶不能切割C等位基因,而A等位基因可以被切割成236bp和176bp两个片段。
AA:电泳呈现两个条带——236bp和176bp;CC:电泳呈现一个条带——412bp;AC:电泳呈现三个条带——412bp,176bp和236bp。
1.4 统计学处理
1.4.1 数据处理方法
①用直接计数法计算基因频率。②以χ2检验进行两组间基因频率的显著性检验。P<0.05认为有差异有显著性。统计软件:SPSS16.0。
1.4.2 Hardy-Weinberg平衡定律
计算各人群中的各等位基因频率,采用Hardy-Weinberg平衡定律,判断对照组和试验组等位基因是否已经达到遗传平衡,具有群体代表性才可以进一步进行两组间的卡方检验。
2 结 果
2.1 Hardy-Weinberg平衡检验结果
SLE患者组及健康对照组Hardy-Weinberg平衡检验结果见表1。

表1 基因型分布的Hardy-Weinberg平衡检验
P>0.05,不能证明观测值和期望值两组数据有明显差异,所以,符合Hardy-Weinberg平衡定律,样本具有群体代表性。
2.2 PCR结果
PCR完成后,健康对照组产物电泳于400~500bp之间得到一条清晰的条带,SLE试验组于400~500bp之间得到一条清晰的条带,空白对照全程未查见条带。结果如图1所示。

注:1-3为SLE患者组,4-5为空白对照,6、8为健康对照组,7为marker;a为600bp,b为500bp,c为400bp d为300bp;A、B、C、D为412bp
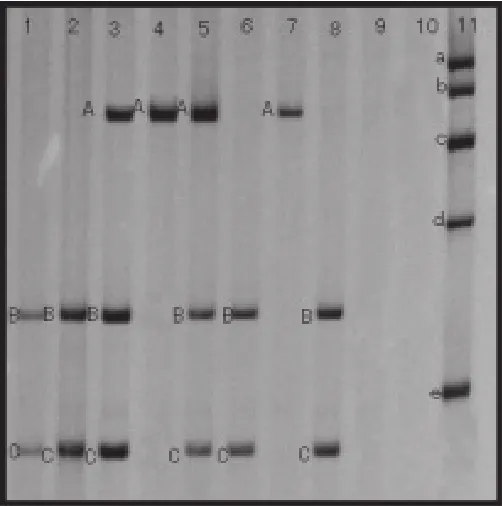
注:1~4为SLE患者组结果,5-8为健康对照组结果,9-10为空白对照,11为marker;a为600bp,b为500bp,c为400bp,d为300bp,e为200bp;A为412bp,B为236bp,C为176bp;1、2、6、8为AA基因型,3、5为AC基因型,4、7为CC基因型
2.3 酶切结果
酶切完成后,电泳得到三种不同的图像结果,籍此可以分为3种基因型,即AA、CC和AC。3种不同的基因型电泳图如图2所示。
2.4 基因型分布结果
根据酶切结果电泳图,基因型分布结果见表2。

表2 基因型分布结果
IL-10基因-592C/A位点的基因型分布(AA/AC/CC)在SLE患者组(46.9%,38.6%,14.5%)和健康对照组(37.5%,47.5%,15.0%)中差异无统计学意义(P>0.05)。
2.5 基因频率分布结果

表3 基因频率分布结果
等位基因频率在SLE患者组(A66.21%,C33.79%)和健康对照组(A61.25%,C38.75%)中差异无统计学意义(P>0.05)。
3 讨 论
动物实验研究发现,在lpr小鼠,由于Fas基因突变,细胞凋亡受到抑制,一些自身反应性细胞保留下来,可以促进自身抗体的产生,此即所谓狼疮素质。具有这种素质的个体,对狼疮易感,结合体外环境的诱发因素,在细胞因子的调节作用下,多克隆B细胞活化,形成一种狼疮环境并逐渐发展,引起机体一系列的免疫调节紊乱,表现为疾病状态。在此狼疮环境形成的过程中,细胞因子扮演着举足轻重的角色,尤以IL-10为著。人们发现体内IL-10水平的不同会导致个体对某些疾病的易感性、发病年龄及疾病严重程度的不同。孪生胎家系研究表明,IL-10的分泌水平75%是由遗传决定的,而且主要受转录水平的控制。单核苷酸多态性是最常见的DNA序列多态性,21世纪初以来,人们对一单核苷酸多态位点进行了广泛研究。在整个IL-10基因上,从5’非翻译区的启动子序列到3’非翻译区存在着大量的SNP位点。其中启动子区域-108、-819、-592位置的SNP是研究的热点。启动子负责与调节基因表达调控的因子相结合,其碱基的改变会直接影响基因的转录和表达。
近年来,人们对不同的SNP或单体型与疾病的易感性和严重性之间的联系进行了广泛研究。Eskdale等[21]研究发现,高加索人群中IL-10的基因多态性与SLE相关。Gibson等[22]也发现非裔美国人群中IL-10启动子区的单核苷酸多态性与SLE相关。Chen等[23]通过检测IL-10基因启动子区域3个SNPs-1082、-819、-592的基因型和单倍型发现:3个SNPs的单倍型在SLE患者和正常人中差异有显著性。王美美等[24]研究发现,SLE患者外周血单个核细胞分泌Th2型细胞因子IL-10的水平较正常人增高,且增高程度与SLE病情活动性相关。黎莉等[25]对未经药物治疗的初发SLE患者和正常人的IL–10 mRNA及其受体表达的研究发现,初发SLE患者IL-10mRNA与正常人无明显差异,但IL-10R表达明显升高。Shen等[23]研究发现:中国SLE患者中IL-10G138bp等位基因频率较正常人群有显著差异,对单一位点运用传递不平衡检验分析证实IL-10G138bp等位基因优先传递给受累子代。上述结果均提示IL-10基因是SLE重要的易感基因。
本文就IL-10基因-592C/A多态性与SLE易感性之间的关系展开研究,选取145例SLE患者和80例健康对照者的全血标本,提取基因组DNA,采用SNP的方法,分析基因型,用卡方检验的统计学方法检验得出SLE试验组(AA 46.9%:AC 38.6%:CC 14.5%)和对照组(AA 37.5%:AC 47.5%:CC 15.0%)基因型无显著性差异(P>0.05),基因频率试验组(A 66.21%:C 33.79%)和对照组(A 61.25%:C 38.75%)也无显著性差异(P>0.05)。本研究结果显示,IL-10-592C/A的多态性在SLE患者与健康对照者之间尚未发现显著性差异,表明IL-10-592C/A的多态性与SLE易感性可能无关,但它们与其他多个基因位点的连锁可能是导致SLE发病的原始基因缺陷之一。因此,IL-10与其他多个基因位点的连锁是进一步研究关注的重点。
[1]Kotzin BL.Systemic Lupus Erythematosus[J].Cell,1996,58(1):303-306.
[2]Moon UY,Park SJ,Oh ST,et al.Patients with systemic lupus erythematosus have abnormally elevated Epstein-Barr virus load in blood[J].Arthritis Res Ther,2004,6(4):295-302.
[3]Brogan BL,Olsen NJ.Drug-induced rheumatic syndromes[J].Curr Opin Rheumatol,2003,15(4):76-80.
[4]Alarcon-Segovia D,Alarcon-Riquelme ME,Cardiel MH,et al.Familial aggregation of systemic lupus ezythematosus,rheumatoid arthritis,and other autoimmune diseases in 1,177 lupus patients from the GLADEL cohort[J].Arthritis Rheum,2005,52(4):1138-1147.
[5]Deapen D,Escalante A,Weinrib L,et al.A revised estimate of twin concordance in SLE[J].Arthritis Rheum,1992,35(3):135-136.
[6]Priori R,Medda E,Conti F,et al.Familial autoimmunity as a risk factor for systemic lupus erythematosus and vice versa: a casecontrol study[J].Lupus,2003,12(10):735-740.
[7]Sachidanandam R,Weissman D,Schmidt SC,et al.A map of human genome sequence variation containing 142 million single nucleotide polymorphisms[J].Nature,2001,409(6822):928-933.
[8]Chong WP,Ip WK,Lau CS,et al.Association of interleukin-10 promoter polymorphisms with systemic lupus erythematosus[J].Genes Immun,2004,5(6):484-492.
[9]Siriboonrit U,Tsuchiva N,Sirikong M,et al.Association of Fcgamma receptor IIb and IIIb polymorphisms with susceptibility to systemic lupus erythematosus in Thais[J].Tissue Antigens,2003,61(3):374-383.
[10]Magnusson V,Johanneson B,Lima G,et al.Both risk alleles for FcgammaRIIA and FcgammaRIIIA are susceptibility factors for SLE: a unifying hypothesis[J].Genes Immun,2004,5(2):130-137.
[11]Barreto M,Santos E,Ferrira R,et a1.Evidence for CTLA4 as a susceptibility gene for systemic lupus erythematosus[J].Eur J Hum Genet,2004,12(8):620-626.
[12]Nath SK,Kilpatrick J,Harley JB.Genetics of human systemic lupus erythematosus: the emerging picture[J].Curr Opin Immunol,2004,16(6):794-800.
[13]Shin HD,Park BL,Kim LH,et a1.Common DNase I polymorphism associated with autoantibody production among systemic lupus erythematosus patients[J].Hum Mol Genet,2004,13(20):2343-2350.
[14]Ferreiros-Vidal I,Gomez-Reino JJ,Barros F,et al.Association of PDCD1 with susceptibility to systemic lupus erythematosus:evidence of popµLation-specific effects[J].Arthritis Rheum,2004,50(8):2590-2597.
[15]Sigurdsson S,Nordmark G,Goring HH,et al.Polymorphisms in the tyrosine kinase 2 and interferon regµLatory factor 5 genes are associated with systemic lupus erythematosus[J].Am J Hum Genet,2005,76(3):528-537.
[16]Hur JW,Shin HD,Park BL,et al.Association study of Toll-like receptor 9 gene polymorphism in Korean patients with systemic lupus erythematosus[J].Tissue Antigens,2005,65(3):266-270.
[17]Demirci FY,Manzi S,Ramsey-Goldman,et al.Association of a common interferon regµLatory factor 5 (IRFS) variant with increased risk of systemic lupus erythematosus[J].Ann Hum Genet,2007,71(Pt3):308-311.
[18]Brown KS,Nackos E,Morthala S,et al.Monocyte chemoattractant protein-1: plasma concentrations and A(-2518)G promoter polymorphism of its gene in systemic lupus erythematosus[J].J Rheumatol,2007,34(12):740-746.
[19]Xu J,Wang Y,Pan F,et al.Association of ACE gene polymorphism with genetic susceptibility to systemic lupus erythematosus in a Chinese popµLation: a family-based association study[J].J Rheumatol,2007,34(12):2408-2411.
[20]Kyogoku C,Langefeld CD,Ortmann WA,et al.Genetic association of the R620W polymorphism of protein tyrosine PHOSPHATASE PTPN22 with human SLE[J].Am J Hum Genet,2004,75(2):504-507.
[21]Eskdale J,Wordswoeth P,Bowman S,et al.Association between poly-morphisms at the human IL - 10 locus and systemic lupus erthematosus[J].Tissue Antigens,1997,49(6):635.
[22]Gibson AW,Edberg JC,Wu J.Novel single nucleotide polymerphisms in the distal IL-10 promoter affect IL-10 production and enhance the risk of systemic lupus erthematosus[J].J Immunonol,2001,49(8):3915.
[23]Shen Nan,Chen Shunle,Zhou Dun,et al.Confirm association between IL-10 alleles and SLE in Chinese lupus cohort by TDT approach[J].Arthritis Rheum,2000,43(5):S58.
[24]王美美,许桦,许晋.系统性红斑狼疮患者外周血单个核细胞分泌IL-10 IFN-γ水平的研究[J].中华风湿病学杂志,2002,6(1):28-30.
[25]黎莉,陈顺乐,沈南等.初发系统性红斑狼疮患者Th1/Th2及其调控因子IL–10、IL-12基因研究[J].中华风湿病学杂志,2002,6(1):13-17.
The Research of Genetic Association of Interleukin-10 Polymorphisms with Systemic Lupus Erythematosus
REN Xiao-ying1, LI Yan2, REN Li-lin3, WANG Li4, WU Yong-kang2*
(1 Department of Laboratory, Chengdu First People's Hospital, Chengdu 610041, China;
2 Department of Experimental Medicine, Huaxi Hospital of Sichuan University, Chengdu 610041, China;
3 Geriatrics Hospital of Chengdu, Chengdu 610041, China;
4 Department of Gynecology and Obstetrics, 452 Hospital of PLA, Chengdu 610041, China)
ObjectiveTo investigate the relationship between the polymorphism of IL-10 gene-592C/A and susceptivity of SLE.MethodsThe whole blood specimens of 145 SLE patients and 80 healthy control subjects were collected. All samples were extracted genomic DNA, got the distribution of IL-10 gene-592C/A polymorphism by using PCR, digested by restriction enzyme and electrophoresised.ResultsNo signifi cantly difference was found in IL-10 gene-592 C/A polymorphism between SLE patients and healthy controls (P>0.05).ConclusionIL-10 gene-592 C/A polymorphism have no association with susceptibility of SLE.
IL-10; Gene polymorphism; SNP; Systemic lupus erythematosus
R593.24
B
1671-8194(2011)04-0024-03
*通讯作者:E-mail: vipwyk@163.com

