肠道病毒EV71相关受体在人二倍体细胞KMB17表面的构成分析
刘馨,廖云
肠道病毒 EV71 主要感染消化道和呼吸道,然后通过血管运送至其他器官产生病毒血症。在病毒与血管平滑肌细胞的相互作用过程中,可以导致血管壁细胞的坏死和血管炎。这种炎症的产生,与病毒上调或抑制某些基因的表达,从而诱导产生的急性免疫反应有关。EV71 上调血管细胞间黏附分子VCAM-1 表达,在小鼠血管平滑肌细胞中,EV71感染可通过诱导血小板衍生生长因子受体(platelet derived growth factor receptor,PDGFR)磷酸化,而刺激 VCAM-1 的表达[1]。另外的研究发现,EV71感染人微血管壁细胞后,能够诱导 Toll 样受体 4(Toll like receptor,TLR4)的表达[2]。
人二倍体细胞 KMB17 是理想的疫苗生产用细胞基质,肠道病毒 EV71 能适应于 KMB17 细胞,并产生裂解性感染。KMB17 细胞表面 EV71相关的受体构成情况如何?这些受体的构成是否与 EV71 病毒能有效适应于 KMB17 细胞有关?为了回答上述两个问题,本文选用了与 EV71 感染相关的 TLR4 和 PDGFR-αR1 两种细胞表面受体作为研究对象,利用流式细胞分析(FACS)、实时定量 PCR(real-time PCR)等技术对这两种受体在KMB17 细胞表面的表达情况以及受体特异的mRNA 片段进行了检测,分析了不同细胞代次、不同细胞周期时段及病毒感染前后这两种受体的表达情况。
1 材料与方法
1.1 材料
1.1.1 试剂材料 KMB17 细胞、EV71 病毒株为中国医学科学院医学生物学研究所保存;单克隆抗体 PDGFR-αR1(FITC 标记,sc-32287)、TLR4(PE标记,sc-13593)购自美国 Santa Cruz公司。SYBR Premix Ex Taq™ II、Prime-script RT-PCR 试剂盒、碘化丙啶(PI)、Trizol 购自大连宝生物工程有限公司;DMEM 培养基购自美国 Hyclone 生物技术公司。
1.1.2 仪器 Prism 7500 实时定量 PCR 仪购自于美国 ABI 公司;FACSCanto II 流式细胞仪为美国 BD 公司的产品。
1.2 方法
1.2.1 PCR 引物 使用 NCBI Primer-BLAST 设计了 PDGFR-αR1、TLR4 特异基因片段的引物,由上海生工科技有限公司合成,序列分别如下:
PDGFR-αR1 上游:5’ CATGTCTGAAGAAGA GAGCTCCGAT 3’;PDGFR-αR1 下游:5’ AGTTGT GCGACAAGGTATAATGGCA 3’;TLR4 上游:5’ A CTTATCAATGCATGGAGCTGAATT 3’;TLR4 下游:5’ TTCTGTAAACTTGATAGTCCAGAAA 3’。同时设立了 β-actin 引物:β-actin-S:CTCTTCCAG CCTTCCTTCCT;β-actin-AS:AGCACTGTGTTGG CGTACAG,片段大小为 116 bp。
1.2.2 KMB17 细胞周期的检测 使用血清饥饿法进行细胞周期的同步化,用0.1% 的 PI 染色后,对不同细胞周期时段的 KMB17 细胞中的 DNA进行染色和流式细胞分析。具体如下:细胞传代后,长至 30% 左右,将培养基更换为无血清培养基,24 h 后,再加入血清培养。以血清饥饿后,再次加入血清培养的时间作为 0 点,按 6、12、24、30、48、60、72 h 分别取 KMB17 细胞进行 PI 染色和检测。按 106个/ ml细胞重悬细胞,使用 95% 乙醇于 4 ℃ 固定 1 h 后,离心去除乙醇,用 50 μg/ml的 RNaseA 于 37 ℃ 作用 30 min,PBS 清洗后加入 1 ml PI,于 4 ℃ 染色 30 min 后,清洗,用500 μl PBS 重悬后检测。
1.2.3 不同周期时段 KMB17 细胞表面 EV71 相关受体检测 取不同细胞周期时段的等量(106个)KMB17 细胞,用上述相关的抗体直接标记后,做流式细胞分析。
1.2.4 不同代次 KMB17 细胞表面 EV71 相关受体检测 用如上方法,对第 23、25、27、28、30、31 和 33 代的 G0/G1 期 KMB17 细胞进行了检测。
1.2.5 EV71 感染前后相关受体表达的变化 用EV71 病毒接种第 27 代 KMB17 细胞,使 m.o.i =1,吸附 0.5 h 后,加入有 5% 血清的 DMEM 培养基培养 12 h 后,按上述方法用荧光抗体标记,进行 FAC 检测,与未感染病毒的细胞进行比较。
1.2.6 Real time PCR检测 提取不同细胞周期的KMB17 细胞的 RNA,用 oligo DT 通用引物合成cDNA,以上述引物进行 real-time PCR 反应。具体反应步骤按相关的说明书操作。
2 结果
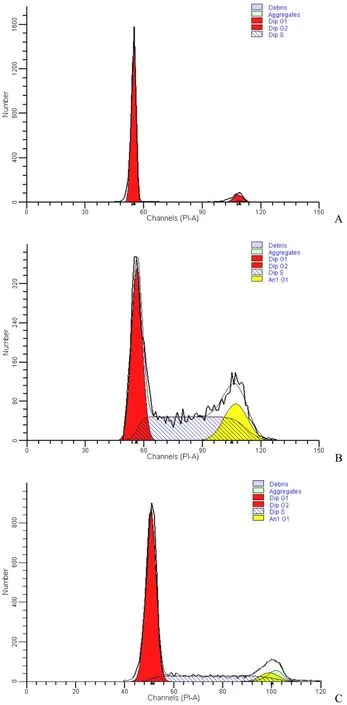
图 1 血清饥饿法同步化后不同时间点 KMB17 细胞的 PI染色检测细胞周期时间段(A:G0/G1 期;B:S 期;C:G2/M期)Figure 1 PI-stain at different time points of KMB17 cells released from serum starvation synchronization. (A: G0/G1 phase; B: S phase; C:G2/M phase)

图 2 流式细胞仪检测第 27 代 KMB17 细胞在 EV71 感染前后表达 TLR4 和 PDGFR-αR1 的阳性细胞比率(A:使用PE 标记抗 TLR4 抗体,感染前 12 h;B:使用 PE 标记抗 TLR4 抗体,感染后 12 h;C:使用 FITC 标记抗 PDGFR-αR1抗体,感染前 12 h;D:使用 FITC 标记抗 PDGFR-αR1 抗体,感染后 12 h)Figure 2 Anti-PDGFR-αR1-FITC mAb or anti-TLR4-PE mAb marked the 27th passage KMB17 cells detected by FAC before or after EV71 infection (A: PE conjugated anti-TLR4 Ab, 12 hours before infection; B: PE conjugated anti-TLR4 Ab, 12 hours post infection; C: FITC conjugated anti-PDGFR-αR1 Ab, 12 hours before infection; D: FITC conjugated anti-PDGFR-αR1 Ab, 12 hours post infection)
利用流式细胞仪研究了 KMB17 细胞的周期,对不同周期时段细胞表面的 TLR4、PDGFR-αR1的表达情况进行了检测;利用 real-time PCR 对不同细胞周期时段 TLR4、PDGFR-α 特异的 mRNA片段进行了检测。使用流式细胞仪一共做了 18 次检测,研究表明,KMB17 细胞在使用血清饥饿法进行 G0/G1 同步化后约 22 h 进入 S 期,在 36 h左右进入 G2 期,在 48 h 左右完成分裂。PDGFR-αR1、TLR4 平均阳性细胞的比例分别为 4.47% 和11.82%;不同细胞周期时段、细胞的不同代次对2 种受体阳性细胞的比例影响不大;EV71 病毒感染后,PDGFR-αR1 及 TLR4 阳性的细胞比率无明显变化。
2.1 KMB17 的细胞周期
KMB17 细胞在使用血清饥饿法进行 G0/G1同步化后,约 22 h 进入 S 期,约 36 h 进入 G2期,在 48 h 左右完成分裂。于是将 KMB17 的细胞周期初步的划分为:G0/G1 同步化后,0 ~ 22 h为 G0/G1 期,22 ~ 36 h 为 S 期,36 ~ 54 h 为G2/M 期。在这 3 个时段,分别取 6、24、48 h 三个点作为检测点(图 1)。
2.2 不同周期时段 KMB17 细胞表面 EV71 相关受体的表达
在 G0/G1 期,通过 FACS 检测,PDGFR-αR1、TLR4 的平均阳性细胞比例分别为 4%、8.9%;在S 期,分别为 2.6%、9%;在 G2/M 期,分别为4.4%、13.5%。
2.3 不同代次 KMB17 细胞表面 EV71 相关受体检测
使用了第 23、24、25、27、28、30、31 和33 代的 KMB17 细胞。不同代次细胞表达 2 种受体的阳性细胞率差别不大。
2.4 EV71 感染前后相关受体表达的变化
EV71 感染后处于 G0/G1 期的第 27 代KMB17 细胞(感染前记为 27b,感染后记为 27a),PDGFR-αR1 的阳性细胞比率有所上升,由 2.6%上升至 4.0%;TLR4 阳性细胞比率分别为 11.8%和 12.6%(图 2)。
2.5 Real-time PCR检测不同细胞周期时段各受体mRNA 的表达
使用 RT-PCR 检测了 KMB17 细胞中 TLR4和 PDGFR-αR1 目的片段cDNA(图 3,核酸电泳图)。利用 real-time PCR 检测了不同细胞周期时段,这 2 种受体 mRNA 的相对表达情况,在总RNA 保持恒定的情况下,PDGFR-αR1 与 TLR4的相对表达量(图 4,图 5)。

图 3 RT-PCR 检测人二倍体细胞中 TLR4 及 PDGFR-αR1 cDNA 片段Figure 3 cDNA fragments detection of TLR4 and PDGFR-αR1 in human diploid cell KMB17 by RT-PCR

图 4 Real-time PCR 检测不同细胞周期 KMB17 细胞中PDGFR-αR1(A)和 TLR4(B)cDNA 片段的相对量Figure 4 Relative quantity of PDGFR-αR1 (A) and TLR4 (B)cDNA fragmentS in KMB17 cells of different cell cycle phases detected by real-time PCR
3 讨论
根据 GENECARDS(http://www.genecards.org)数据库资料,人肺组织表达 PDGFR、TLR4、integrins 等受体,其中 PDGFR、TLR4 与肠道病毒 EV71 的感染相关。疫苗生产用 KMB17 细胞是来自于人胚肺的二倍体细胞,不同的病毒对KMB17 细胞的适应能力存在差异,而肠道病毒EV71 能够有效地在 KMB17 细胞上产生裂解性增殖,可能与细胞表面表达相应的受体有关。本文的研究表明 KMB17 细胞表面表达 PDGFR-αR1、TLR4 这两种受体;在 KMB17 细胞的生产许可代次(23 ~ 33 代)之内,表达两种受体的细胞阳性率差异不明显;PDGFR-αR1 在 G0/G1 期表达较高,TLR4 在 G2/M 期表达较高。EV71 感染后,表达 PDGFR-αR1、TLR4 的阳性细胞率有所上升,但差异不大。文献[2]报道 EV71 感染后诱导TLR4 在人微血管壁细胞表达,但在 KMB17 细胞中没有观察到明显的 TLR4 表达的变化,这可能与这两者细胞类型的不同有关。
同时我们检测了 G0/G1 期人二倍体细系WI38 表面的 TLR4 和 PDGFR-αR1 的表达情况,分别为 15.7% 和 1.7%,人二倍体细胞系 IMR90表面的 TLR4 和 PDGFR-αR1 的表达情况,分别为 4.6% 和 7.4%,存在一定的差异,但两种受体在不同的人二倍体细胞中相对量多寡一致。
图 5 Real-time PCR 循环图Figure 5 Real-time PCR cycle
根据报道,A1、A2 型腺苷受体(A1 adenosine,A2 adenosine)的拮抗剂在人肌肉瘤细胞上有抗EV71 复制子增殖的作用[3]。我们使用 RT-PCR 没有在 KMB17 细胞中检测到 A1 Adenosine,A2 Adenosine 的特异的 mRNA 片段。
对 EV71 敏感的人横纹肌肉瘤细胞(rhabdomyosarcoma cells)感染 EV71 后的mRNA 差异显示分析表明,与细胞膜相关,又显著变化的基因有 4 种膜蛋白:膜蛋白 RDEV064 180 BC002392,膜蛋白 palmitoylated 1(55 kD),Leukophysin(LKP)和神经元膜表面糖蛋白 M6b[4]。此外,EV71 还可通过DC-SIGN 的介导作用进入DC 细胞[5]。通过克隆表达法,对人 T 细胞 cDNA文库的筛选发现,CD126(human P-selectin glycoprotein ligand-1)是 EV71 病毒的功能性受体,但是这个受体是白细胞依赖性的,而且是病毒株型特异的[6],在其他非白细胞中,EV71 不依赖于 CD126 也能进行复制[7]。
最近的研究认为人清道夫受体家族 scavenger receptor B2(SCARB2 CD36 like 2)是 EV71 的一个细胞受体[8-9]。与 PDGFR-αR1 和 TLR4 相比,不同的是 SCARB2 与 EV71 最初的感染识别关系更为密切,而 PDGFR-αR1 与 TLR4 只是在病毒感染后诱导的免疫反应过程中相关,因此,正如本研究显示,在体外病毒的感染和繁殖过程中,由EV71 引起的这两种受体蛋白的变化也相对有限。对疫苗生产用人二倍体细胞 KMB17 而言,检测与病毒识别密切相关的受体蛋白的构成,如新近发现的 SCARB2,将更有助于阐明在生产应用实际过程中该细胞对不同的病毒的敏感性存在差异的问题。
[1] Tung WH, Sun CC, Hsieh HL, et al. EV71 induces VCAM-1 expression via PDGF receptor, PI3-K/Akt, p38 MAPK, JNK and NF-kappaB in vascular smooth muscle cells. Cell Signal, 2007,19(10):2127-2137.
[2] Liang CC, Sun MJ, Lei HY, et al. Human endothelial cell activation and apoptosis induced by enterovirus 71 infection. J Med Virol, 2004,74(4):597-603.
[3] Arita M, Wakita T, Shimizu H, et al. Characterization of pharmacologically active compounds that inhibit poliovirus and enterovirus 71 infectivity. J Gen Virol, 2008, 89(Pt 10):2518-2530.
[4] Leong PW, Liew K, Lim W, et al. Differential display RT-PCR analysis of enterovirus-71-infected rhabdomyosarcoma cells reveals mRNA expression responses of multiple human genes with known and novel functions. Virology, 2002, 295(1):147-159.
[5] Lin YW, Wang SW, Tung YY, et al. Enterovirus 71 infection of human dendritic cells. Exp Biol Med (Maywood), 2009, 234(10):1166-1173.
[6] Nishimura Y, Shimizu H. Identification of P-selectin glycoprotein ligand-1 as one of the cellular receptors for enterovirus 71. Uirusu,2009, 59(2):195-203.
[7] Nishimura Y, Shimojima M, Tano Y, et al. Human P-selectin glycoprotein ligand-1 is a functional receptor for enterovirus 71. Nat Med, 2009, 15(7):794-797.
[8] Yamayoshi S, Yamashita Y, Li J, et al. Scavenger receptor B2 is a cellular receptor for enterovirus 71. Nat Med, 2009, 15(7):798-801.
[9] Koike S. Identification of an enterovirus 71 receptor; SCARB2.Uirusu, 2009, 59(2):189-194.

