不同沸石吸附铅离子的对比研究*
, ,,
(1. 许昌学院化学化工学院,河南许昌 461000;2. 中国石化上海石油化工研究院)
重金属不能被降解,一旦进入水体或土壤中则很难排除,因此被世界众多国家列入优先控制的污染物。Pb2+是重金属离子污染中数量较大的一种,主要来源于矿山、冶炼、电池、油漆等工业以及汽车尾气,具有较强的毒性,尤其可毒害神经和造血系统,引起痉挛、神经迟钝、贫血等,是儿童健康的头号环境威胁,因此对环境中Pb2+的去除成为环境治理的重要内容。
废水中Pb2+的去除大多采用离子交换、化学沉淀、电解和生物吸附等方法 ,但是这些方法存在较多缺点,如处理容量低、试剂消耗大、成本高等,因此很难推广应用。同时,用壳聚糖、树脂、活性炭吸附铅离子则由于成本高、吸附剂不稳定等缺点也在应用方面受到限制[1]。近年来,沸石分子筛用于含铅废水吸附处理的研究尝试取得了良好的进展。该方法不仅达到了很好的铅去除效果,而且操作简单,原材料廉价易得,并且吸附后的沸石经简单的处理后可以循环利用[2]。目前,系统对比分析各类分子筛的吸附性能的研究尚鲜有报道。笔者采用商品化、较常用的3种沸石分子筛——ZSM-5、Y、Beta沸石进行吸附水中Pb2+的对比研究,旨在为工业处理含铅废水提供初步的理论依据和技术支撑。
1 实验部分
1.1 仪器及试剂
仪器:WFX-1F2B2 型火焰原子吸收分光光度计、HY-2型调速多用振荡器、DRZ-8D型马弗炉、SHZ-D(Ⅲ)型循环水式真空泵、pHS-3C精密pH计。
试剂:硝酸铅、硝酸、氢氧化钠,均为分析纯;ZSM-5、Y和Beta沸石(上海石油化工研究院提供),其物化性能见表1。3种沸石在实验前须在450 ℃下焙烧6 h以活化;去离子水(自制)。

表1 沸石的物化性能
1.2 实验方法
采用原子吸收分光光度法测定水中铅离子的质量浓度ρ(mg/L)。标准曲线中铅离子浓度与吸光度A的关系为:A=0.004 1ρ-0.004 1,其相关系数为0.998 384,符合要求。
准确称取一定量的沸石置于50 mL具塞锥形瓶中,向瓶中加入一定量的100 mg/L的硝酸铅标准溶液,用NaOH或HCl调节溶液的pH;将锥形瓶置于振荡器中,振荡吸附一定时间后,用循环水式真空泵抽滤,取一定量的上层滤液转移到100 mL的容量瓶中稀释定容。用原子吸收分光光度计测定溶液的吸光度(以下各条件实验均按此步骤进行),以确定滤液中残留的铅离子浓度。 按下列公式计算沸石对Pb2+的吸附率Q(%)和吸附量q(mg/g):
Q=(1-ρ1/ρ2)×100%
(1)
q=(ρ2-ρ1)/ρb
(2)
式中,ρ1为振荡吸附后滤液含铅离子的质量浓度,mg/L;ρ2为振荡吸附前硝酸铅溶液中含铅离子的初始质量浓度,mg/L;ρb为吸附剂的用量,g/L。
2 结果与讨论
2.1 吸附时间对吸附率的影响
固定ρ(Pb2+)=100 mg/L、pH为6、沸石投加量为8 g/L,在室温条件下振荡不同时间进行吸附实验。
图1为吸附率与吸附时间的关系。由图1可知,3种沸石对Pb2+的吸附机制基本符合溶液中的物质在多孔吸附剂上吸附过程经历的外扩散、内扩散和吸附等3个步骤。吸附反应初期,吸附率迅速上升,这是因为此时沸石对Pb2+的吸附主要发生在沸石的表面;随着吸附时间的延长,吸附率逐渐减缓,这是由于沸石对Pb2+进行吸附导致溶液中Pb2+的浓度降低,此时的吸附主要发生在沸石孔道的内表面;吸附质沿着沸石微孔向内部扩散,扩散阻力渐增,此时的吸附率主要受扩散速率的影响,导致吸附率变慢,到吸附后期,吸附已基本达到饱和[3]。总体上看,3种沸石在吸附140 min后基本上达到平衡,此时3种分子筛的吸附率都达到75%以上。为了确保充分吸附,以下实验中的吸附时间均固定为140 min。

图1 吸附时间对沸石吸附铅离子的影响
2.2 pH对吸附的影响
固定ρ(Pb2+)=100 mg/L、沸石投加量为8 g/L,改变pH,室温条件下振荡吸附140 min。
图2为沸石对Pb2+的吸附率随pH的变化关系。由图2可知,溶液pH对3种沸石的吸附率有较大的影响。总体上看,吸附率随溶液pH的升高而增加,但变化的快慢并不完全是线性的。溶液pH<7时,吸附率较低;当pH >7时,吸附率明显升高。这是由于溶液呈酸性时,铅主要以离子的形态存在,同时H+与Pb2+存在竞争吸附,因此吸附率较低;而当溶液呈碱性时,既存在吸附剂对铅离子的吸附,又伴随着Pb(OH)2的沉淀,因此吸附效果较好。为了消除Pb(OH)2沉淀的影响,实验保持溶液pH为6。该结果与文献[4-5]的报道一致。

图2 pH对沸石吸附铅离子的影响
2.3 吸附剂用量对吸附的影响
固定ρ(Pb2+)=100 mg/L、pH为6,加入计量的ZSM-5沸石(或Y、Beta沸石),在室温下振荡吸附140 min。
图3为吸附剂用量对吸附铅离子的影响。由图3可知,3种沸石的投加量对Pb2+的吸附的影响各不相同。Beta沸石的投加量几乎对Pb2+的吸附率无影响,这是因为增加沸石投加量时,虽然Beta沸石对Pb2+的绝对吸附量在增加,但吸附量与沸石投加量增加的程度基本相当,因此表现为吸附率几乎不随Beta沸石投加量的增加而变化,所以Beta沸石的投加量为4 g/L时即可达到很好的去除效果(铅吸附率可达94.4%)。而随着ZSM-5和Y沸石的投加量增大时,其各自的吸附率都有不同程度的增大趋势,但当Y沸石的投加量大于16 g/L时,Pb2+的吸附率基本保持不变,这主要是由于Pb2+吸附已达平衡;而ZSM-5沸石的用量相对于达吸附饱和时的用量偏少,随着ZSM-5沸石投加量的增加,其对Pb2+的吸附率增加程度要远远大于投加量的增加程度,即随着ZSM-5沸石的投加量的增加,其对Pb2+的吸附率逐渐升高。
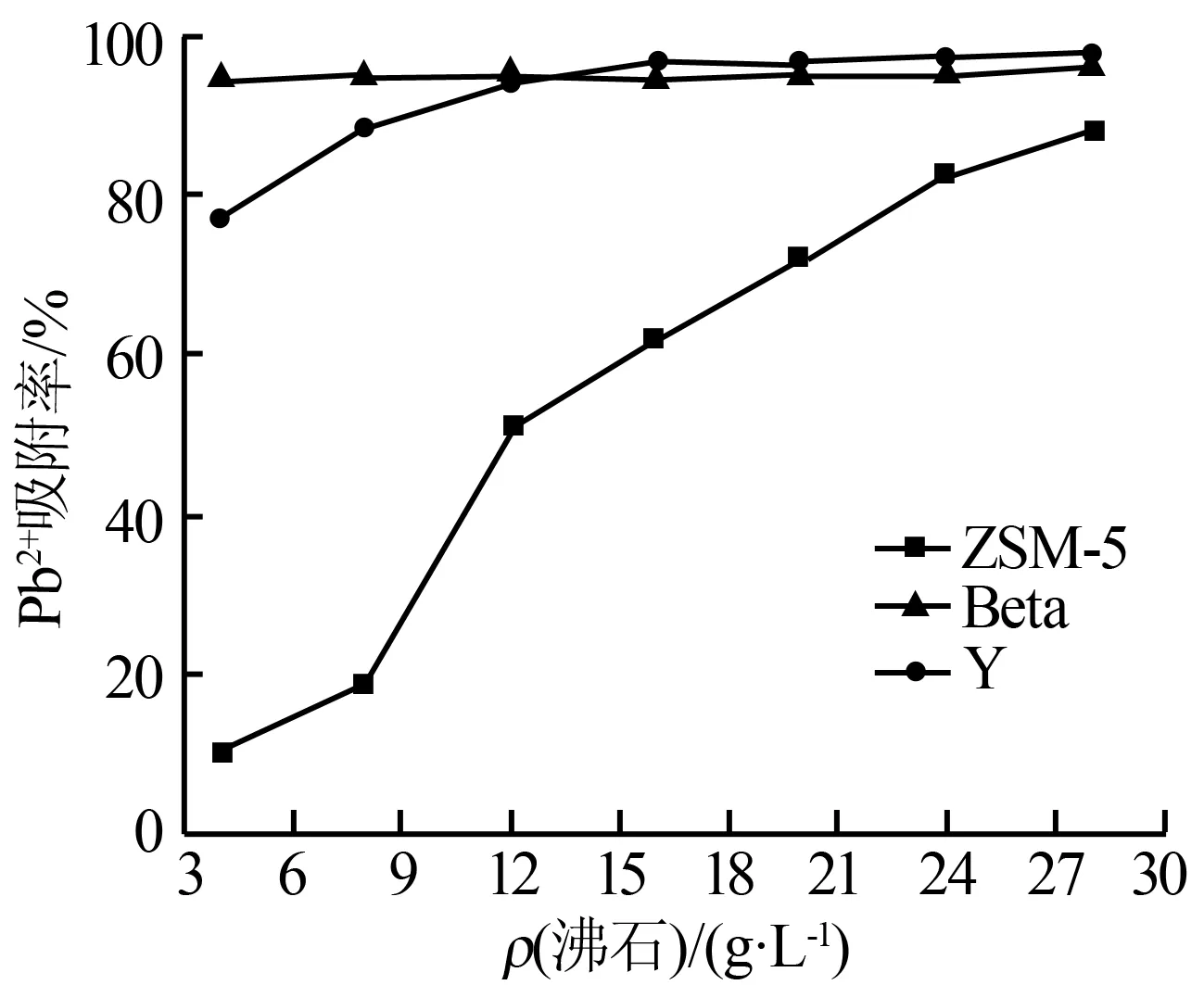
图3 吸附剂用量对吸附铅离子的影响
2.4 Pb2+初始质量浓度对吸附的影响
改变水溶液中Pb2+质量浓度,固定沸石的投加量为8 g/L、pH为6,在室温条件下振荡吸附140 min。
图4为铅离子初始质量浓度(ρ0)对沸石吸附铅离子的影响。由图4可见,当ρ0(Pb2+)=40 mg/L时,3种沸石对Pb2+的吸附率都达到95.03%以上,其中Beta沸石的吸附率达到了97.00%。随着铅离子初始浓度的增加,3种沸石对铅离子的吸附率逐渐降低,这主要是因为吸附剂的用量是一定的,当Pb2+的质量浓度较大时,其吸附量较大或已接近吸附平衡故使沸石对Pb2+的吸附率下降,此时可增加吸附剂的用量来提高吸附率。同时也发现,Beta沸石的吸附率要高于Y和ZSM-5沸石。

图4 铅离子初始质量浓度对沸石吸附铅离子的影响
上述4个条件考察结果表明,Beta沸石的吸附效果要优于Y和ZSM-5沸石。
2.5 沸石吸附铅离子的吸附等温线
室温下,固定其他条件不变,测定了不同平衡质量浓度时Pb2+在ZSM-5、Y和Beta沸石上的吸附量,以平衡吸附量q(mg/g)对平衡时溶液中铅离子的质量浓度ρ(mg/L)作图,得到等温吸附曲线,结果见图5。从图5可看出,Beta沸石在平衡质量浓度较低时就使吸附量达到较高的水平,而ZSM-5和Y沸石则经过了一个缓慢升高直至基本不变的过程,说明Beta沸石内部对Pb2+吸附较快,扩散因素较小,与前述实验现象和结论相符。将数据作适当的变换后,用Freundlich等温方程和 Langmuir等温方程拟合,即得吸附等温线[3]。

图5 平衡浓度对沸石吸附铅离子的影响
Langmuir 等温方程:
1/q=1/Q0+1/(Q0KLρ)
(4)
式中:Q0为饱和吸附量,mg/g;KL为Langmuir常数,mg-1。
Freundlich 等温方程:
lnq=lnKF+(lnρ)/n
(5)
式中:KF和n为Freundlich常数。
将图5中的数据分别代入Langmuir等温方程和Freundlich等温方程,并进行线性拟合,求相关性R。Langmuir和Freundlich等温方程的拟合曲线如图6所示,直线方程和相关性R见表2。

a—Langmuir;b—Freundlich

沸石种类Langmuir等温方程RFreundlich等温方程RZSM-51/q=0.08323+0.009536(1/ρ)0.98688lnq=0.19249+1.36620lnρ0.99626Y1/q=0.08421+0.009648(1/ρ)0.99117lnq=0.31133+1.25448lnρ0.99768Beta1/q=0.08247+0.009449(1/ρ)0.99023lnq=0.55166+0.99611lnρ0.99822
图6和表2结果显示,ZSM-5、Y、Beta分子筛对铅离子的吸附实验数据与Freundlich和 Langmuir模型拟合得都比较好,回归结果呈良好的线性关系,其拟合相关系数均在0.986 88以上,表明Freundlich等温方程和 Langmuir等温方程都能较好地描述3种沸石对水溶液中铅离子的吸附规律。
2.6 讨论
从上述实验结果可知,Beta沸石的吸附性能最好,Y 沸石次之,ZSM-5最差。从表1沸石的物化性能可以看出,Y沸石具有最大的比表面积,Beta沸石次之,ZSM-5最小;Y和Beta沸石的孔径和吸附容量大小相当,而ZSM-5的孔径和吸附容量则较小;Y和Beta沸石具有相当的Na和Al含量,ZSM-5的Na和Al含量则最小。因此,ZSM-5具有最差的吸附性能显然归因于其相对较小的比表面积、孔径大小、吸附容量以及Na和Al含量。当然,Beta沸石的最佳吸附性能不能仅仅归因于这些物化性能,还可能是因为Beta沸石拥有直通型孔道,即只有孔道没有笼,所以可以进行阳离子全部交换,因此可吸附更多的金属离子[6]。
3 结论
1)3种沸石中,Beta沸石对水溶液中的Pb2+有很好的吸附去除效果。当其用量为4 g/L时,Beta沸石对水溶液中铅离子的吸附基本达到平衡,吸附率可达94.4%。2) 当Pb2+的初始质量浓度增大时,Pb2+的绝对吸附量增加,但吸附率降低。3) 吸附在140 min时达到平衡,溶液的pH对Pb2+的去除有显著影响,中性和碱性条件下的吸附率大于酸性条件下的吸附率。4) 对于3种沸石,平衡吸附量与吸附平衡质量浓度之间的关系较好地符合Freundlich和Langmuir等温吸附方程所描述的规律。
[1] 顾国梁.含铅废水治理的研究进展[J].山东建筑大学学报,2006,21(6):557-561.
[2] 陈彬,吴志超.沸石在水处理中的应用[J].工业水处理,2006,26(8):9-13.
[3] 李绍芬.化学与催化反应工程[M].北京:化学工业出版社,1990.
[4] 严刚,冯双青.活化沸石对水中铅离子的吸附性能[J].无机盐工业,2008,40(6):53-55,58.
[5] 郝鹏飞,梁靖,钟颖.改性沸石对含铅废水的处理研究[J].环境科学与管理,2009,34(6):106-108.
[6] 徐如人,庞文琴,等.分子筛与多孔材料化学[M].北京:科学出版社,2004:250-252.

