制备纳米二氧化铈粉体新工艺的研究
郭立峰, 李丽华, 张金生
(辽宁石油化工大学石油化工学院,辽宁抚顺113001)
纳米量级的材料因其具有量子效应、小尺寸效应和表面效应,被广泛应用于许多领域,例如新能源材料、催化、光电能转换等。CeO2是一种廉价的材料,并且用途很广泛,主要应用在玻璃抛光剂、紫外吸收材料、电子陶瓷和燃料电池等方面[1-4]。因此,纳米CeO2成为当今材料科学研究的热点。目前,纳米CeO2的主要合成方法有:溶胶-凝胶(Sol-Gel)法[5]、化学共沉淀法[6]、沉淀法[7-8]、醇热合成法[9]、水热法以及燃烧法等[10-12]。制备纳米二氧化铈粉体的燃烧法通常为液相燃烧法,本实验则采用固相燃烧法制备纳米二氧化铈[13-15],并对所得到的产物进行了表征分析。
1 实验部分
1.1 主要试剂及仪器
试剂:硝酸铈(Ce(NO3)3·6H2O,国药集团化学试剂有限公司),柠檬酸(C6H8O7·2H2O,天津市光复科技发展有限公司),均为分析纯。实验用水为二次蒸馏水。
仪器:4-10型马福炉,WQF-520型傅立叶变换红外光谱仪(北京瑞利分析仪器公司);UV1100紫外分光光度计(上海天美科学仪器公司);SDT2960差热-热重联用分析仪(日本理学仪器厂);D/max-2500型全自动旋转靶X-射线衍射仪(日本理学仪器厂);JEM2100型高分辨透射电镜(日本JEOL公司)。
1.2 纳米二氧化铈粉体的制备
分别称取7.684 2g硝酸铈和2g柠檬酸,置于玛瑙研钵中混合,充分研磨1h,得到混合均匀的浆料状混合物。将浆料物用适量的去离子水溶解,待全部溶解后将其放入烘箱内,80℃干燥4h后放入马福炉内焙烧,在马福炉中按以下程序升温:以5℃/min升温速率从室温升到200℃,在200℃到220℃之间升温速率为1℃/min。在目标温度下保持2h,得到疏松泡沫状的多孔物。
1.3 纳米CeO2的表征
红外光谱测定条件:压片法,仪器分辨率为4 cm-1,检测器为MCT,检测范围为400~4 000 cm-1。紫外光吸收性能分析测定条件:用1cm比色皿,去离子水作为参比,测定纳米CeO2颗粒的水溶液在200~900nm的吸光度。差热-热重联用分析仪的测定条件:温度在34~600℃,在氮气(0.1 MPa)的氛围中以10℃/min的速率升温,对样品进行热稳定性分析。X射线分析测定条件:Cu Kα辐射,闪烁计数器前加石墨弯晶单色器,管电压为40 kV,管电流为80mA,测角仪半径为185mm,光阑系统为DS=SS=1°,RS=0.15mm,采用2θ步进行扫描,步长0.01°,扫描速度为8(°)/min。高分辨透射电镜分析测定条件:电子枪类型,LaB6枪;加速电压200kV;点分辨率0.14nm;最小束斑1.0nm;放大倍数50~1.5×106。
2 结果与讨论
2.1 反应物配比对制备纳米二氧化铈粉体的影响
图1为不同反应物配比(硝酸铈与柠檬酸物质的量比)在500℃下,焙烧2h后的生成物与标准CeO2的XRD。由图1可知,不同反应物配比的生成物谱图均与CeO2标准谱图(JCPDS No.81-792)基本吻合,说明这5种反应物配比均可以制备出纯度较高的CeO2,所以用平均粒径大小进一步选择最佳配比。CeO2的平均粒径D可利用X射线宽化分析法,根据测得的样品最强峰2θ值及半高峰宽,由Scherrer公式:D=KA/Bcosθ求出。式中:D为平均晶粒尺寸(nm);K为常数0.89;A为入射线波长15.41(nm);B为半高峰宽(弧度);θ为布拉格角(°)。由此计算出的平均粒径大小如表1所示。
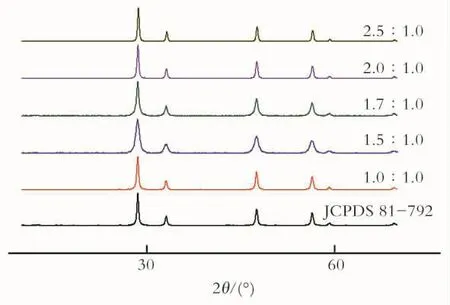
Fig.1 XRD patterns of CeO2at different ratios of cerium nitrate and citric acid图1 不同反应物配比焙烧生成CeO2的XRD

表1 不同反应物配比时合成产物的平均粒径Table 1 The relative pattern of the average crystal size at the different ratios of reactants
由表1可知,当配比为1.7∶1.0时,CeO2的平均粒径大小为15.2nm,此时的粒径为最小。为了进一步确定最佳的反应物配比,利用透射电镜(TEM)测定不同反应物配比在500℃下,焙烧2h生成CeO2的TEM,如图2所示。由图2可见,a,b和e发生团聚现象非常严重,使其粒径增大;而c和d则发生了轻微的团聚现象,且c的团聚最少,所以反应物的最佳配比为1.7∶1.0。


Fig.2 TEM patterns of CeO2at different ratios of reactants图2 不同反应物配比焙烧生成CeO2的TEM
2.2 焙烧温度对制备纳米二氧化铈粉体的影响
2.2.1 差热-热重分析 图3为纳米CeO2前躯体的TG-DTA。从图3中可以看出,温度从34℃开始升到185℃时,样品的质量缓慢减少,失重率为7.8%,是因为样品中自由水的蒸发和结晶水的分解,主要是结晶水的分解。而最大放热峰出现在215℃左右,对应于硝酸盐和柠檬酸之间的分解产物发生的氧化还原反应所带来的剧烈失重。因此,选择焙烧温度高于250℃。

Fig.3 The TG-DTA pattern of the precursor of CeO2图3 CeO2前躯体的TG-DTA
2.2.2 不同焙烧温度下生成CeO2的XRD 图4为前躯体在原料配比为1.7∶1.0时,于不同温度焙烧2h后的生成物与标准CeO2和Ce(NO3)3的XRD(JCPDS No.8 1-7 9 2和JCPDS No.1-137)。由图4可知,焙烧温度从300~800℃所制备的纳米CeO2均与纳米CeO2标准谱图(JCPDS No.81-792)基本吻合,说明从300~800℃均可得到纯度很高的纳米CeO2粉体。只有在焙烧温度为250℃时所得的XRD谱图有些小的杂质峰,经过分析,此杂质峰为Ce(NO3)3标准谱图的特征峰。说明在250℃时燃烧不完全。
为了进一步考察的纳米CeO2的性能,对不同焙烧温度下的产品进行平均粒径分析。由此计算出的平均粒径大小如表2所示。
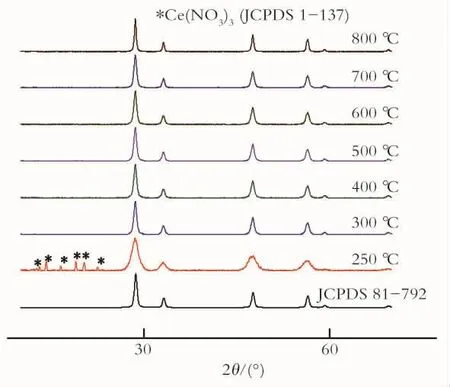
Fig.4 XRD patterns of CeO2at different alcination temperature图4 不同焙烧温度下生成CeO2的XRD
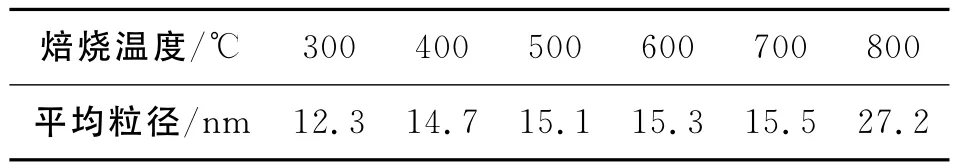
表2 不同焙烧温度时的平均粒径Table 2 The relative pattern of the average crystal size at the different calcination temperatures
由表2可知,焙烧温度在300℃时,CeO2平均粒径最小,随着焙烧温度的不断升高,粒径也不断增大。这主要是因为随着焙烧温度的不断升高,二氧化铈的晶粒发生了团聚,使二氧化铈的晶粒长大。
图5为300℃和400℃焙烧后生成纳米二氧化铈粉体的TEM。由图5可见,焙烧温度为300℃和焙烧温度为400℃所合成的CeO2均为不规则结构,且都有一定的团聚,焙烧温度为400℃时聚集程度更大。由图5中的插入图(10nm级)可知,焙烧温度为300℃的单个CeO2晶体粒径比焙烧温度为400℃的小,前者的粒径约为6nm,后者的粒径约为12nm。由此可知,随着焙烧温度的升高,纳米CeO2的团聚程度增大,从而使粒径增大。所以选择焙烧温度为300℃。

Fig.5 TEM micrographs of nano-cerium oxide powder at different calcination temperature图5 300℃和400℃焙烧后生成纳米二氧化铈粉体的TEM
2.3 焙烧时间对制备纳米二氧化铈粉体的影响
图6为前躯体在原料配比为1.7∶1.0,焙烧温度为300℃条件下,经过不同焙烧时间后的生成物与标准CeO2和Ce(NO3)3的XRD图(JCPDS No.81-792和JCPDS No.1-137)。
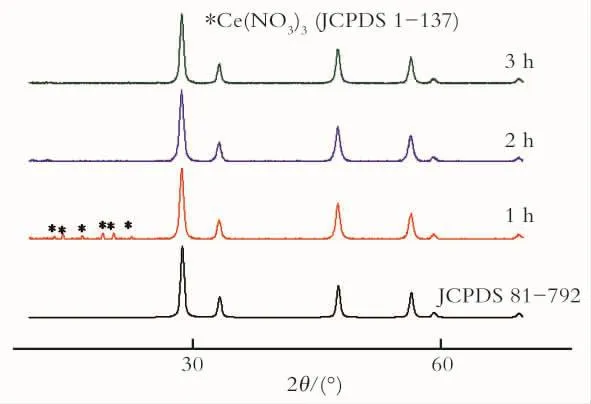
Fig.6 XRD patterns of CeO2with different calcination times图6 不同焙烧时间生成CeO2的XRD
从图6中可以看到,当焙烧时间为1h时,与CeO2标准XRD图相对比多了很多小峰,经过分析后得出,这些峰为Ce(NO3)3标准XRD图的特征峰。所以,在焙烧时间为1h时,得不到纯度很高的纳米二氧化铈粉体。而焙烧温度为2h的XRD图和焙烧温度为3h的XRD图与CeO2标准XRD图(JCPDS No.81-792)很吻合。但相比之下,前者的干扰小峰比后者少很多;由Scherrer公式:D=KA/Bcosθ求得,前者的平均粒径大小为15.1nm,后者则为15.5nm;再从节能方面来考虑,焙烧时间为2h的更经济,更省时。所以,焙烧时间2h为最佳焙烧时间。
综上所述,燃烧法制备纳米CeO2粉体的最佳反应条件为硝酸铈和柠檬酸物质的量之比为1.7∶1.0,焙烧温度为300℃,焙烧时间为2h。
2.4 纳米CeO2的红外光谱和紫外光吸收性能
图7为反应物配比为1.7∶1.0,焙烧温度为300℃和焙烧时间为2h时,所制备的纳米CeO2的红外光谱和紫外吸光。从图7(a)中可以看出,3 450 cm-1附近的强吸收峰为游离水中—OH键的伸缩振动,2 350cm-1附近的吸收峰为空气中CO2的吸收,1 650cm-1附近的吸收峰为水的变形振动吸收峰,730cm-1附近的红外弱峰和550cm-1附近的强红外吸收宽带为CeO2的特征峰。由文献[16]可知,CeO2的红外吸收峰是700cm-1附近的红外弱峰和400cm-1附近的强红外吸收宽带。这主要是由于以下几点因素造成的[17]:(1)量子尺寸效应的影响。纳米CeO2的粒径太小,使费米能级附近的能级间隙变宽,从而引起其吸收带向短波长移动,发生蓝移。(2)晶格畸变引起红外光谱变化。纳米CeO2的粒径太小,界面所引起的对晶粒组元的负压强使得晶粒结构发生变化从而引起晶格畸变,晶格常数变小,键长的缩短会导致化学键力常数增大,从而引起红外吸收峰的蓝移。(3)表面效应使得红外光谱发生变化。纳米CeO2的粒径太小,表面原子配位不饱和,因此存在大量的悬空键,产生的离域电子在表面和体面之间重新分配,使键强度增加,化学键力常数增大,从而导致红外光谱的蓝移。
从图7(b)中可以看出,在260~400nm出现了一个较宽的峰,所以纳米CeO2在UVB(280~320 nm)波段和UVA(320~400nm)波段具有良好的紫外光吸收性能。且吸收边界扩展到了400nm以外[18],说明纳米CeO2在可见光区域也具有良好的光透过性。
3 结束语
(1)以硝酸铈和柠檬酸为原料,按配比为1.7∶1.0(物质的量比),经过简单的研磨后得到的前躯体,在300℃下焙烧2h后合成CeO2纳米粉体。所制备的纳米CeO2的平均粒径大小约为6nm,且纯度较高。在这3个影响因素中,温度和时间对纳米CeO2的合成影响较大。
(2)此合成方法是一种新型的燃烧法。与化学共沉淀法、沉淀法、水热合成法和溶胶-凝胶法相比,此固相燃烧法具有易于操作、环保、所制备出的产品粒径小等特点。
(3)由于所合成的CeO2纳米粉体具有良好的紫外光吸收性能、且粒径小,所以可以很好的添加到防晒化妆品中,也可以添加到太阳伞和涂料等一系列产品中,具有广泛的应用前景。
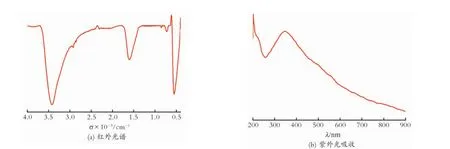
Fig.7 Infrared and UV-Vis spectrum of CeO2图7 CeO2的红外光谱与紫外光吸收
[1] He Y J.Nanostructured CeO2microspheres synthesized by a novel surfactant-free emulsion[J].Powder technology,2005,155:1-4.
[2] Dong Xiaoting,Qu X G,Hong G Y,et al.Preparation and application in electrochemistry of nanocrystalline CeO2[J].Chin.sci.bull,1996,41(16):1396-1401.
[3] 徐研,王春云,杨中辰.CeO2紫外吸收玻壳中的应用研究[J].中国稀土学报,2007,28(3):93-95.
[4] 王小康,唐电,张腾.纳米二氧化铈的研究现状[J].国外金属热处理,2003,24(6):11-12;29.
[5] 刘志平,胡社军,黄慧民,等.溶胶-凝胶法制备纳米二氧化铈的工艺研究[J].无机盐工业,2008,40(11):31-33.
[6] 韦薇,杨冬霞,杨申明,等.化学共沉淀法制备纳米二氧化铈的研究[J].中国稀土学报,2009,30(5):19-21.
[7] Qiu K H,Wang Y R,Zhang P C,et al.Preparation of CeO2nanophoyocatalyst using precipitation method mater[J].Sci.forum,2007,119:544-545.
[8] 董相廷,李铭,张伟,等.沉淀法制备CeO2纳米晶与表征[J].中国稀土学报,2001,19(1):24-26.
[9] Zhang X L,Zhang X C,Wang X Y,et al.Alcohothermal synthesis and properties of ceria nanoparticles[J].J.of Zhengzhou university,2007,39(3):145-149.
[10] Masui T,Hirai H,Imanaka N,et al.Synthesis of cerium oxide nanoparticles by hydrothermal crystallization with citric acid[J].J.mat.sci.lett.,2002,21(6):489-494.
[11] 吴苗红,刘静,杨学敏,等.燃烧剂对燃烧法合成CeO2纳米粉体的影响[J].浙江大学学报,2009,36:309-311,317.
[12] 胡涛,杨建,赵军,等.尿素燃烧法制备Cu-Ce-O催化剂用于消除CO[J].催化学报,2007,28(10):844-846.
[13] 娜仁图雅,莎木嘎.燃烧法制备纳米ZnFe2O4及其性能研究[J].内蒙古师范大学学报,2009,38(2):187-190.
[14] 盖广清,董相廷,王进贤,等.室温固相反应法制备CeO2纳米晶[J].稀有金属材料与工程,2007,36(3):437-439.
[15] 周国华,廖世焱,万端极.燃烧法制备纳米ZnO及光催化降解甲基橙的研究[J].化学工程师,2009(11):16-19.
[16] Mcdevitt N T,Baun W L.Characterization of Fe3O4magnetic particles with temperature sensity[J].Spectrochimica acta.,1964,20(5):799-808.
[17] 李莉娟,孙凤久,楼丹花,等.纳米氧化铝的晶型及粒度对其红外光谱的影响[J].功能材料,2007,38(3):479-480;484.
[18] Shinryo Yabe,Mika Yamashita,Shigeyoshi Momose,et al.Synthesis and UV-shielding properties of metal oxide doped ceria via soft solution chemical processes[J].Journal of inorganic materrials,2001,3(7):1003-1008.

