宫颈癌放疗抗拒与缺氧诱导血管新生的关系
戴钰辉, 张鹏程 (河北北方学院附属第一医院放射科, 张家口 075000;河北北方学院附属第一医院普外科)
宫颈癌放疗抗拒与缺氧诱导血管新生的关系
戴钰辉1, 张鹏程2(1河北北方学院附属第一医院放射科, 张家口 075000;2河北北方学院附属第一医院普外科)
目的 研究宫颈癌放疗后抗拒与肿瘤缺氧诱导血管新生的关系及意义。 方法 选择91例Ⅱb-Ⅳ期不同组织分级的宫颈癌放疗患者。标本采集后用10%甲醛固定,常规石蜡包埋,4 μm连续切片,应用免疫组化方法检测了91例宫颈癌组织中HIF-1α、COX-2、VEGF的阳性表达,同时标记CD105肿瘤新生血管,计算MVD。统计学处理应用SPSS16.0统计软件进行分析,结果采用卡方检验、方差分析进行统计学分析,HIF-1α、COX-2、VEGF及CD105相关性用Spearman等级相关分析。 结果 随着组织分化程度降低,肿瘤的放疗抗拒增大。HIF-1α、COX-2、VEGF在高分化、中分化、低分化宫颈癌中的阳性表达逐渐升高,HIF-1α、VEGF与MVD之间存在正相关,且随组织分级的降低,MVD的计数逐渐增加,差异有统计学意义(P<0.05)。结论 肿瘤缺氧环境诱导多个因子表达升高,促进肿瘤血管新生,新生的肿瘤血管与不同组织分级的宫颈癌产生放疗抗拒呈正相关,产生放疗抗拒的大小也不同。
HIF-1α;COX-2;VEGF; 肿瘤血管新生; 放疗抗拒
宫颈癌是妇科常见恶性肿瘤之一,放射治疗是宫颈癌临床治疗的主要手段[1]。宫颈癌放疗后产生抗拒,直接影响到治疗的疗效,但放射治疗产生抗拒的机制不清楚。肿瘤血管新生为肿瘤提供氧和养分,使肿瘤生长、繁殖甚至更具侵袭性[2],推测可能与肿瘤对放疗抗拒有关。低氧诱导因子1α(hypoxia-inducible factor-1α,HIF-1α)、COX-2、血管内皮生长因子(vascular endothelial growth factor,VEGF)阳性表达与肿瘤缺氧和血管新生相关,本实验通过检测三种因子在不同组织分级的宫颈癌的阳性表达,并计数微血管密度(MVD),以期为宫颈癌放射治疗后的转归提供理论参考。
1 材料与方法
1.1 研究对象 从2007-10~2009-10在河北北方学院附属第一医收治的宫颈癌病例中选择91例术前未经过放疗、化疗的宫颈癌术后肿瘤组织石蜡标本,具有完整的临床病理资料。年龄26-68岁,平均年龄46岁。病理分级:高分化鳞癌18例、中分化鳞癌36例、低分化鳞癌37例。
1.2 试剂及来源 兔抗人HIF-1α、VEGF多克隆抗体、鼠抗人COX-2单克隆抗体、抗CD105单抗体,SP法试剂盒,MVD计数法。
1.3 实验方法 患者均采用直线加速器外照射全盆腔,总量DT 50 Gy/25次/5周(DT 30-35 Gy时中线遮挡4 cm);3周时,高剂量率内照射(铱-192),DT 5-7 Gy/次,每周一次,5-7周。A 点剂量:内照射2/3、外照射1/3;B点剂量内照射1/3,外照射2/3。放射治疗前,均经宫颈取材SP法免疫组化,医师阅片、核实、诊断。
1.4 判定标准 光镜下观察,HIF-1α和VEGF表达阳性为细胞质染色呈棕黄色颗粒,COX-2阳性染色表现在肿瘤细胞的胞膜、胞质内,呈弥漫性均匀棕黄色颗粒。根据阳性细胞所占比例及着色强度综合制定免疫组化半定量记分标准为:①阳性细胞记分:<1%,0分;1% -10%,1分;11% -50%,2分;51% -80%,3分;>80%,4分。②着色强度记分:弱,1分;中,2分;强,3分。两个分值相加为最终判定结果:1分(-);2-3分(+);4-5分(++);6-7分(+++)。0-3分为低表达,视为阴性;4-7分为高表达,视为阳性。
根据1979年WHO(World Health Organization)实体瘤近期客观疗效标准测量病变,完全缓解、部分缓解评定为放疗敏感,无变化、恶化评定为放疗抗拒。
1.5 微血管计数判定标准 任何被CD105抗体染成棕黄色孤立的内皮细胞或内皮细胞簇团,只要与邻近微血管、肿瘤细胞或其他结缔组织分开,就将其作为一个微血管,只要结构不相连,其分支结构也视为一血管。微血管密度(MVD)记数参照Weidner[3]报道的方法,以±s表示。
1.6 统计学分析 所有数据应用SPSS16.0统计软件进行分析。数据用±s进行描述,采用卡方检验、方差分析进行分析,HIF-1α、VEGF、COX-2 及CD105相关性用Spearman等级相关分析。P<0.05被认为差异有统计学意义。
2 结果
2.1 放疗抗拒 结果显示,在不同组织分级的宫颈癌中均存在放疗抗拒。而且随着组织分化程度降低,肿瘤的放疗抗拒增大(见表1)。
2.2 HIF-1α蛋白的表达 HIF-1α表达主要定位于细胞质,着色呈棕黄色。37例低分化鳞癌有26例呈阳性表达,阳性率70.1%,36例中分化鳞癌有20例呈阳性表达,阳性率55.6%。18例高分化鳞癌变有8例呈阳性表达,阳性率44.4%,表明HIF-1α的表达在低分化鳞癌与中分化鳞癌比较有统计学差异(P<0.05);低分化鳞癌与高分化鳞癌比较有统计学差异(P<0.05);中分化鳞癌与高分化鳞癌比较有统计学差异(P<0.05,见表1)。

表1 HIF-1α、VEGF与COX-2在不同组织分级的宫颈癌中的表达与疗效的关系Tab 1 Relationship between the expression of HIF-1α,VEGF,COX-2 in different histological grading of cervical cancer and curative effect
2.3 VEGF蛋白的表达 在肿瘤组织中,VEGF阳性表达主要定位于肿瘤组织的细胞质和细胞膜上,呈棕色或棕黄色。VEGF在低分化鳞癌、中分化鳞癌、高分化鳞癌组织阳性表达率分别是86.4%(32/37),75.0%(27/36),61.1%(11/18),VEGF 在低分化鳞癌、中分化鳞癌、高分化鳞癌的表达两两比较差异均有统计学意义(P<0.05,见表1)。
2.4 COX-2蛋白的表达 COX-2阳性染色表现在肿瘤细胞的胞膜、胞质内,呈弥漫性均匀棕黄色颗粒。COX-2在低分化鳞癌、中分化鳞癌、高分化鳞癌组织阳性表达率分别是 40.5%(15/37),30.6%(11/36),16.7%(3/18),而且 COX-2 在低分化鳞癌、中分化鳞癌、高分化鳞癌的表达两两比较差异均有统计学意义(P<0.05,见表1)。
在宫颈癌各病理分级组间HIF-1α、VEGF、COX-2表达的差异均有统计学意义(P<0.05)。表2-4结果显示,宫颈癌中HIF-1α、VEGF、COX-2相互间表达水平呈正相关,但HIF-1α与COX-2不完全一致。

表2 宫颈癌中HIF-1α与VEGF表达的关系Tab 2 Relation between the expression of HIF-1α and VEGF in cervical cancer

表3 宫颈癌中HIF-1α与COX-2表达的关系Tab 3 Relation between the expression of HIF-1α and COX-2 in cervical cancer
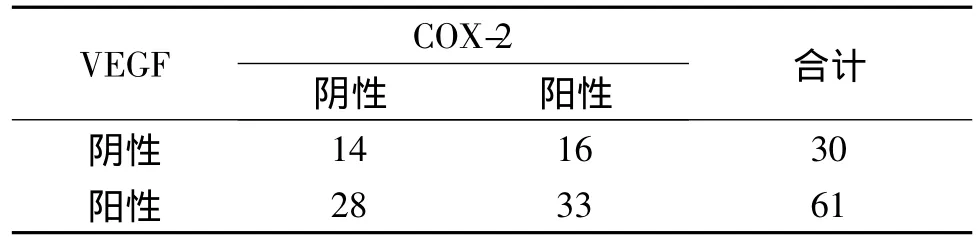
表4 宫颈癌中VEGF与COX-2表达的关系Tab 4 Relation between the expression of VEGF and COX-2 in cervical cancer
2.5 CD105的表达 CD105的染色定位于血管内皮细胞膜上呈棕黄色,分布于肿瘤及间质。微血管的形态不规则,有的新生血管区呈管腔结构,有的只是内皮细胞呈线状或点状分布。91例宫颈癌组织中,MVD计数平均46.7±9.2;MVD计数在低分化鳞癌、中分化鳞癌、高分化鳞癌分别是63.29±7.64,53.31 ±7.13,42.03 ±7.65,三组间比较有统计学差异(P<0.05,见表5),说明 MVD与宫颈癌的发生、发展密切相关。
2.6 三种因子在不同组织分级宫颈癌中的阳性表达与MVD的关系 结果显示,HIF-1α伴随组织分级的降低而升高,MVD的计数也逐渐增加,见表5,不同分级MVD的计数差异有统计学意义(P<0.05)。VEGF伴随组织分级的降低而升高,MVD的计数也随之增加,不同分级MVD的计数具有统计学差异(P<0.05,见表 5)。HIF-1α、VEGF 阳性表达与MVD计数呈正相关。COX-2伴随组织分级的降低而升高,而不同分级MVD的计数不具有统计学差异(P>0.05)。
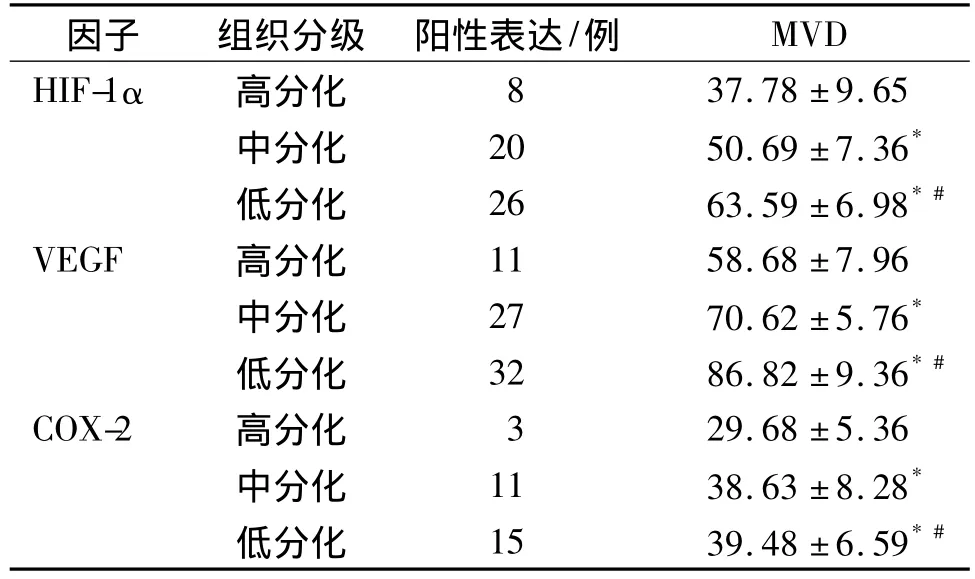
表5 HIF-1α、VEGF、COX-2在不同组织分级宫颈癌中的阳性表达与MVD的关系Tab 5 Relation between the positive expression of HIF-1α,VEGF,COX-2 in different hidtological grading of cervical cancer and MVD
2.7 不同组织分级中HIF-1α表达与VEGF的表达、COX-2表达、MVD计数的相关性 Spearman直线相关分析显示:HIF-1α表达与VEGF和COX-2的表达呈正相关关系(r分别为 0.776,0.525,均P<0.05),HIF-1α表达与MVD计数也呈正相关关系(r=0.671,P<0.05)。VEGF 的表达与 MVD 计数呈正相关关系(r=0.647,P<0.05)。
3 讨论
宫颈癌应用放射治疗越来越多,这是因为放射治疗的安全性及在提高病人的生存质量方面明显优于其他治疗手段。肿瘤组织分化程度的不同,经常作为我们临床医师预估宫颈癌放疗疗效的参考,但并没有科学的数据来准确判定。迄今为止,肿瘤血管新生对肿瘤生长、繁殖、侵袭的研究成为热点。但肿瘤血管新生与放疗抗拒的大小,放射治疗对肿瘤血管新生的影响仍不明确。本研究通过对不同组织分级的宫颈癌患者进行分析和比对,了解不同组织分级的实体肿瘤缺氧诱导血管新生与放疗抗拒的关系。
缺氧诱导肿瘤血管新生的机制非常复杂,可以激活多个信号通路,促进肿瘤血管的新生。本研究选择关键因子HIF-1α、COX-2、VEGF来研究与肿瘤血管生成的关系,以此来判定肿瘤对放疗抗拒的大小。
实体肿瘤本身不均匀血管新生的特性[1],导致肿瘤的生长不均衡,肿块内部缺氧程度也不同。放射治疗本身对肿瘤富氧区非常敏化,这样可以把肿瘤富氧细胞杀死,使肿瘤变小。而肿瘤的缺氧细胞再加之实体瘤本身存在缺氧区,其都对放疗存在抗拒,不同组织分级的肿瘤新生血管的能力不同,导致不同组织分级的宫颈癌放射治疗存在差异。已有研究表明肿瘤再生根本原因是这三种因子的阳性表达所致[4]。肿瘤细胞缺氧区可以促进HIF-1α因子的表达升高,HIF-1α是调节细胞内氧代谢的关键因子之一,其中HIF-1α为HIF-1所特有并受缺氧调控,其表达随细胞内氧浓度的下降而增加。由于肿瘤缺氧环境又可使抑癌基因突变,促进了肿瘤HIF-1α过量产生,增加了肿瘤细胞在缺氧条件下的存活[5]。COX使花生四烯酸转化为前列腺素酶,COX-2是诱生型异构体,在肿瘤血管生成中起重要作用[6]。其可促进血管生长因子释放,增强其功能,促进VEGF表达上调[7]。表皮生长因子(VEGF)是已知最重要的血管生长因子[8、9],VEGF 表达主要受缺氧环境的调节。VEGF通过与内皮细胞膜上的受体结合而发挥其内皮相关功能,调节内皮增殖,血管生成,调节血管通透性及血栓形成。不仅促进内皮细胞移动,有利于血管生成,还有利于肿瘤细胞脱落,进入血液或向临近组织扩散,为肿瘤的浸润、转移创造条件。这三种因子相互作用,共同来促进肿瘤血管的新生,为肿瘤的再生长提供新的养分。在本研究的数据分析中,表明了不同组织分级的子宫颈癌,伴随组织分化程度的降低,HIF-1α蛋白、COX-2和VEGF阳性表达升高。伴随着三种因子的表达升高,肿瘤新生血管的能力增强。实性肿瘤的生长是血管依赖性的,肿瘤新生血管为肿瘤提供营养和转移的途径。
微血管密度(MVD)是衡量血管生成的定量指标。我们发现HIF-1α、VEGF的阳性表达随组织分级的降低与MVD升高而升高,呈正相关。也说明了HIF-1α、VEGF有促进血管形成作用,HIF-1α的升高伴随 COX-2、VEGF也升高,HIF-1α通过促进VEGF途径调节肿瘤血管生成。实体瘤的缺氧环境促进HIF-1α、COX-2、VEGF的表达增强,肿瘤血管新生,为肿瘤再生长提供能量,导致放疗的疗效降低。也表明肿瘤组织分级越低,肿瘤对放射治疗的抗拒增加越明显。
总之,研究表明,肿瘤的放疗抗拒,是因为HIF-1α、COX-2、VEGF这三种因子的通路链被激活,促进MVD形成新生血管,对实体瘤缺氧细胞再氧合起着关键作用,为肿瘤重新具有活力提供必要的氧和养分,导致肿瘤的放射治疗疗效不可预知。所以对任何使 HIF-1α、COX-2、VEGF、MVD 通路链断裂或者抑制的治疗,都能预判放疗的疗效。这样为宫颈癌选择常规分割治疗或者超分割治疗提供参考。
[1] 余子豪,殷巍伯,徐国镇.肿瘤放射治疗学[M].4版.北京:中国协和医科大学出版社,2008:232-320.
[2] Birner P,Schindl M,Obermair A,et al.Over-expression of hypoxiainducible factor-1α is a marker for an unfavorable prognosis in early-stage invasive cervical cancer[J].Cancer Res,2000,60(17):4693-4696.
[3] Weidner N.Intratumor microvessel density as a prognostic factor in cancer[J].Am J Pathol,1995,147:9 - 19.
[4] Semenza GL.Regulation of mammalian O2hemeostasis by hypoxiainducible factor1[J].Annu Rev Cell Dev Biol,1999,15:551 -578.
[5] Bos R,Zhong H.Level of hypoxia-inducible factor-1α during breast carcinogenesis[J].J Natl Cancer Inst,2001,93(6):309.
[6] Gately S,Kerbel R.Therapeutic potential of selective cyclooxygenase-2 inhibitors in the management of tumor angiogenesis[J].Prog Exp Tumor Res,2003,37:179 -192.
[7] Zhao QT,Yue SQ,Dou KF,et al.Potential involvement of the cyclooxygenase-2 pathway in hepatocellular carcinoma-associated angiogenesis[J].Life Sci,2007,80:484 -492.
[8] Karamysheva AF.Mechanisms of angiogenesis[J].Biochemistry,2008,73:751 -762.
[9] Sharkey AM,Day K,Mcpherson A,et al.Vascular endothelial growth factor expression in human endometrium is regulated by hypoxia[J].J Clin Endocrinol Metab,2000,85:402 -409.
Relationship between radiotherapy resistance and hypoxia-induced angiogenesis in cervical cancer
DAI Yu-hui1,ZHANG Peng-cheng2(1Dept of Radiology,First Affiliated Hospital of Hebei North University,Zhangjiakou 075000,China;2Dept of Surgery,First Affiliated Hospital of Hebei North University)
ObjectiveTo explore the relationship between radiotherapy resistance and hypoxia-induced angiogenesis in cervical cancer.MethodsA total of 91 patients with stage Ⅱb-Ⅳcervical cancer treated with radiotherapy were enrolled in this study.The samples were fixed by 10%formaldehyde,embedded by general paraffin and sliced up continuously by 4 μm.The positive expression of hypoxia-inducible factor-1α (HIF-1α),vascular endothelial growth factor(VEGF),COX-2 of cervical cancer tissue in 91 cases were measured by SP immunohistochemistry,and tumor angiogenesis was marked by CD105,and then microvessel density(MVD)was measured.SPSS16.0 software of statistics was used,and the data was analyzed by χ2test and analysis of variance.The relativity among HIF-1α,COX-2,VEGF and CD105 was analyzed by Spearman rank correlation analysis.ResultsThe radiotherapy resistance increased while the histological differentiation degree of cervical cancer decreased.The positive expression of HIF-1α,COX-2 and VEGF in the high,middle and low differentiated tissues of cervical cancer increased gradually.There was a positive correlation between HIF-1α,VEGF and MVD.The count of MVD increased with the decrease of histological differentiation degree,and the difference had statistical significance(P<0.05).ConclusionThe tumor hypoxia could induce the increase of positive expression of many factors for accelerating the tumor angiogenesis.The angiogenesis is positively correlated the radiotherapy resistance in different histological grading of cervical cancer,and the degree of radiotherapy resistance is also different.
hypoxia-inducible factor-1α;COX-2;vascular endothelial growth factor;tumor angiogenesis;radiotherapy resistance
R730.2
A
1007 -6611(2011)01 -0042 -04
10.3969/J.ISSN.1007 -6611.2011.01.011
张家口市2010年科学技术研究与发展指导计划项目(1021080D)
戴钰辉,男,1973-10生,本科,主治医师,E-mail:daiyan159582@163.com.
2010-08-30]

