硫酸酯化米糠多糖结构分析及其抗肿瘤活性研究*
王莉,朱丽丹,盛慧明,陈正行
近年来诸多研究发现,多糖及其衍生物在抗肿瘤、抗炎、抗病毒、抗衰老、抗凝血等方面发挥着生物活性作用,多糖在医药上作为免疫调节剂用来治疗肿瘤、肝炎等疾病已为大家所广泛接受[1-3]。但由于多糖结构的复杂性,其生物活性随多糖来源及其产生的多糖种类不同而差异较大,另外多糖一般都具有较大的分子质量,水中溶解性较差,这给多糖的实际应用造成了一定的困难。采取一定的方法对多糖结构进行适当修饰,能提高多糖的生理活性,其中硫酸化修饰是目前多糖结构修饰中研究得最而且效果突出的一种修饰手段。
生物活性物质的活性高低与其结构有着密切的关系,分子结构的微小变化和立体结构因素都会影响其活性[4]。许多研究已经证实,硫酸酯化多糖的生物活性与几个结构参数密切相关,如硫酸酯化度,分子量,硫酸酯化的位置,糖的种类及主链和分支结构[5]。目前对硫酸酯化米糠多糖的分子结构研究尚属空白,本实验对 SRBPS2a的结构特点进行初步的研究,并通过建立小鼠抑制乳腺癌 EMT-6模型,研究了 SRBPS2a在体外和体内抗肿瘤作用机理,为以后进一步研究 SRBPS2a的构效关系奠定基础。
1 材料与方法
1.1 材料与设备
脱脂米糠,浙江省杭州市中谷油脂有限公司提供,-4℃保存,耐高温;RP M I 1640细胞培养基,GI BCO公司;小鼠乳腺癌细胞 EMT-6,北京市肿瘤医院动物实验中心提供;BALB/C雌性小鼠,6周龄,体重(18±2)g,中科院动物实验中心;小牛血清,杭州四季青生物公司;二甲亚砜、MTT[3-(4,5-dimethylthiazol-2yl)-2,5-diphenyltetrazoloium],Sigma公司;其余试剂为国产分析纯。
高效液相色谱仪,美国 Waters公司;Nexus-470傅立叶变换红外光谱仪,美国 Ther mo fisher scientific公司;Bruker Avance 500核磁共振波谱仪,美国Bruker公司;CO2培养箱,美国 Thermo公司;WFZ UV-2100紫外可见分光光度计,尤尼柯上海仪器有限公司;VCX500型超声波破碎机,美国 Sonics&materials公司;BSZ-100自动部分收集器、TH-1000型梯度混合器,上海青浦沪西仪器厂;HL-2S型恒流 、HD-5电脑紫外检测仪,上海沪西分析仪器厂。
1.2 方法
1.2.1 硫酸酯化米糠多糖 SRBPS2a的制备
根据文献[6]提取和纯化 RBPS2a。
采用氯磺酸-吡啶法[4]对 RBPS2a进行硫酸酯化。准确称取 400 mg的 RBPS2a并将其悬浮于 35 mL N,N-二甲基甲酰胺 (DMF)中,加入配置好的酯化试剂,在一定温度下搅拌反应 1~3 h,反应结束后用4 mol/L NaOH中和至 pH值为 7。加入体积分数95%乙醇,使醇浓度为 70%,离心分离后将沉淀溶于蒸馏水,流水透析 72 h,蒸馏水透析 12 h,真空浓缩、冷冻干燥得到 SRBPS2a。
根据 Dodgson and Price的方法[7]测定 SRBPS2a硫酸基含量。
1.2.2 分子质量的测定 (HPGPC)
采用高效液相凝胶渗透色谱法测定 SRBPS2a的分子质量。采用 TSK及 Ultrahydrogel linear(7.8 mm×300 mm)色谱柱,双柱串联,Waters-2410型示差折光检测器检测,流动相为 0.1 mol/L NaNO3,流速为0.9 mL/min,柱温 45℃,进样量 20μL,记录样品色谱曲线。在相同的 HPLC测定条件下,将 7种分子质量为 6 100、16 500、26 290、40 000、84 000、158 000和291 000的标准Dextran相继进样,记录各自的保留时间TR,以TR为横坐标LgM为纵坐标,绘制标准曲线。相同条件下得到样品 SRBPS2a的色谱曲线,采用Millennium 2010(Waters)软件分析样品的保留时间得到样品的相对分子质量。
1.2.3 傅立叶变换红外光谱 (FT-IR)
利用NicoletNexus 470型红外光谱仪检测 SRBPS2a的功能性官能团。将 SRBPS2a与溴化钾压片,在 4 000~400 cm-1范围内扫描,扫描 32次,分辨率 4 cm-1。
1.2.413CNMR
用D2O配成 30 mg/mL浓度的样品溶液,室温下利用BrukerAvance 500 NMR核磁共振仪进行分析测定。
1.2.5 体外抗肿瘤试验
利用MTT法[8]来评价 SRBPS2a抑制小鼠乳腺癌细胞 EMT-6的能力。取对数生长期的小鼠乳腺癌细胞 EMT-6培养于 RPM I 1640完全培养液中,放入37℃CO2培养箱中培养,接种时细胞浓度调整为 (3~5)×105/mL,将细胞加入 96孔培养板中,每孔 150 μL,置于 37℃、5%CO2培养箱培养 24 h,再加入用完全培养基稀释成不同浓度的样品溶液 150μL,空白对照组加入等体积的 RPM I1640完全培养基,每组设 4个复孔,将细胞培养板移入 CO2培养箱中,培养48 h后MTT法于 570 nm波长下测定其吸光值,计算各种肿瘤细胞增殖抑制率。抑制率计算公式如下:

1.2.6 体内抗肿瘤试验
1.2.6.1 动物模型建立
收集培养至对数生长期的 EMT-6细胞,用生理盐水将细胞浓度调整为 1×107个 /mL,于小鼠右前肢进行无菌皮下接种,每只小鼠接种 0.2 mL细胞悬液,即细胞总数为 2×106个,待小鼠瘤体积达到 500 mm3左右进行实验。
1.2.6.2 给样方式
将建模成功的小鼠分组与给样。方案如下:荷瘤小鼠随机分成 5组,每组 12只,次日开始注射待测样品 SRBPS2a,样品设低、中、高 3个剂量 ,即 25、50、75 mg/(kg·d)体重;阳性对照组给予用生理盐水稀释的五氟尿嘧啶 (5-FU)20 mg/(kg·d)体重 ,每日灌胃给药一次,每次每鼠给药体积为 0.2 mL,连续 10 d;阴性对照组每日给予等量无菌 0.9%生理盐水。
1.2.6.3 抑瘤率测定
停药 24 h后断颈处死荷瘤小鼠,剥离瘤块,称重并计算肿瘤抑制率。肿瘤生长抑制率按下式计算:

1.2.7 相对胸腺和脾脏的质量
取停药后 24 h后处死荷瘤小鼠的脾脏和胸腺,称重并按下式计算脾指数和胸腺指数。脾指数和胸腺指数按下式计算:

1.2.8 数据分析
所测数据以表示,如果数据符合正态分布,统计方法采用双侧t检验,α=0.05,如数据不符合正态分布,则采用 F检验。
2 结果与讨论
2.1 硫酸酯化米糠多糖 SRBPS2a的结构分析
2.1.1 硫酸酯化米糠多糖 SRBPS2a的分子质量
硫酸酯化可以通过结构修饰从而改变多糖的空间结构、分子质量及取代基种类、数目和位置而对其活性产生影响,其中分子质量是一个非常重要的参数[9]。
高效液相凝胶渗透色谱 (HPGPC)分析显示SRBPS2a呈单一对称谱图,为相对单一组分,据标准曲线得出其相对分子质量 (Mw)为 3.5×105u。与修饰前的 RBPS2a分子质量 9×105u相比,硫酸酯化修饰之后的多糖分子质量明显变小,说明在强酸性的酯化过程中,由于氯磺酸强大的脱水能力,使多羟基多糖脱水并降解,从而使 SRBPS2a分子质量变小。用Dodgson and Price的方法测定 SRBPS2a取代度为1.29。有研究发现,当 DS在 0.9~1.3内,有助于提高了 SRBPS2a的抗肿瘤活性[4]。
2.1.2 硫酸酯化米糠多糖 SRBPS2a的红外光谱
图1为 SRBPS2a的红外光谱图。1 263和 1 044 cm-1的吸收峰分别是 S=O的弯曲振动和伸缩振动,830 cm-1的吸收峰和 1 137 cm-1为 C—O—S的拉伸振动和伸缩振动,这些都是硫酸酯的特征吸收峰[10]。580 cm-1的吸收峰通常出现在硫酸酯化多糖中[11]。与 RBPS2a的红外光谱图相比较[6],证明硫酸基已与米糠多糖结合形成硫酸酯。800~850 cm-1表明了硫酸基团取代位置的吸收区域。其中 845 cm-1和 830 cm-1处的吸收峰表明了 SRBPS2a的硫酸基团在 C-2位和 C-4位上发生了取代,而在 820 cm-1处未显示吸收峰,表明 C-6上没有发生取代[12]。
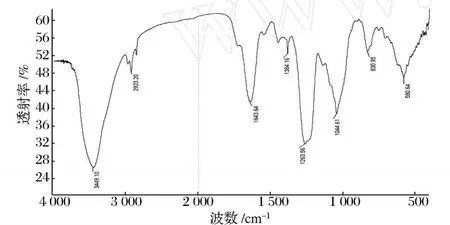
图1 硫酸酯化米糠多糖 SRBPS2a的红外光谱
2.1.3 硫酸酯化米糠多糖 SRBPS2a的核磁共振分析
NMR用于检测组成有机化合物分子的原子核性质及其与周围化学环境的相互作用,一维核磁共振氢谱 (1H-NMR)和一维核磁共振碳谱 (13C-NMR)可为多糖的结构分析提供有用的信息。RBPS2a的核磁共振分析在文献[12]有详细的介绍。
表1为 SRBPS2a的13C谱图的化学位移。与酯化之前 RBPS2a的核磁谱图相比较,α-D-木糖,α-D-阿拉伯糖,α-D-葡萄糖和α-D-阿拉伯糖的异头碳信号均消失,说明硫酸酯化改性的过程中,多糖仅保留了β-(1→3)-D-半乳糖的主链结构,其侧链被切除。SRBPS2a的 C-2的部分信号由 75.6 ppm转移至 81.3 ppm,说明部分 C-2位上的羟基被硫酸基团所取代;在 77.4 ppm出现的新的信号归属于 C-4位,表明硫酸基团取代也发生在 C-4位上。同时,由于在 C-2和C-4位置上发生了取代,影响了 C-1的信号,因此在101.0 ppm处出现了与 C-1相关的信号。61~64 ppm之间的与 C-6相关的信号消失,而在 56.6 ppm处 O-CH3信号的出现,表明在硫酸酯化的过程中,C-6位置发生了氧化降解同时有甲氧基的产生,推测 C-6被氧化成了糖醛酸甲酯[15]。综上所述,RBPS2a在经过硫酸酯化修饰后,主链为β-(1→3)-D-半乳糖,其侧链被切除,硫酸基团的取代发生在 C-2和 C-4位上,C-6氧化形成了糖醛酸甲酯。

表1 SRBPS2a的13C NM R化学位移
2.2 硫酸酯化米糠多糖 SRBPS2a抗肿瘤活性
2.2.1 体外抗肿瘤试验
许多研究表明,硫酸酯化衍生物对肿瘤细胞的增殖抑制跟其的取代度有关,多糖的取代度的越高的,在体内抗肿瘤细胞能力越强[9]。如表2为 SRBPS2a对 EMT-6体外肿瘤细胞的增殖抑制作用——当SRBPS2a在剂量浓度为 500和 250 mg/mL时,比 RBPS2a对 EMT-6体外肿瘤细胞有显著的抑制作用 (P<0.05);当 SRBPS2a和 RBPS2a剂量浓度为 500 mg/mL时对 EMT-6体外肿瘤细胞的抑制力分别为47.35%和 31.58%;RBPS2a在剂量浓度为 100和 50 mg/mL时无明显的抑制作用。这表明 SRBPS2a比RBPS2a对 EMT-6体外肿瘤细胞有更好的抑制作用。
硫酸酯化修饰通常认为是提高多糖的生物活性的一种有效方法。引入硫酸基后所引起的多糖立体结构的变化,糖环构象可能扭曲或转变,且硫酸基间的排斥作用导致卷曲构象呈伸展和刚性状态。有研究表明:分子质量的降低,侧链的切除,硫酸基团的取代和多糖糖链刚性的增加可能有助于提高多糖的抗肿瘤活性[13]。
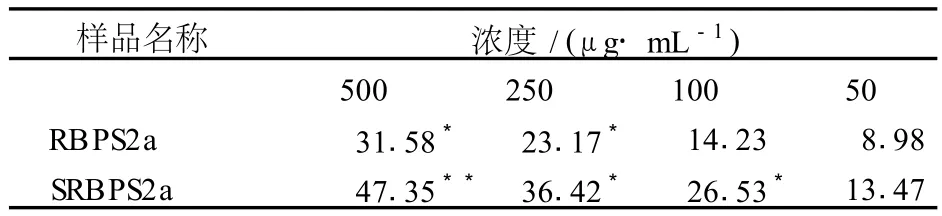
表2 不同浓度下 RBPS2a及其 SRBPS2a对 E MT-6体外肿瘤细胞的增殖抑制作用
2.2.2 体内抗肿瘤试验
SRBPS2a对 EMT-6荷瘤小鼠的体内抑瘤作用如表3所示。结果表明,阳性对照组 (5-FU)的抑瘤率为 73.81%,而不同剂量浓度的 SRBPS2a对 EMT-6荷瘤小鼠表现出不同抗肿瘤活性。SRBPS2a在剂量浓度为 75mg/kg有显著的抑制肿瘤细胞生长作用,肿瘤抑制率达 55.95%。
阴性对照组平均瘤重为 (0.84±0.21)g,然而阳性对照组平均瘤重为 (0.22±0.09)g,相比与阴性对照组显著减少,注射 SRBPS2a剂量浓度为 75和 50 mg/kg的小鼠平均瘤重为 (0.37±0.11)和 (0.47±0.18)g。实验结果表明,硫酸酯化多糖对小鼠体内EMT-6的生长具有明显的抑制作用。阳性对照组 (5-FU)有较高的抗肿瘤作用,但也有很强的毒副作用,如体重和脾脏的质量明显下降的影响。实验中发现,SRBPS2a试验组的食欲、精神、皮毛光泽度明显优于阴性和阳性对照组,且未观察到有副作用和体重减轻。
如表3所示,阳性对照组小鼠胸腺指数和脾指数相对于阴性对照均有显著的降低;SRBPS2a组脾指数相对于阴性对照组有显著的增加,但胸腺指数无显著差异。这些结果表明,SRBPS2a能增加免疫器官的重量。作为一个最有效的抗癌药物,5-FU被用于通过化疗对抗各种实体肿瘤[14],然而,由于毒性累积和抗药性的发展,连续使用 5-FU的并不总是可行的。一些多糖或其衍生物除了他们的生物活性还被认为能影响许多癌症化疗的敏感性[15-16]。SRBPS2a由于其对肿瘤细胞株较好的抑制率且没有毒副作用,被认为是一种具有发展潜力的抗肿瘤药物。

表3 SRBPS2a对 EM T-6荷瘤小鼠的体内抑瘤作用
3 结论
采用氯磺酸-吡啶法将米糠多糖合成硫酸酯化米糠多糖,得到了取代度为 1.29,分子质量为 3.5×105u,具有显著体外抗肿瘤活性的米糠多糖硫酸酯化衍生物 SRBPS2a,且硫酸基团的取代发生在 C-2和 C-4位上。以肿瘤细胞体内和体外增殖抑制为指标表明,SRBPS2a明显比 RBPS2a有更好的抑制肿瘤的能力。由于 SRBPS2a具有很好的的抗肿瘤活性,可以在将来成为是一种用于治疗癌症、低副作用的药品,也为SRBPS2a进一步研究诱导肿瘤细胞凋亡及分子机制提供可能。
[1] Nie X,ShiB J,Ding Y,et al.Preparation of a chemically sulfated polysaccharide derived from Grifola frondosa and its potential biological activities[J]. International Journal ofBiologicalMacromolecules,2006,39:228-233.
[2] Peng Y,ZhangL,Zeng F,et al.Structure and antitumor activities of the water-soluble polysaccharides from Ganoder ma tsugae mycelium[J].Carbohydrate Polymers,2005,59:385-392.
[3] Cui F J,TaoW Y,Xu Z H,et al.Structural analysis of anti-tumor heteropolysaccharide GFPS1b from the cultured mycelia of Grifola frondosa GF9801[J].Bioresource Technology,2007,98:395-401.
[4] WangL,Li X X,Chen Z X.Sulfated modification of the polysaccharides obtained from defatted rice bran and their antitumor activities[J].International Journal of Biological Macromolecules,2009,44:211-214.
[5] DuarteM E R,Cardoso M A,NosedaM D,et al.Structural studies on fucoidans from the brown seaweed Sargassum stenophyllum[J].Carbohydrate Research,2001,333:281-293.
[6] WangL,Zhang H B,Zhang X Y,et al.Purification and identification of a novel heteropolysaccharide RBPS2a with anti-complem-entary activity from defatted rice bran[J].Food Chemistry,2008,110:150-155.
[7] Dodgson K S,Price R G.A note on the determination of the ester sulphate contentof sulphated polysaccharides[J].Biochemical Journal,1962,84:106-110.
[8] Mosmann T.Rapid colorimetric assay for cellular growth and survival:Application to proliferation and cytotoxicity assay[J].Journal of I mmunological Methods,1983,65:55-63.
[9] Yang J H,Du YM,Wen Y,et al.Sulfation of Chinese lacquer polysaccharides in different solvents[J].Carbohydrate Polymers,2003,52:397-403.
[10] Falshaw R,Furneaux R H.Structural analysis of carrageenans from the tetrasporic stages of the red algae,Gigartina lanceata and Gigartina chapmanii(Gigartinaceae,Rhodophyta)[J].Carbohydrate Research,1998,307:325-331.
[11] Mahner C,Lechner M D,Nordmeier E.Synthesis and characterisation of dextran and pullulan sulphate[J].Carbohydrate Research,2001,331:203-208.
[12] Maciel J S,Chaves L S,Souza B W S,et al.Structural characterization of cold extracted fraction of soluble sulfated polysaccharide from red seaweed Gracilaria birdiae[J].Carbohydrate Polymers,2008,71:559-565.
[13] Amornrut C,Hidenao T,EunW R,et al.Effectof(1→3)-and(1→4)-linkages of fully sulfated polysaccharides on their anticoagulant activity[J].Carbohydrate Research,2002,337:925-933.
[14] Satoru K,Noboru T,Hiroo N,et al.Oversulfation of fucoidan enhances its anti-angiogenic and antitumor activities[J].Biochemical Pharmacology,2003,65:173-179.
[15] Wang Y F,Zhang L N,Li Y Q,et al.Correlation of structure to antitumor activities of five derivatives of a bglucan from Poria cocos sclerotium[J].Carbohydrate Research,2004,339:2 567-2 574.
[16] LongleyD B,Harkin D P,Johnson G P.5-Fluorouracil:mechanis ms of action and clinical strategies[J].Nature Reviews Cancer,2003,3:330-338.

