1株聚乳酸降解细菌的筛选、鉴定及产酶研究
刘玲绯,李凡,林秀梅,刘东波,夏红梅,陈珊
(东北师范大学生命科学学院,吉林长春130024)
塑料以其质优、价廉、强度高等特性,自19世纪以来在工农业生产和社会生活中得到广泛的应用。在塑料给人们带来方便的同时,也因其在自然环境中难以分解而产生了大量的“白色垃圾”,严重地破坏了生态平衡、危害动植物生长、威胁人类健康[1],因此生物可降解塑料的开发和应用受到了人们的重视。聚乳酸(poly-L-lactic acid,PLA)是一种新兴的生物可降解材料,是以谷物发酵而得到的乳酸为单体,通过化学合成方法聚合而成的脂肪族高分子聚合物。除了可生物降解性以外,PLA还具有较好的机械性能、热塑性、生物相容性及产物安全性,成膜后高透明度,纤维的高拉伸强度和易于加工的特性等,因此PLA被认为是最具潜力的替代现有塑料的新型“生态材料”之一,备受世界各国的关注[2]。随着研究的不断深入,人们发现虽然PLA在许多物理化学和机械性能上要优于聚羟基丁酸酯(PHB)、聚己内酯(PCL)等材料,但其在自然界中的生物降解速率要比PHB和PCL缓慢得多,环境中降解PLA的微生物数量不到0.04%,远远低于PHB、PCL等材料的降解微生物数量(0.8%~11%)[3-4]。目前,人们已经分离了大约几十种能够降解PLA的菌株,其中大部分属于特殊的放线菌类[5],只发现了少量的对PLA具有降解作用的细菌和真菌[6-7],PLA降解微生物和酶类都具有一定的特殊性。本实验主要筛选了1株对PLA具有降解作用的细菌,并对其进行了鉴定和诱变,对其产酶条件进行了初步的研究,旨在获得高效的降解菌株和最佳的产酶条件,为PLA降解微生物和降解酶特殊性的研究奠定基础。
1 材料与方法
1.1 材料
1.1.1 PLA材料PLA颗粒及PLA薄膜由中国科学院长春应用化学研究所提供,熔点164.6℃,相对分子质量为2.074×105。
1.1.2 培养基①PLA培养基:PLA 1 000 mg,1 mol/L K2HPO49.4 mL,1 mol/L KH2PO40.62 mL,(NH4)2SO41 000 mg,NaCl 100 mg,MgSO4·7H2O 200 mg,Na2WO40.5 mg,MnSO40.5 mg,CaCl2·2H2O 20 mg,FeSO4·7H2O 10 mg,Na2MoO4·2H2O 0.5 mg,蒸馏水定溶至1 L;②蛋白酶活力筛选培养基:酪蛋白10 g,牛肉膏3 g,Na2HPO42 g,NaCl 5 g,琼脂20 g,蒸馏水1 000 mL,0.4%溴麝香草酚蓝溶液12.5 mL,pH 7.4;③PLA乳化液的制备:10 mL三氯甲烷溶解0.4 g PLA颗粒,待充分溶解后,加入0.04 g Plysurf A210G乳化剂和100 mL pH 8.0的磷酸盐缓冲液,摇匀后置于超声波细胞破碎仪中乳化,功率300 W,工作时间6 s,共90次。乳化结束后将乳化液置于磁力搅拌器上75℃加热搅拌90 min,使溶于其中的三氯甲烷完全挥发,再用pH 8.0的磷酸盐缓冲液定容至400 mL备用。
1.2 方法
1.2.1 PLA降解菌的分离纯化将10 g从不同环境中采集到的污泥置于以PLA为唯一碳源的100 mL的液体培养基中,37℃振荡进行富集培养,采用平板稀释涂布法在PLA唯一碳源平板上对降解菌株进行分离纯化。
1.2.2 PLA降解情况的测定分别以PLA粉末和PLA乳化液作为唯一碳源,接入6 mL经37℃,130 r/min振荡培养24 h的种子液,于37℃,130 r/min条件下培养。观察培养过程中培养液的变化。在进行薄膜降解实验时,将PLA膜(1.0 cm×1.0 cm,0.01~0.02 g)置于100 mL的PLA培养基中(PLA粉末由薄膜代替),接入6 mL经37℃,130 r/min振荡培养24 h的菌液,于37℃,130 r/min条件下培养。每隔3 d取膜1次并称重,计算薄膜的失重率。对降解后的PLA薄膜和未接入菌体的PLA对照薄膜进行扫描电子显微镜观察。
1.2.3 菌种鉴定形态学及生理生化特征测定:参照《常见细菌系统鉴定手册》[8];16S rDNA序列测定及系统发育分析:使用BioFlux的基因组DNA提取试剂盒提取纯化菌株的基因组DNA作为模板,用通用引物27F(5'-AGA GTT TGA TCC TGG CTC AG-3')和1492R(5'-GGT TAC CTT GTT ACG ACT T-3')扩增该菌株的16S rDNA。PCR产物进行电泳和凝胶回收后送上海生工测序。测序结果在NCBI数据库中进行Blast比对,并用MEGA 3.1软件进行系统进化树分析。
1.2.4 紫外线诱变及突变菌株的筛选[9]在无菌的平皿中倒入5 mL处于对数期的DSL09菌液,置于磁力搅拌器上搅拌,在垂直距离为30 cm的15 W紫外灯(波长为254 nm)下分别照射0、30、60、90、120、150 s。将照射后的菌液分别稀释至106~108个/mL,并涂布在蛋白酶活力筛选培养基中,在黑暗条件下37℃恒温培养2 d,观测菌落及水解透明圈的大小,计算HC值(HC值=透明圈直径/菌落直径),根据HC值进行初筛。将平板初筛得到的菌种进行活化,分别接种于PLA唯一碳源培养基中,于37℃恒温振荡培养,测定其产酶高峰,以未诱变的菌株作对照,筛选出具有较强PLA降解活力的突变菌株。
1.2.5 PLA降解酶活力测定方法[10]取0.4 g/mL的PLA乳化液1 mL与等体积的粗酶液在60℃恒温水浴锅中保温24 h,利用乳酸试剂盒测定上清液中乳酸的量,通过计算酶反应中乳酸的生成量来表征PLA降解酶活力。同时对灭活的酶液进行同样的操作,作为酶活测定的对照。
1.2.6 蛋白酶活性测定方法[10]以pH 7.0的磷酸盐缓冲液,质量分数为1%的酪蛋白溶液作为底物,加入1 mL稀释好的酶液,混合后在37℃水浴锅里反应10 min;再用质量分数为10%的三氯乙酸终止反应,静置30 min后10 000 r/min离心10 min,在280 nm条件下测定上清液的吸光值。以灭活酶液的反应体系作为空白对照。
1.2.7 发酵条件的优化对上述筛选到的产PLA降解酶活力最高的菌株在诱导物种类及含量、初始pH值、接种量、发酵温度、发酵时间上进行优化,获得最适的产酶条件。以测定的最适产酶条件为参数,对菌株进行发酵,测定发酵液的PLA降解酶活力和蛋白酶活力,绘制产酶曲线。酶活测定方法参照1.2.5和1.2.6。
2 结果与分析
2.1 PLA降解菌的筛选及降解性能测定
将污泥接入以PLA粉末为唯一碳源的液体培养基中进行摇瓶富集,富集液采用平板菌落法在PLA唯一碳源平板上进行分离纯化,结果从污泥中筛选出1株具有PLA降解活力的细菌,编号为DSL09。该菌株对PLA粉末、PLA乳化液及PLA薄膜都具有较好的降解作用,以PLA粉末和乳化液为碳源时,菌株生长旺盛;以PLA薄膜为碳源时,薄膜重量随着培养时间的延长而下降,经过40 d左右的培养后,薄膜发生崩解破碎,失重率为10%,而未接入菌体的对照薄膜,虽然同样在液体培养基中振荡,并且也因为一定的水解作用而发泡变白,但并未发生崩解,说明菌株DSL09对PLA材料具有明显的降解作用。同时薄膜的扫描电子显微镜观察结果也显示出,经过菌体作用的薄膜表面出现了大量的孔洞,而未经菌体作用的对照表面仍然光滑,因此进一步判定了DSL09的PLA降解作用。
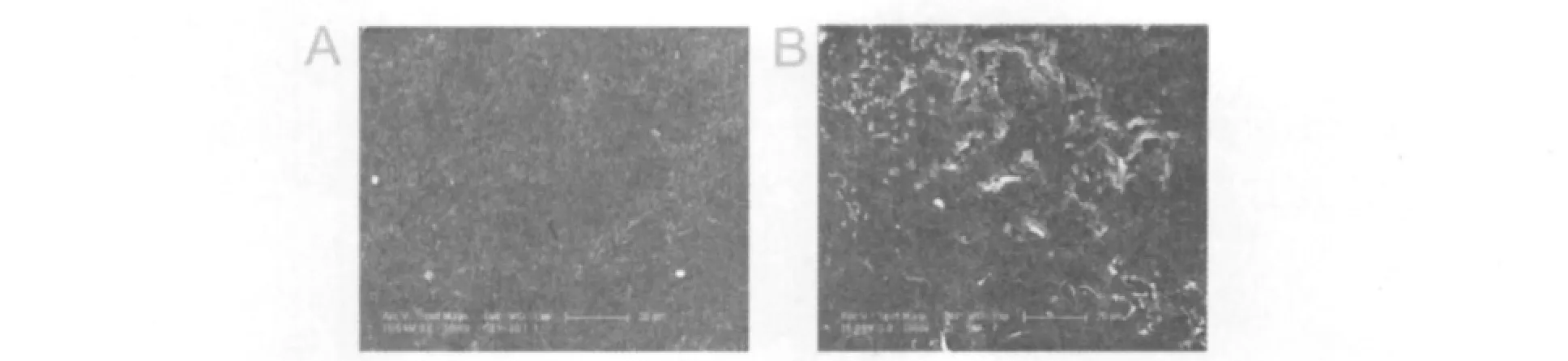
图1 PLA薄膜降解的形态图片Fig.1 Degradation of PLA film by strain DSL09
2.2 PLA降解菌的鉴定
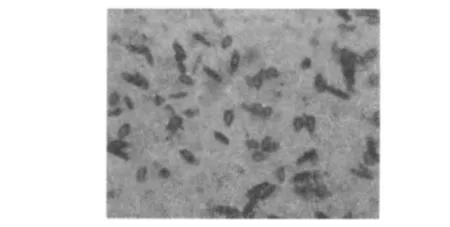
图2 DSL09的菌体形态Fig.2 The morphology of strain DSL09
采用形态学观察、分子生物学分析及生理生化特征测定等方法对DSL09菌株进行鉴定。观察结果显示DSL09菌落呈圆形、不透明、白色、表面光滑的隆起状;显微镜下可见菌体为短杆菌,有芽胞,革兰染色为阳性(图2)。
通过对菌株16S rDNA的扩增和测定,获得1条1 512 bp的核苷酸序列,在NCBI数据库中进行Blast比对,发现该序列与Bacillus sp.MK03、Bacillus sp.XJSL4-5等芽胞杆菌的16S rDNA具有99%的相似性,根据比对结果构建了DSL09与其他相关菌株的系统发育树,结果见图3,也显示出该菌株在系统发育树上与芽胞杆菌位置较近。

图3 根据16S rDNA序列构建的DSL09菌株的系统发育树Fig.3 Phylogenetic tree of DSL09 based on 16S rDNA sequences
为对该菌株进行进一步确定,参照《常见细菌系统鉴定手册》中芽胞杆菌属的种间鉴别特征对菌株的生理生化特性进行了测定,结果(表1)显示DSL09菌株在理化性质上接近地衣芽胞杆菌(Bacillus licheniformis),但不同的是该菌株在55℃条件下不能生长,因此该菌株可能属于芽胞杆菌属新的种或亚种。

表1 菌株DSL09生理生化特性Table 1 Physiological and biochemical properties of strain DSL09
2.3 紫外线诱变及突变菌株的筛选
为提高DSL09菌株的PLA降解酶活力,对其进行紫外线诱变处理,而紫外诱变的前提是具有相对高通量的筛选方法,根据文献报道和本实验室的研究结果,以PLA做底物,菌株生长时不易形成明显的透明圈,因此用PLA平板筛选突变株较难。但目前发现的大多数PLA降解酶都属于蛋白酶类,可以尝试应用灵敏度高、重现性好的蛋白酶筛选培养基来对诱变后的菌株活力进行初筛,再结合PLA唯一碳源液体培养法进行复筛,最终获得PLA降解酶活力升高的菌株。
通过观察并测定菌株在蛋白酶筛选平板上形成的水解透明圈及菌落大小,发现最终经30 s和60 s诱变后的菌株具有较大的HC值,挑选其中的4株菌分别接入以PLA为唯一碳源的液体培养基中,置于37℃,130 r/min振荡培养进行复筛。结果显示4株菌的PLA降解酶活力均明显高于原始菌株DSL09。其中DSL09-60b的PLA降解酶活力最高,可达到原始菌株酶活力的1.5倍。将其经斜面传代6次后,测定其PLA降解酶活力,未见明显变化,说明该菌株具有较稳定的遗传性能,因此选择DSL09-60b作为下一步研究的对象。
2.4 最适产酶条件的优化
2.4.1 最适诱导物及其含量的测定根据文献报道,目前所发现的PLA降解酶基本都属于蛋白酶类[2],本实验在对菌株进行诱变时,即根据这一点采用了蛋白酶活力筛选培养基进行初筛,极大地方便了突变菌株的选出,诱变结果显示蛋白酶活力提高的突变株其PLA降解酶活力也相应提高,这一结果证明了对于DSL09-60b菌株,其PLA降解酶确实与蛋白酶存在着一定的相关性。因为PLA是人工合成的非天然化合物,如果其属于蛋白酶类,那么在培养基中添加一定的蛋白酶诱导物,可能对PLA降解酶的产生具有促进作用。本实验选择明胶、蛋白胨、酵母膏和酪蛋白为诱导物,分别添加入PLA粉末培养基中,置于37℃恒温振荡摇床培养3 d,测定发酵液的PLA降解酶活性,结果见图4。由图4可知蛋白类诱导物可以有效地促进DSL09-60b PLA降解酶的产生,用酪蛋白作为诱导物时,菌株产PLA降解酶活性最高。
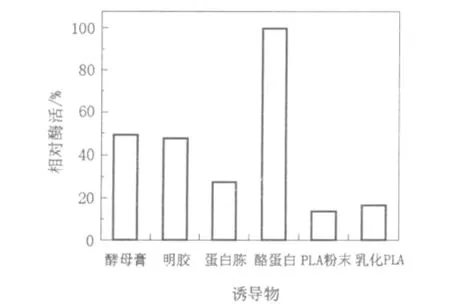
图4 不同诱导物对产酶的影响Fig.4 Effect of different inducers on enzyme formation
选择酪蛋白为诱导物后,分别采用含有0.1%、0.3%、0.5%、0.7%、0.9%的酪蛋白培养基培养菌株3 d。测得当酪蛋白含量为0.5%时,PLA降解酶活力最高(图5),说明0.5%是酪蛋白诱导物的最佳添加量。
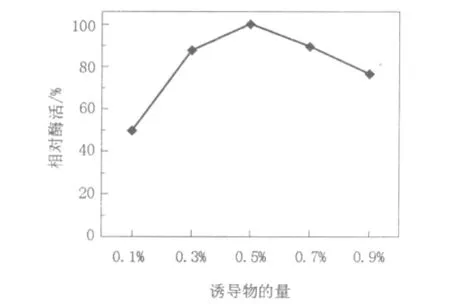
图5 诱导物的量对产酶的影响Fig.5 Effect of quantity of inducers on enzyme formation
2.4.2 最佳产酶pH条件的测定将保存于斜面培养基的菌种接种于100 mL含有0.5%酪蛋白的PLA培基中,37℃130 r/min振荡培养24 h,制备种子培养液。将种子培养液按6%(体积比)接种量接种于100 mL含有0.5%酪蛋白的不同pH(6~9)的PLA培养基中,37℃130 r/min振荡培养3 d。培养结束后,将发酵液14 000 r/min离心15 min,取上清液测定PLA降解酶活力。
如图6所示,培养基的初始pH对菌株产酶活力有较大的影响。当培养液为酸性时,PLA降解酶的活力明显较低,随着pH升高降解酶活力也随之升高,当pH为8.0时,PLA降解酶活力达到最高,之后酶活力随着培养基pH的升高而降低,因此菌株的最佳产酶初始pH为8.0。
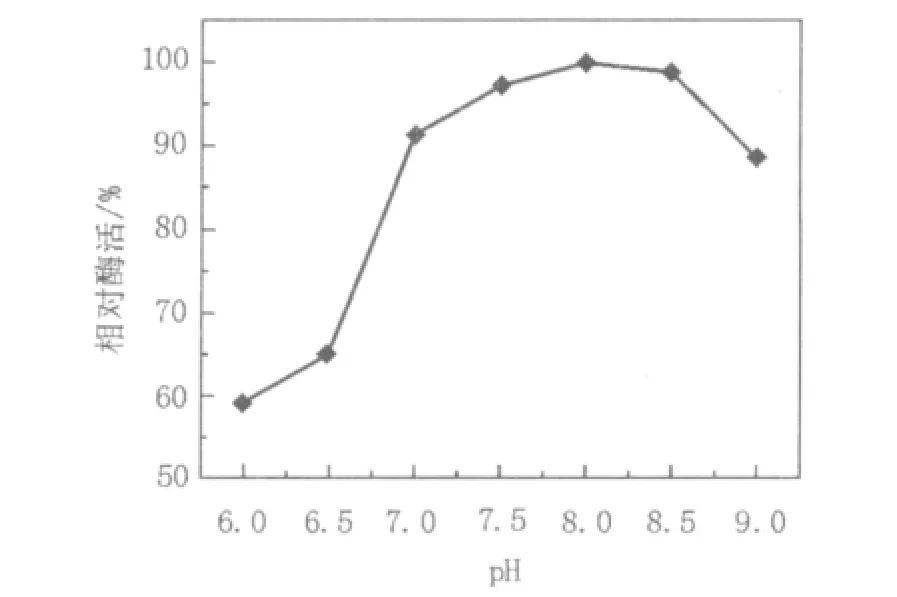
图6 不同pH值对产酶的影响Fig.6 Effect of initial pH on enzyme formation
2.4.3 最适产酶接种量测定将活化24 h的菌种按2%、4%、6%、8%、10%(体积比)的接种量接种于100 mL含0.5%酪蛋白的PLA培养基(pH 8.0)中,在37℃条件下恒温振荡培养3 d。培养结束后,将发酵液离心,取上清液测定PLA降解酶活力,结果如图7所示。当接种量为6%时菌株产PLA降解酶活力最高,而过高或过低的接种量都会影响菌株的产酶效率。
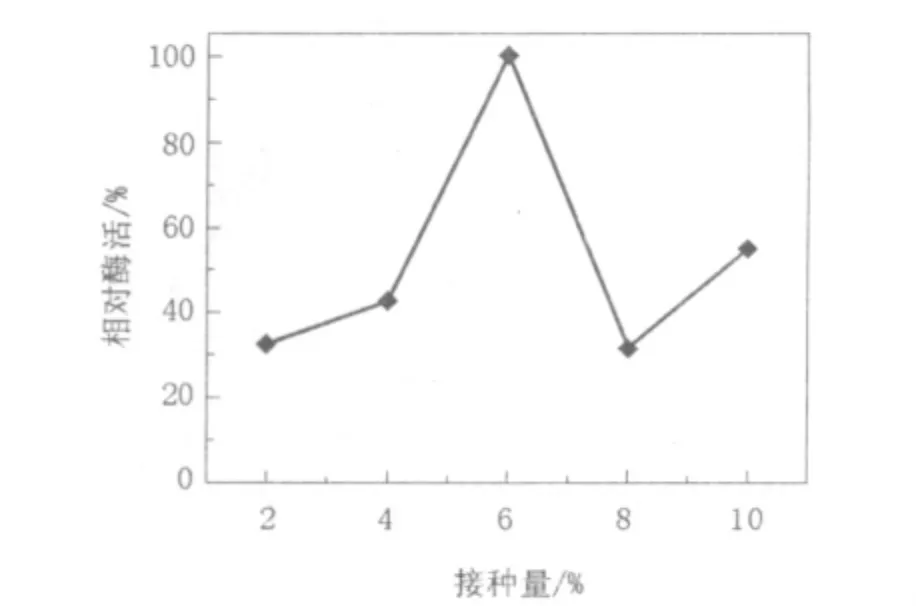
图7 不同接种量对产酶的影响Fig.7 Effect of quantity of inoculation on eniyme formation
2.4.4 最佳产酶温度的测定将种子培养液按6%(体积比)接种量接种于100 mL含有0.5%酪蛋白的PLA乳化培养基中,分别在22、27、32、37、42℃5个温度条件下,130 r/min振荡培养3 d。培养结束后,取发酵上清液测定PLA降解酶活力,结果如图8所示。当培养温度为37℃时,菌株产PLA降解酶的活力达到最高值,而在较高或较低温度培养菌株时,菌体增殖缓慢产PLA降解酶活力均有所降低。因此,菌株的最适产酶温度为37℃。
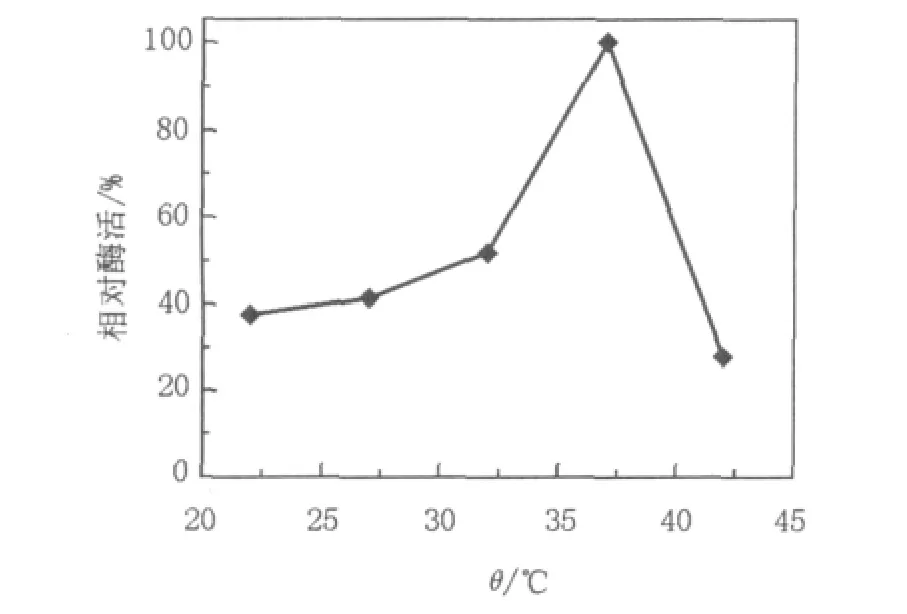
图8 不同发酵温度对产酶的影响Fig.8 Effect of temperature on enzyme formation
2.4.5 最佳产酶时间的测定为获取菌株的最高产酶活力,将种子培养液按6%(体积比)接种量接种于100 mL含有0.5%酪蛋白的PLA培养基中,在37℃,130 r/min条件下振荡培养,每隔6 h取样1次,测定发酵液上清的PLA降解活力,结果见图9。
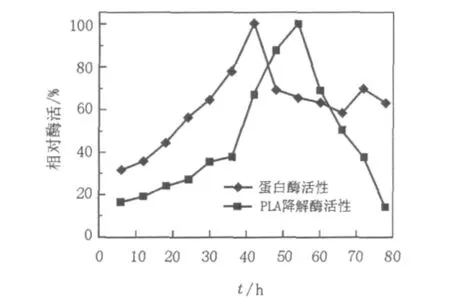
图9 不同发酵时间对产酶的影响Fig.9 Effect of time on enzyme formation
由图9可知,培养时间对菌株产酶能力有较大的影响。在培养至54 h时产PLA降解酶活力最强,此后随着培养时间的延长其产酶活力呈现下降趋势,也说明上述培养条件下,54 h为DSL09-60b菌株PLA降解酶的最佳收获时间。在对最佳培养条件下的产酶曲线进行测定的同时,也测定了该条件下菌株蛋白酶的分泌情况,结果显示当菌株培养至42 h时产蛋白酶活力最强,与PLA的产酶高峰并不重合,该结果暗示了菌株所分泌的PLA降解酶与蛋白酶之间虽然存在着相关性,但并不具有同一性。
3 讨论
从污泥中筛选出1株对PLA具有降解活力的细菌DSL09,经形态学、16S rDNA及生理生化鉴定,认为该菌株为Bacillus sp.。通过紫外诱变,获得了1株具有较高PLA降解活力的菌株,编号为DSL09-60b。测定该突变菌株的最适产酶条件为0.5%的酪蛋白诱导、初始pH 8.0、接种量6%、37℃培养54 h。
根据文献报道,目前所发现的PLA降解菌大都属于放线菌类,而分离的细菌和真菌较少,本文所筛选的Bacillus sp.对于PLA降解机制的阐明具有重要意义。
本文还根据PLA降解酶属于蛋白酶类的部分报道,尝试了应用蛋白酶活力筛选培养基对PLA降解酶活力升高的突变株进行初筛的方法,有效地提高了诱变后PLA降解菌株的筛选效率,也证明了对于Bacillus DSL09-60b,其PLA降解酶与蛋白酶确实存在一定的相关性;但同时本实验也对DSL09-60b菌株产PLA降解酶与蛋白酶的曲线进行了测定,结果显示培养至42 h时发酵液蛋白酶活力最高,而PLA降解酶活力的高峰则出现在54 h,这一结果说明菌株所分泌的PLA降解酶与蛋白酶并不具有同一性,推测DSL09-60b菌株所分泌的PLA降解酶是包含于菌株分泌蛋白酶内的1种或几种特殊的蛋白酶类。下一步的工作主要集中于降解酶的分离纯化及特性分析,进而阐明PLA的降解机制及降解酶的特殊性。
[1] K.Madhavan Nampoothiri,Nimisha Rajendran Nair,Rojan Pappy John.An overview of the recent developments in polylactide(PLA)research[J].Bioresource Technology,2010,101(22):8493-8501.
[2] 李凡,王莎,刘巍峰,等.聚乳酸(PLA)生物降解的研究进展[J].微生物学报,2008,48(2):262-268.
[3] Nishida H,Tokiwa Y.Distribution of poly(β-hydroxybutyrate)and poly(ε-caprolactone)aerobic degrading microorganisms in different environments[J].Environ.Polym.Degrad,1993,1(3):227-233.
[4] Pranamuda H,Tokiwa Y,Tanaka H.Polylactide degradation by an Amycolatopsis sp.[J].Appl Environ Microbiol,1997,63(4):1637-1640.
[5] Jarerat A,Pranamuda H,Tokiwa Y.Poly(L-lactide)-degrading activity in various actinomycetes[J].Macromol.Biosci,2002,2(9):420-428.
[6] Sakai K,Kawano H,Iwami A,et al.Isolation of a thermophilic poly-L-lactide degrading bacterium from compost and its enzymatic characterization[J].J Biosci Bioeng,2001,92(3):298-300.
[7] Jarerat A,Tokiwa Y.Degradation of Poly(L-lactide)by a Fungus[J].Macromol.Biosci,2001,1(4):136-140.
[8] 东秀珠,蔡妙英,等.常见细菌系统鉴定手册[M].北京:科学出版社,2001:62-65.
[9] 陶文沂.工业微生物生理与遗传育种学[M].北京:中国轻工业出版社,1997:51-62.
[10] 李凡.聚乳酸生物降解酶及其催化特性研究[D].山东大学,2008:33-44.

