植物抗坏血酸过氧化物酶基因家族研究进展
李 娜,陆 海
(北京林业大学生物科学与技术学院,北京 100083)
1 植物APX的酶学特征与催化机制
植物因在光合作用时释放大量的氧而面临着严峻的氧化胁迫.此外,植物在受到逆境胁迫时会产生大量氧自由基,引起膜脂的过氧化、膜蛋白发生聚合等反应,从而破坏其生物膜的结构和功能,损伤植物细胞.提高植物体内氧自由基代谢途径中的酶活力,可以增强植物抵御氧化胁迫的能力,从而增强植物耐逆能力.植物体内清除氧自由基的酶有超氧化物歧化酶(SOD)、抗坏血酸过氧化物酶(APX,EC1.11. 1.11)、谷胱甘肽还原酶(GR)、过氧化氢酶(CAT)和过氧化物酶(POD)等.其中,SOD、APX和GR可形成高效的抗坏血酸—谷胱甘肽循环.APX是以抗坏血酸(AsA)为电子供体的一种过氧化物酶.APX是植物体内尤其是叶绿体中清除H2O2的关键酶[1].
APX催化的反应为,2AsA+H2O2→2MDA(单脱氢抗坏血酸自由基)+2H2O.APX的催化循环属于过氧化物酶的“乒乓机制”,其反应如下(R表示卟啉或保守Trp残基,MDA为单脱氢抗坏血酸,反应速率为类囊体型APX的数值)[1]:
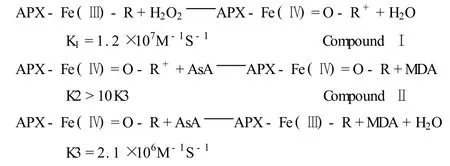
目前,APX基因序列已经在菠菜、豌豆、拟南芥、西红柿、水稻、马铃薯等植物中分离获得[2-4].此外,豌豆APX蛋白的三维空间结构也已得到鉴定[5].研究表明,APX是一种包含原卟啉IX的血红蛋白,它的分子量大约是30 kD,单体存在,但有几种cAPX则以同二聚体形式存在[6].植物过氧化物酶超家族的特征是:含组氨酸(His-42)和精氨酸(Arg-38),末端的组氨酸与天冬酰氨(Asn-71)侧链以氢键相连,而天冬酰氨(Asn-71)则以氢键与主链羰基谷氨酸(G lu-65)的羰基相连;在邻近血红素的位点,组氨酸(His-163)与血红素铁结合,并与天冬氨酸(Asp-208)形成很强的氢键,这6个残基在几乎所有的APX中都是保守的[7].
2 植物APX基因家族成员组成与细胞内分布
高等植物的APX存在着多种同工酶:一种是光合器官型,又称叶绿体型同工酶,包括位于基质中的APX(sAPX)和同类囊体膜结合的APX(tAPX);另一种是非光合器官型,在植物细胞的胞浆、线粒体和乙醛酸循环体中均有发现.另外,根据APX各同工酶所在细胞中内位置的不同,APX可分为胞质APX同工酶APX(cAPX)、质体基质APX同工酶APX(sAPX和mitAPX)、过氧化物酶体APX(mbAPX)同工酶和叶绿体类囊体膜APX同工酶APX(tAPX),前两者属于可溶性同工酶,后两者为膜结合同工酶.在细胞内,不同位置的APX同工酶具有不同的生化特性,即具有不同的分子量、底物特异性、最适pH值和对抗坏血酸的稳定性[8].研究证明,叶绿体APX同工酶比胞质APX同工酶、过氧化物酶体APX同工酶更加不稳定,在无抗坏血酸存在的条件下会迅速失活[1].
此外,研究还发现,在拟南芥中至少有6个基因编码的APX蛋白,分别是:2个胞质APX同工酶基因(At1g07890和At3g09640),2个过氧化物酶体APX同工酶基因(At4g35000和At4g35970),一个类囊体膜束APX同工酶基因(At1g77490),一个叶绿体/线粒体APX同工酶基因(At4g08390)[9].
2004年,Teixeira等[10]在水稻中分离出了8个APX同工酶基因,其中有2个胞质APX同工酶(Os-APX1和OsAPX2),2个假定的过氧化物酶体同工酶(OsAPX3和OsAPX4),还有4个假定的叶绿体APX同工酶(OsAPX5-OsAPX8),其中OsAPX8被认为是类囊体膜束APX同工酶.同时,通过使用GFP作为标签对OsAPX3和OsAPX6 2个同工酶在细胞亚结构中的定位,证明了OsAPX3定位于过氧化物酶体内,而OsAPX6定位于线粒体内.
有研究表明:APX同工酶在亚细胞结构中的定位由蛋白质C、N端区域的导肽和跨膜结构决定[11];过氧化物酶体APX同工酶的导肽组成C端的跨膜结构域,该导肽富含缬氨酸(Valine)和丙氨酸(Ala),并且伴随一个含有约5个氨基酸残基的正电荷区域[12];过氧化物酶体APX同工酶通过粗糙内质网直接定位于过氧化物酶体,并且暴露于胞质[13];与过氧化物酶体APX同工酶不同,所有的叶绿体APX同工酶在其N端具有羟基化的肽段,该部分在成熟蛋白质中将被加工处理[14].另外,类囊体膜结合APX同工酶在其C端拥有一段跨膜的疏水结构[15].
3 植物APX的组织与发育特异性表达调控
对植物来说,不同部位、不同组织的APX活性存在明显差异.
谢小群等[16]对黄芩一年生植株种子、花瓣、顶芽、叶和根中APX活性的测定结果表明,不同部位、不同组织的APX活性差异显著.其总活力顺序依次为,顶芽>叶>根>种子>花瓣.试管苗生长过程中,APX的总活力和比活力变化趋势与试管苗生长趋势呈现较好的一致性,即在生长初期,APX活性处于较低水平,7d后试管苗生长旺盛,代谢活动加强,生物量迅速增加,APX活性也随着代谢作用加强而急剧上升,此后,营养物质不断消耗,生长逐渐缓慢, APX活性下降.
Gadea等[17]对番茄果实的研究表明,在番茄成熟后期,因H2O2急剧积累,其CAT活性降到较低水平,而APX及GR受衰老影响不大,仍具有一定活性.所以,抗坏血酸—谷胱甘肽循环可能在成熟后期及衰老过程中的H2O2代谢中发挥重要作用.
冯晴等[18]的研究表明,在小麦叶片衰老过程中,APX比CAT活力下降得晚,表明APX在小麦叶片衰老的中后期起着比CAT更重要的清除H2O2的作用.APX酶的增加,可能是衰老进程对基因表达的调节.CAT存在于过氧化体、乙醛酸循环体等微体中,而APX则存在于叶绿体、线粒体、乙醛酸循环体和细胞质中,叶绿体是产生 H2O2的主要场所,因此,APX清除H2O2要比CAT更直接.此外,在叶片衰老过程中,APX活力下降较晚,可能与AsA-GSH循环途径中的单脱氢抗坏血酸自由基还原酶、双脱氢抗坏血酸还原酶及谷胱甘肽还原酶的调节有关.
4 植物APX的诱导表达特性
研究表明,在臭氧、SO2、Fe、Cu、百草枯、热击、强光等逆境条件下,细胞质APX转录水平增加,而在冷、热、紫外光、H2O2、盐、百草枯等胁迫时,过氧化物酶体APX的转录水平增加.而叶绿体APX正相反,在外界条件刺激下,其转录水平很少改变.但也有研究表明,在干旱时,小麦的类囊体APX活性增加[19],菠菜叶片中APX活性明显增加[20].另外,水杨酸(SA)能够抑制APX活性,用特定电磁波处理作物干种子和发芽种子能显著提高其APX活性.Spundova等[21]的研究表明,抗旱性不同的 2个小麦品种,其叶绿体基质APX和类囊体结合的APX在幼苗期对抗旱响应表现明显不同,说明不同定位的APX可能在H2O2清除中发挥着不同作用.
目前,研究人员对于拟南芥与水稻的相关研究研究 比 较 系 统[22,23].比 如,拟 南 芥 AtAPx1 (At1g07890)基因在植物的不同组织都有表达,并且其表达水平受各种胁迫条件的调节,AtAPx2 (At3g09640)基因在光合维管束鞘细胞层的表达受光照和植物损伤的调控.AtAPx1同工酶是拟南芥消除活性氧的重要成员.此外,Davletova等[9]通过使用基因敲除方法的研究表明,在植物受到光照胁迫条件下,胞质APX同工酶在保护叶绿体免受损伤方面发挥重要作用.
Teixeira等[24]揭示了水稻APX基因家族各基因在不同组织和各种环境胁迫条件下的表达水平的相互协调性.Hong等[25]报道了水稻根中的APX8(Os-APX 8)受盐浓度的影响较大,运用半定量反转录PCR方法,分别检测了水稻APX1~APX8 mRNA的表达水平,发现在150 mmol/L和200 mmol/L NaCl条件下,水稻根部的OsAPX8表达量有所增加,但是其他家族成员的表达量却不受影响,而在300 mmol/L NaCl的条件下,APX家族成员有着更复杂的变化, OsAPX8表达量有所增加,OsAPX7的表达量有所下降,但APX基因家族其他成员的表达量却不受影响.同样,外源脱落酸(ABA)的使用同样会提高根中OsAPX8的表达水平.
D’Arcy-Lameta等[3]研究了在3种胁迫条件下(逐渐干旱、快速干燥、施用外源脱落酸ABA)碗豆叶子中的4种APX同工酶(细胞质APX、过氧化物酶体APX、叶绿体基质APX、类囊体APX)的基因表达情况,研究表明,在干旱胁迫下,耐旱型植株的APX酶活基本不变,而干旱敏感型植株的APX酶活较对照增加了78%,这与有些文献中的报道相矛盾,作者分析指出,酶的活性应该视加于植物上的胁迫以及植物本身对胁迫的抗性和敏感性而定.干旱引起的膜损伤会导致细胞隔区的破坏,因此不可能在水分胁迫下准确地测定不同的细胞隔区的APX活性.为了更好地了解每种APX同工酶的作用,作者还克隆了不同同工酶的基因,分别研究它们在不同胁迫下的表达水平.研究表明,在快速干燥和施用外源ABA时,干旱敏感型植株的细胞质APX和过氧化物酶体APX的基因转录增加,而耐旱型植株相应同工酶的转录水平保持稳态.
Park等[26]在成功克隆甘薯的swAPX1基因后,又研究了该基因在各种非生物和生物胁迫下的表达情况.swAPX1基因只在甘薯的成熟叶片和培养的悬浮细胞中表达,在茎、储藏根和非储藏根中却没有表达,而且在悬浮细胞的生长过程中,swAPX1的表达量不断的增加.通过 RT-PCR方法,Park等发现swAPX1基因在叶片中的表达受各种非生物胁迫条件的调控.损伤、50 mmol/L甲基紫精、440 mmol/L过氧化氢或100μmol/L脱落酸条件下,swAPX1基因的表达量均明显升高.另外,在细菌病原体感染的条件,swAPX1基因的表达量也会增加.同时,该结论也证明了swAPX1基因在清除甘薯叶片中的过氧化氢方面发挥了重要作用,从而有利于植株克服非生物和生物胁迫造成的氧化损伤.
Yabuta等[27]的研究表明,在转基因烟草中,叶绿体APX在清除活性氧体系中发挥着很重要的作用,它保证了叶片的叶组织在水—水循环和光合作用中维持能量.Davletova等[9]的研究发现,在拟南芥中,如果缺乏细胞质APX时,会导致叶绿体和过氧化物酶体的的H2O2清除系统瓦解,从而不能清除光合作用和光呼吸中产生的H2O2,因而导致了H2O2含量升高,蛋白发生氧化.Hossain等[28]的研究发现, APX的活性降低是引起剑兰的花衰老的决定条件,所以,细胞质APX作为活性氧清除体系中的中心物质也是极其重要的,作用机制可能涉及到一些信号转导.
5 植物APX在基因工程中的应用
现已证实,增强植物耐逆性的途径之一是提高植物体内抗氧化酶类活性及增强抗氧化代谢的水平.转基因植物中APX的过量表达,已经被证明可以提高转基因植物的抗性.目前,研究人员已从棉花、拟南芥等植物中克隆了APX基因,并进行了部分转基因植物的研究.例如,拟南芥中tAPX的过量表达增强了对除草剂(Paraquat)诱导的光合氧化胁迫和氧化氮诱导的细胞死亡的抗性[19].此外,Wang等[29]将一个细胞质APX(cAPX)基因转入番茄中过量表达,结果显著提高了转基因番茄的抗寒和抗盐能力.Sarowar等[30]将一个辣椒APX基因转入烟草,同样提高了转基因烟草的抗氧化胁迫与抗真菌能力,同时,该实验室研究人员也将一个杨树过氧化物酶体APX基因转入烟草,同样提高了转基因烟草的抗旱耐盐能力[31].Sun等[32]将StAPX基因转入烟草,同样提高了转基因烟草幼苗的对盐与渗透胁迫的抗性.
此外,APX转基因的反义表达可以研究是否提高植物体的维生素C含量,也可以研究呼吸作用多条线路的选择性.Tarantino等[33]的研究表明,在拟南芥中降低类囊体APX的表达导致对百草枯和一氧化氮抗性的显著下降.Rizhsky等[34]的研究表明, APX及CAT的双反义植物比APX或CAT单反义植物对氧化胁迫更不敏感.
6 结 语
随着分子生物学技术与基因工程的迅猛发展,研究人员通过分离等技术手段得到了各种植物的抗逆基因,如APX、SOD、POD等.但是,目前的研究已不仅仅局限于对各种抗逆基因的分子克隆和蛋白的活性分析,学者们更关注的是其在各种胁迫条件下功能的调节以及每个成员之间的相互关系.
APX同工酶的表达状况受处于各种胁迫条件下的各个细胞区室的分别调控.因此,研究APX在植物细胞中的定位,比较逆境胁迫下细胞内APX同工酶对于氧化胁迫的敏感性以及它们活性的大小将成为今后研究的一个方向.同时,APX基因家族每个成员在植物发育的不同时期的表达调节和各个成员之间的相互协调关系也是研究的一个热点.另外,在APX同工酶表达过程中涉及的细胞信号转导,以及H2O2作为第二信使方面的研究也是一个重点.
[1]Ishikawa T,Sakai K,Y oshimura K,et al.cDNAs Encoding Spinach Stromal and Thylakoid-bound Ascorbate Peroxidase,Differing in the Presence or Absence of Their3’-coding Regions[J].FEBS Lett,1996,384(3):289-293.
[2]Sharma P,Dubey R S.Ascorbate Peroxidase from Rice Seedlings: Properties of Enzyme Isoforms,Effects of Stresses and Protective Roles of Osmolytes[J].Plant Science,2004,167(3):541-550.
[3]D’Arcy-Lameta A,Ferrari-Iliou R,Contour-Ansel D,et al.Isolation and Characterization of Four Ascorbate Peroxidase cDNAs Responsive to Water Deficit in Cowpea Leaves[J].Annals of Botany,2006,97(1):133-140.
[4]Pereira C S,da Costa D S,Teixeira J,et al.Organ-specific Distribution and Subcellular Localisation of Ascorbate Peroxidase Isoenzymes in Potato(Solanum tuberosum L.)Plants[J].Protoplasma,2005,226(3-4):223-230.
[5]Sharp K H,Moody P C E,Brown KA,et al.Crystal Structure of the Ascorbate Peroxidase-salicylhydroxamic Acid Complex[J]. Biochemistry,2004,43(27):8644-8651.
[6]孙卫红,王伟青,孟庆伟.植物抗坏血酸过氧化物酶的作用机制、酶学及分子特性[J].植物生理学通讯,2005,41 (2):143-147.
[7]Jespersen H M,K jaersgard I V H,Ostergaard L,et al.From Sequence Analysis of Three Novel Ascorbate Peroxidases from Arabidopsis Thaliana to Structure,Function and Evolution of Seven Types of Ascorbate Peroxidase[J].BiochemJ,1997,326(2):305 -310.
[8]Ishikawa T,Sakai K,Y oshimura K,et al.cDNAs Encoding Spinach Stromal and Thylakoid-bound Ascorbate Peroxidase,Differing in the Presence or Absence of Their3’-coding Regions[J].FEBS Lett,1996,384(3):289-93.
[9]Davletova S,Rizhsky L,Liang H J,et al.Cytosolic Ascorbate Peroxidase1is a Central Component of the Reactive Oxygen Gene Network of Arabidopsis[J].Plant Cell,2005,17(1):268-281.
[10]Teixeira F K,Menezes-Benavente L,Margis R,et al.Analysis of the Molecular Evolutionary History of the Ascorbate Peroxidase Gene Family:Inferences from the Rice Genome[J].Journal of Molecular Evolution,2004,59(6):761-770.
[11]Shigeoka S,Ishikawa T,Tamoi M,et al.Regulation and Function of Ascorbate Peroxidase Isoenzymes[J].Journal of Experimental Botany,2002,53(372):1305-1319.
[12]Mullen R T,Trelease R N.The Sorting Signals for Peroxisomal Membrane-bound Ascorbate Peroxidase are Within its C-terminal tail[J].Journal of Biological Chemistry,2000,275(21):16337 -16344.
[13]Mullen R T,Lisenbee C S,Miernyk J A,et al.Peroxisomal Membrane Ascorbate Peroxidase is Sorted to a Membranous Network that Resembles a Subdomain of the Endoplasmic Reticulum [J].Plant Cell,1999,11(11):2167-2185.
[14]Madhusudhan R,Ishikawa T,Sawa Y,et al.Characterization of an Ascorbate Peroxidase in Plastids of Tobacco BY-2cells[J]. Physiologia Plantarum,2003,117(4):550-557.
[15]Takeda T,Y oshimura K,Ishikawa T,et al.Purification and Characterization of Ascorbate Peroxidase in Chlorella Vulgaris [J].Biochimie,1998,80(4):295-301.
[16]谢小群,高山林.黄芩过氧化物酶同工酶电泳和抗坏血酸过氧化物酶活性分析[J].植物资源与环境学报, 2002,11(1):5-8.
[17]Gadea J,Conejero V,Vera P.Developmental Regulation of a Cytosolic Ascorbate Peroxidase Gene from Tomato Plants[J]. Mol Gen Genet,1999,262(2):212-219.
[18]冯 晴,徐朗莱,叶茂炳,et al.小麦叶片衰老过程中CAT和APX活力及其同工酶谱的变化[J].南京农业大学学报,1997,20(2):95-99.
[19]Murgia I,Tarantino D,Vannini C,et al.Arabidopsis Thaliana Plants Overexpressing Thylakoidal Ascorbate Peroxidase Show Increased Resistance to Paraquat-induced Photooxidative Stress and to Nitric Oxide-induced Cell Death[J].Plant Journal,2004,38 (6):940-953.
[20]Tanaka K,Takeuchi E,Kubo A,et al.Two Immunologically Different isozymes of Ascorbate Peroxidase from Spinach Leaves [J].Arch Biochem Biophys,1991,286(2):371-5.
[21]Spundova M,Sloukova K,Hunkova M,et al.Plant Shading Increases Lipid Peroxidation and Intensifies Senescence-induced Changes in Photosynthesis and Activities of Ascorbate Peroxidase and Glutathione Reductase in Wheat[J].Photosynthetica,2005, 43(3):403-409.
[22]Rizhsky L,Davletova S,Liang HJ,et al.The Zinc Finger Protein Zat12is Required for Cytosolic Ascorbate Peroxidase1Expression During Oxidative Stress in Arabidopsis[J].Journal of Biological Chemistry,2004,279(12):11736-11743.
[23]Chang C C C,Ball L,Fryer M J,et al.Induction of ASCORBATE PEROXIDASE2 Expression in Wounded Arabidopsis Leaves Does not Involve Known Wound-signalling Pathways but is Associated with Changes in Photosynthesis[J].Plant Journal, 2004,38(3):499-511.
[24]Teixeira F K,Menezes-Benavente L,Galvao V C,et al.Rice Ascorbate Peroxidase Gene Family Encodes Functionally Diverse Isoforms Localized in Different Subcellular Compartments[J]. Planta,2006,224(2):300-314.
[25]Hong C Y,Hsu Y T,Tsai Y C,et al.Expression of ASCORBATE PEROXIDASE8in Roots of Rice(Oryza sativa L.) Seedlings in Response to NaCl[J].Journal of Experimental Botany,2007,58(12):3273-3283.
[26]Park S Y,Ryu S H,Jang I C,et al.Molecular Cloning of a Cytosolic Ascorbate Peroxidase cDNA from Cell Cultures of Sweetpotato and its Expression in Response to Stress[J].Molecular Genetics and Genomics,2004,271(3):339-346.
[27]Yabuta Y,Motoki T,Y oshimura K,et al.Thylakoid Membranebound Ascorbate Peroxidase is a Limiting Factor of Antioxidative Systems Under Photo-oxidative Stress[J].Plant Journal,2002, 32(6):915-925.
[28]Hossain Z,Mandal A KA,Datta S K,et al.Decline in Ascorbate Peroxidase Activity—a Prerequisite Factor for Tepal Senescence in Gladiolus[J].Journal of Plant Physiology,2006,163 (2):186-194.
[29]Wang YJ,Wisniewski M,Meilan R,et al.Overexpression of Cytosolic Ascorbate Peroxidase in Tomato Confers Tolerance to Chilling and Salt Stress[J].Journal of the American Societyfor Horticultural Science,2005,130(2):167-173.
[30]Sarowar S,K im E N,K im YJ,et al.Overexpression of a Pepper Ascorbate Peroxidase-like1Gene in Tobacco Plants Enhances Tolerance to Oxidative Stress and Pathogens[J].Plant Science, 2005,169(1):55-63.
[31]Li YJ,Hai R L,Du X H,et al.Over-expression of a Populus Peroxisomal Ascorbate Peroxidase(PpAPX)Gene in Tobacco Plants Enhances Stress Tolerance[J].Plant Breeding,2009,128 (4):404-410.
[32]Sun W H,Duan M,Shu D F,et al.Over-expression of StAPX in Tobacco Improves Seed Germination and Increases Early Seedling Tolerance to Salinity and Osmotic Stresses[J].Plant Cell Reports,2010,29(8):917-926.
[33]Tarantino D,Vannini C,Bracale M,et al.Antisense Reduction of Thylakoidal Ascorbate Peroxidase in Arabidopsis Enhances Paraquat-induced Photooxidative Stress and Nitric Oxide-induced Cell Death[J].Planta,2005,221(6):757-765.
[34]Rizhsky L,Hallak-Herr E,Van Breusegem F,et al.Double Antisense Plants Lacking Ascorbate Peroxidase and Catalase are Less Sensitive to Oxidative Stress than Single Antisense Plants Lacking Ascorbate Peroxidase or Catalase[J].Plant Journal, 2002,32(3):329-342.

