新疆核桃AP1同源基因部分片段的克隆与表达分析
叶春秀,牛建新
(1石河子大学农学院园艺系,石河子832003;2新疆农垦科学院分子农业技术育种中心,石河子832000)
新疆核桃AP1同源基因部分片段的克隆与表达分析
叶春秀1,2,牛建新1
(1石河子大学农学院园艺系,石河子832003;2新疆农垦科学院分子农业技术育种中心,石河子832000)
为了分离新疆早实核桃上与花分生组织相关的基因,以早实核桃的花芽为实验材料,通过对不同植物的AP1保守区核苷酸序列分析,设计1对引物,采用RT-PCR的方法克隆获得1条长度为463 bp的PCR产物,命名为Jr AP1。该片段与其他植物的AP1同源基因序列同源性达70%~86%,推测所得的基因为AP1基因的同源基因对其全长和功能将进行进一步研究分析。初步RT-PCR分析的结果表明:Jr AP1在早实核桃的顶芽、花芽、枝条、果实、老叶、嫩叶上都有表达,说明了该基因参与了早实核桃的营养生长和生殖生长。而且其在新疆早实核桃及晚实核桃上都能够得到表达,扩增产物亮度早实核桃>晚实核桃,推测其可能在早实机制上起到一定的作用。
核桃;花分生组织;APETALA1(AP1)基因;表达特征
开花是高等植物生活史中一个质变过程,是植物个体发育过程的中心环节。高等植物花的形态建成是基因和环境共同作用的复杂过程,花在发育过程中,花器官的类型、数目和位置均受到严格的控制。花发育过程是果树生长发育过程中的重要转折时期,成花的迟早对果树产量有着直接的影响,进而影响着经济效益。果树实生树从播种到第1次开花的童期一般较长,这是一直以来困扰育种家和生产者的一大难题,诱导果树早花在育种和实践过程中均具有重要意义。控制果树花发育的基因种类繁多,决定着果树花发育的时间、特征和数量。目前,已从形态、生理、内含生化物质、激素等方面对果树成花进行探索,在果树花发育机理和调控花发育过程的方法,取得了不少研究成果,但对成花的本质机理知之甚少,若能直接研究调控果树开花的基因和克隆出这些基因,无疑将把花发育基因研究推进到新的高度,并对年周期中花芽分化机理研究提供最本质的依据[1-2]。
自从在模式植物拟南芥和金鱼草中获得控制花发育的基因以来,已经相继在许多植物上克隆得到了与开花诱导相关的基因,如,AP1(花分生组织)基因就是其中一个与开花诱导相关的重要基因,其能促进开花,在花器官形成过程中起重要作用,同时也初步构建了花器官发育过程的遗传和调控模型[7-8]。目前,在枣[3]、苹果[4]、龙眼[5]、山核桃[6]等果树上已经有相关的报道。
新疆核桃群体中的早实核桃表现出开花较早,1年能开2次花的特性引起了研究者的注意,并且期望能够通过从分子水平上对早实核桃开花机制进行研究。目前,新疆早实核桃的研究大多集中在与早实性相关的分子标记,本实验室也有相关报道[9],而对花发育相关基因的研究较少。本研究从新疆早实核桃上克隆与花分生组织发育相关的AP1同源基因,并进行进一步研究,期望得到相关基因的全序列和合适的表达载体构建体系,并对其功能进行验证分析。
1 材料与方法
1.1 材料
1.1.1 植物材料
实验材料为采自新疆省轮台资源圃的早实核桃材料新早丰及晚实核桃材料和田20号,采集花芽组织,液氮处理后-70℃保存,用于RNA的提取。
1.1.2 菌株与质粒载体
菌株为大肠杆菌XL1(为本实验室保存),PMD19-T载 体,Taq 酶,200 bp Mar ker(D514),d NTPs等购自Ta Ka Ra公司,其它均为国产分析纯试剂。
1.2 方法
1.2.1 引物设计与合成
根据 Gen Bank和相关资料[6,10],已克隆的 AP1基因序列的保守区,应用Pri mer premier 5.0引物设计软件设计1对引物,引物由上海生工生物技术有限公司合成,序列如下:
AP正:5′-GCAGCAGCTTGATACTACTCTTA -3′;
AP反:5′-GTTTTGCTCCTGTATTGCCTTCT-3′。
1.2.2 总RNA的提取及反转录
总RNA的提取方法参照本实验室改进的方法[11],提取的总RNA直接用于后续实验或-80℃保存备用。以提取的总RNA为模板进行反转,合成c DNA第一链,具体操作如下:DEPC水12.5 μL,总RNA 2.0μL,互补引物1.0μL,离心混匀,70℃水浴5 min,冰浴5 min;在冰上依次加入5×M-MLV Buffer 5.0μL,d NTP 2.5μL,RNase 1.0 μL,42℃水浴5 min;加入 M-MLV反转录酶1.0 μL,42℃水浴1 h,立即放入92℃灭活4 min,即可获得c DNA第一链,直接PCR或-20℃保存备用。
1.2.3 特异片段的克隆与分析
取上述反转录液进行PCR扩增,反应体系为:dd H2O 13.4μL,10×buffer(含 Mg2+)2.0μL,d NTPs 0.4μL,引物各1.0μL,DNA 2.0μL,Taq酶0.2μL。反应液混合后在微型离心机上微甩,置于PCR仪上进行扩增反应。反应程序为:94℃预变性5 min,94℃变性45 s,55℃退火45 s,72℃延伸80 s,32个循环,72℃延伸7 min,4℃保温。扩增产物采用1%的琼脂糖凝胶电泳检测,在紫外凝胶成像仪上观察,并记录实验结果。
对目的片段采用琼脂糖凝胶DNA回收试剂盒(DP1602)回收,将回收纯化的片段连接到PMD19-T载体上,转化到大肠杆菌 XL1-Bl ue中,利用IPTG诱导X-Gal为底物显色反应筛选可能重组子,挑取白斑于液体LB培养基中,37℃摇菌过夜,提取质粒,进行酶切和PCR鉴定。鉴定结果初步正确的菌液送上海生工测序,测序结果提交NCBI进行BLAST检索比对,利用BLASTx程序将获得的氨基酸序列与不同植物同源性进行相似性分析。
1.2.4 新疆核桃AP1同源基因在不同品种及组织中的表达
以反转录产物为模板,利用引物AP正和AP反分析该基因在新早丰、和田20号及早实核桃顶芽、花芽、枝条、果实、嫩叶、老叶不同组织上的表达。取2.0μL反转录产物为模板进行PCR反应,反应条件同1.2.3。产物采用1.2%的琼脂糖凝胶进行电泳检测。
2 结果与分析
2.1 核桃AP1同源基因的克隆
根据相关资料发表的AP1同源基因的序列保守区域设计特异性引物,以早实核桃材料花芽提取的总RNA为模板,合成c DNA,进行PCR,获得了长度为463 bp的片段,并进行克隆与鉴定(图1),得到了与预期结果大小一致的扩增产物,PCR检测与扩增产物大小一致,说明得到了重组子,将鉴定结果初步正确的菌液寄上海生工生物工程技术有限公司测序。
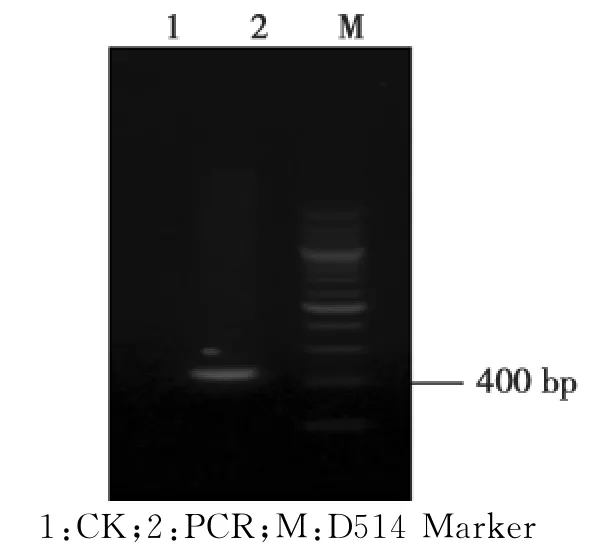
图1 Jr AP1 PCR扩增Fig.1 The PCR result of Jr AP1
2.2 核桃AP1同源基因核酸的序列分析
将测序结果采用DNA MAN或DNAstar和NCBI相关软件进行初步分析并提交,利用Gen-Bank/BLAST(局部性相似基本查询工具)进行同源性比对,结果表明获得的AP1基因的同源基因大小为463 bp(如图3),分析显示该片段含有1个最大为150 bp的开放阅读框,编码50个氨基酸。该片段与其他部分植物相关基因的同源性比对结果显示,相关基因的同源性在70%~86%(表1),其中,同源性最高的是桃(Prunus persica)和月季(Rosa hybrid cultivar),达到86%;最低的为枇杷(Eriobotrya japonica),也有70%的同源率,说明克隆得到的是核桃AP1基因的同源基因片段,命名为Jr AP1。
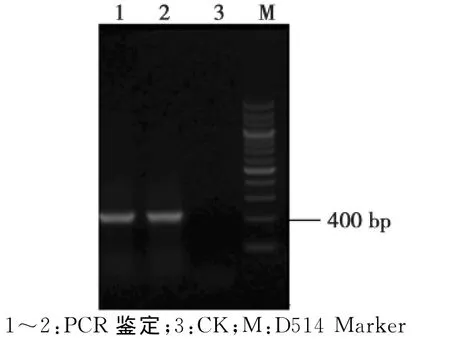
图2 质粒PCR鉴定Fig.2 The result of plasmid PCR

图3 新疆核桃AP1同源基因核苷酸及氨基酸序列Fig.3 The nucleotide and amino acid of AP1 homology gene of walnut in Xinjiang
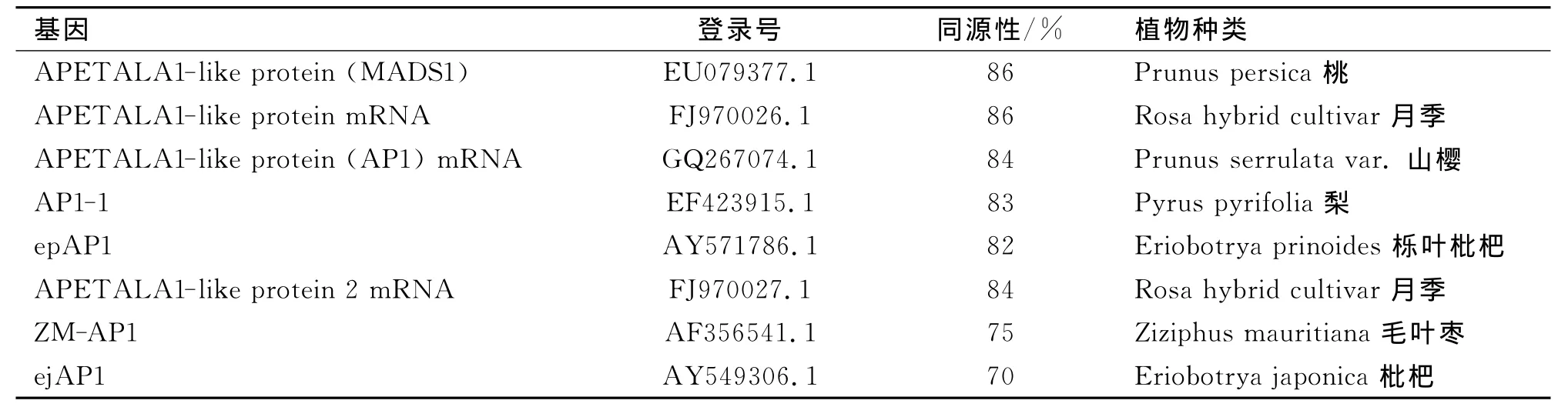
表1 Jr AP1核苷酸序列与其它植物同源性分析Tab.1 The result of compare bet ween AP1 homologous genes in Walnut and other plant
2.3 Jr AP1的表达分析
AP1基因是影响花分生组织特征的一个基因,在时空上调节花分生组织的形成和花器官的发生,是萼片和花瓣等花器官正常发育的一个必需因子。通过在早实与晚上核桃上的表达分析(图4),发现AP1同源基因在新疆早实核桃与晚实核桃之间的扩增产物亮度存在着差异,初步预测该基因在早实核桃与晚实核桃之间表达量存在着差别,且晚实核桃上的表达量低于早实核桃,推测可能是基因的拷贝数量存在差异,进而影响了基因的功能差异,这一结果需要进一步的精确定量分析进行验证。在早实核桃的不同部位的检测表明AP1同源基因在早实核桃的整个生长过程中都起着相应的作用,在早实核桃不同组织都有基因的表达,但在顶芽、花芽、枝条上的产物亮度低于在果实、嫩叶、老叶上的产物亮度(图5)。
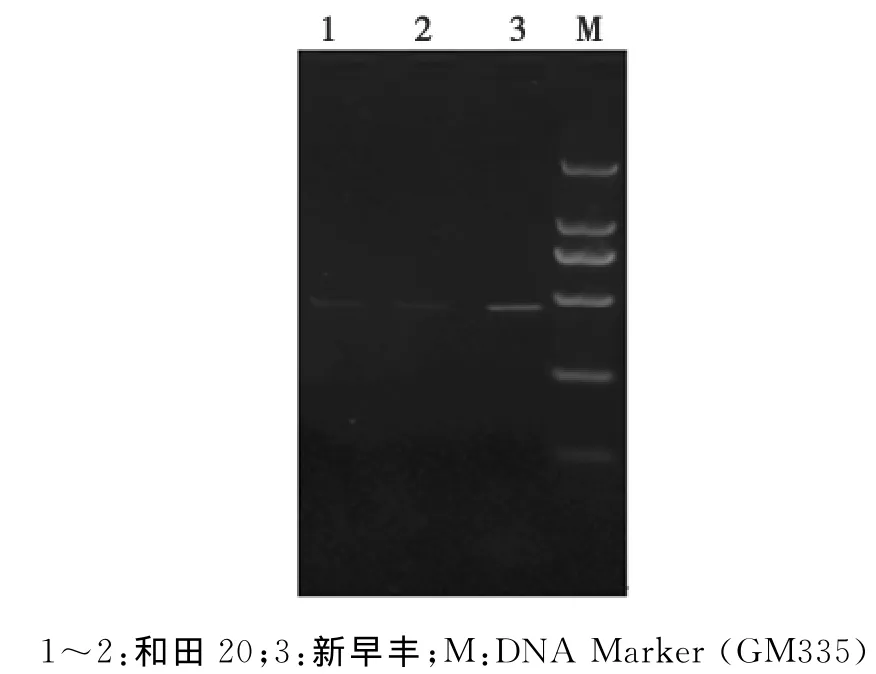
图4 AP1部分序列在早实与晚实核桃上的扩增Fig.4 Comparing AP1 partial sequence bet ween precocious and later-seeding walnut
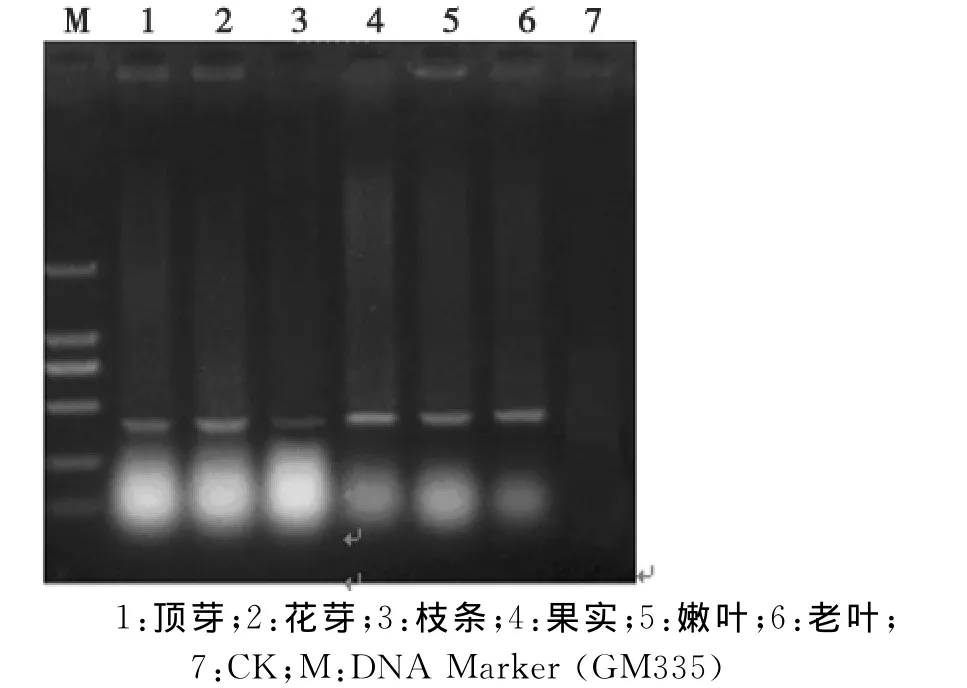
图5 AP1部分序列在早实核桃不同组织上的扩增Fig.5 Comparing AP1 partial sequence bet ween precocious and later-seeding walnut
3 讨论与结论
根据不同植物AP1保守区域设计引物,从新疆早实核桃花芽中克隆得到Jr AP1基因的c DNA部分序列,为获得该基因全长序列提供一定的研究信息。NCBI上核苷酸同源性比对结果显示:其与其它植物上的AP1基因同源性较高,说明该基因的保守性较高,即可通过较高同源性的基因推导该基因的功能。
不同核桃品种及早实核桃不同组织之间的初步表达分析显示:Jr AP1在晚实核桃与早实核桃上均有表达,且扩增产物的亮度存在着差异,推测这种差异可能在早实机制上起到直接的作用,这需要借助于于Souther n印迹杂交、荧光定量PCR进行准确的拷贝数及定量分析。该基因在早实核桃的不同组织上也都能够进行表达,说明该基因参与了核桃的营养及生殖的生长,伴随整个生长过程,属于组成型表达。其在果实和花芽上均有表达,这类似与其它大部分植物的繁殖器官表达[12],并且在果实上的表达量高于顶芽、枝条、花芽、老叶及嫩叶。在营养器官的表达方面,该基因在早实核桃上的表达与在拟南芥[13]的表达不同:在营养器官枝、叶片中也存在着基因的表达,而与枣中的Zj AP1[3]、苹果中的 MADS5[4]的表达一致。在营养器官中都存在着基因的表达,说明了该基因在早实核桃上也存在着不同于一些物种同源基因的表达特征,具体机制需要进一步研究。
[1]印华,周兆德,吴志祥.果树花发育调控基因的研究进展[J].热带农业科学,2009(1):64-68.
[2]刘淑芳,果树提早开花的分子生物学基础研究[J].杭州:浙江大学,2001.
[3]孙海峰,孟玉平,曹秋芬,等.枣中 APETALA1(AP1)同源基因的克隆及其表达特征分析[J].山西大学学报:自然科学版,2009,32(2):266-272.
[4]Yao J,Dong Y,Kvar nheden A,et al.Seven MADS-box genes in apple are expressed in different parts of the fruit[J].Amer Soc Hort Sci,1999,124:8-13.
[5]高慧颖,李韬,姜帆,等.龙眼 APETALAI(AP1)同源基因的克隆与序列分析[J].福建果树,2006(2):1-3.
[6]王正加,黄有军,夏国华,等.山核桃APETALA1同源基因的克隆与序列[J].浙江林学院学报,2008,25(4):427-430.
[7]Weigel D,Meyerowitz E M.The ABCs of floral homeofic genes[J].Cell,1994,78(2):203-209.
[8]Parcy F,Nilsson O,Busch M.A,et al.A genetic framework for floral patterning[J].Nature,1998,395:561-566.
[9]牛建新,吕建强,王林,等.核桃早实性相关性状的SCAR标记[J].果树学报,2008,25(5):732-735.
[10]安利忻,刘荣维,陈章良,等.花分生组织决定基因AP1转化矮牵牛的研究[J].植物学报,2001,43(1):63-66.
[11]马兵钢.新疆库尔勒香梨主要病毒的分子检测研究[D].儋州:华南热带农业大学,2004.
[12]Kim S,Koh J,Yoo M J,et al.Expression of floral MADS-box Genes in Basal Angioper ms:Implications for the evolution of Floral Regulators[J].The Plant Journal,2005,43:724-744.
[13]Mandel M,Gustason Brown C,Savidge B,et al.Molecular Characterization of the Arabidopsis Floral Homeotic Gene APETALA1[J].Nature,1992,360:273-277.
Cloning and Expression Analysis of the AP1 Homolog Gene in Jugl ans regia L.
YE Chunxiu,NIU Jianxin
(1 Department of Horticulture,Agricultural College,Shihezi University,Shihezi 832003,China;2 Center for Molecular Agrobiotechnology and Breeding,Xinjiang Academy of Agricultural and Reclamation Sciences,Shihezi 832000,China)
In t his experi ment,we designed a pairs of primers accor ding to the conservative regions of floral meristem identity genes-APETALA1(AP1)homologous genes.About 463 bp fragment of this homologous gene was amplified by RT-PCR using the pair of pri mers fro m t he genomic RNA of walnut.The result of blasting sequence indicates that the homology reaches 70%~86%of the other AP1 homologous gene.It was named Jr AP1.We guess this fragment was the homologous gene of AP1,and we will research its function and the full length in further.Expression analysis of Jr AP1 was detected in different tissue in precocious by RT-PCR,the result sho wed that this gene could be expressed with vegetative and reproductive growth.There were expression bet ween later-seeding walnut and precocious walnut,but the expression in early-seeding was stronger than another,it was maybe related to the character of precocious.
walnut;floral-meristem gene;APETALA1(AP1)gene;expression pattern
S722.3
A
1007-7383(2011)06-0679-04
2011-08-04
国家自然科学基金项目(30560090),新疆维吾尔族自治区重大专项(201130102-1-4)
叶春秀(1982-),女,副研究员,博士,从事果树生物技术研究;e-mail:yecx2008@163.co m。
牛建新(1962-),男,教授,博士生导师,从事果树与生物技术研究;e-mail:njx105@163.co m。

