过量表达大叶补血草LgSOS1基因对拟南芥耐盐性的影响
周玲玲,祝建波,王爱英
(石河子大学生命科学学院,石河子832003)
过量表达大叶补血草LgSOS1基因对拟南芥耐盐性的影响
周玲玲,祝建波,王爱英
(石河子大学生命科学学院,石河子832003)
将从盐生植物大叶补血草(Limonium.gmelinii(Willd.)Kuntze)中分离的质膜型Na+/H+逆向转运蛋白基因Lg SOS1构建到p CAMBIA1301植物表达载体的Ca MV35S启动子下游上,转化拟南芥,获得抗潮霉素的转基因植株。对该植株的PCR和RT-PCR检测表明,Lg SOS1已整合到拟南芥基因组中并过量表达。对转化植株的耐盐性实验结果表明:盐胁迫下转基因植株长势明显好于对照;盐分测定表明,转基因植株地上部分的Na+积累显著低于野生型的,K+含量则显著高于野生型的。这表明Lg SOS1过量表达提高了拟南芥植株的耐盐性。
Lg SOS1基因;质膜Na+/H+逆向转运蛋白;拟南芥;耐盐性
土壤盐渍化问题是困扰农业生产的一大难题,土壤中高浓度的Na+会扰乱植物正常的代谢活动,影响根细胞对K+的吸收,进而导致细胞生长停止或死亡[1-2]。Na+区隔化和 Na+外排是植物降低细胞内Na+浓度的主要方式,这一生理功能由Na+/H+逆向转运蛋白完成[3]。质膜型Na+/H+逆向转运蛋 白 则 参 与 Na+的 外 排[4-5]。Shi等[6-7]研 究 表明,拟南芥质膜型Na+/H+逆向转运蛋白At SOS1行使Na+外排功能,并控制Na+长距离运输。过量表达的遗传转化体或基因突变体的抗盐生理结果表明[8-9],质膜型 Na+/H+逆向转运蛋白可调节植物的耐盐能力。文献[10-11]研究结果表明,水稻和小麦中的质膜型Na+/H+逆向转运蛋白也行使类似的功能。
有关盐生植物的质膜型Na+/H+逆向转运蛋白功能的报道较少[12-13]。我们从泌盐盐生植物大叶补血草中克隆了质膜型Na+/H+逆向转运蛋白基因Lg SOS1[14]。
本研究将Lg SOS1导入到拟南芥,获得过量表达的转基因植株,并分析了盐胁迫下转基因植株的耐盐性,这对进一步了解LgSOS1基因的功能及其与拟南芥耐盐能力之间的关系具有一定的参考意义。
1 材料与方法
1.1 材料
1.1.1 植物材料
选用拟南芥(Ar abidopsis thaliana)Colu mbia生态型,播种于育苗营养土∶蛭石∶珍珠岩为5∶2∶2的混合介质中,每3天浇一次自来水,温度为18~22℃。
1.1.2 质粒载体及菌种
质粒载体:PCAMBIA1301;
农杆菌(Agrobacterium tumefaciens):GV3101菌株为石河子大学农业生物技术中心重点实验室提供。
1.1.3 酶及化学试剂
潮霉素溶液为Sigma公司产品,浓度为50 mg/L;卡那霉素和 Taq酶、A MV、RNAase inhibitor、Trizol试剂均购自上海生物工程公司;其它化学试剂为国产或进口分析纯。
1.1.4 仪器设备
Image Master VDS Pharmacia Biotech凝胶成像系统,Eppendorf台式冷冻离心机(德国Biofuge公司),FCP300型三恒电泳仪(北京六一仪器厂),My Cycler T M thermal cycler PCR仪器(Bio RAD公司)。
1.2 方法
1.2.1 植物的生长
拟南芥种子播种于盛满混合介质(草炭土∶蛭石∶珍珠岩=5∶2∶2)直径7 c m的培养杯中,在16 h光照、8 h黑暗的长日照条件下培养,以促进开花。当植株长至茎高约3 c m时,去除其顶生花序,以刺激腋生花序的生长。待腋生花序长出,其下部的花已有授粉现象出现时进行转化,转化前,将已授粉的花及果荚除掉。
1.2.2 菌液制备及渗透操作
挑取鉴定好的农杆菌单克隆于20 mL含有40 mg/L利福平、50 mg/L卡那霉素的LB液体培养基中,28℃250 r/min震荡培养至OD600为0.5左右。在转化前1天,以1∶10比例转接到50 mL含抗生素的新鲜LB液体培养基中培养过夜。第2天,当菌液OD600在1.2~1.6之间时取出,室温5 000 r/min离心15 min,弃上清,沉淀悬浮于相应体积的渗透培养基(蔗糖5%,Sil wet L-77 200μL/L)中,OD600在0.8左右。
将农杆菌悬浮液倒在小烧杯中,将长有拟南芥的培养杯倒扣其上,浸泡15 min。取出植株,横放在塑料盘中,用保鲜膜封好以保持湿度,放在恒温室培养。第2天打开,竖直培养,仍用保鲜膜保持湿度6-7 d。培养3-4周,待种子成熟后,收取种子。
1.2.3 转化植株的筛选
种子消毒:先用70%的乙醇浸泡2 min,再用1%NaCl O溶液涡漩洗涤15 min,无菌水漂洗5次,用0.1%的琼脂重悬浮种子,均匀分散到固体筛选培养基(1×MS,3%蔗糖,0.8%琼脂,p H 5.7,潮霉素30 mg/L)表面,放入培养室培养。大约2周后即可区分转化植株与未转化植株,将转化植株移栽到土壤中生长以收取种子。
1.2.4 转化植株的遗传分析
为得到纯合的转基因株系,转化植株要自交三代以上。
取T1代所结种子,表面消毒后播种于含30 mg/L潮霉素的固体筛选培养基上,萌发2周后统计绿苗和黄苗的分离比例(T1代分离比,单位点插入应为3∶1),将绿苗移栽到土壤中,培养至成熟,单株收取种子为T2代种子。
将T2代种子播种于含30 mg/L潮霉素的固体筛选培养基上,其中转基因植株纯合子不再发生分离,这些植株所结出的T3代种子即为转基因植株的结合系,用于耐盐性实验。
1.2.5 转基因植株的PCR和RT-PCR鉴定
提取部分转基因植株和野生型拟南芥的基因组总DNA,分别用 P1(CCTTAGAGGCGTTTGGTGAT)和 P2(AAAATAAGCAACATGATATGGAAGA)这对基因特异性引物进行PCR扩增,并以质粒CA MBIA1301-LgSOS1作阳性对照。
为了检测转化植株中LgSOS1基因是否表达,进行了RT-PCR检测。
其检测过程主要如下:采用Trizol RNA提取试剂提取一个转基因的纯系和野生型拟南芥的RNA,分别取10μL RNA,2.0μL Oligo d T,70℃5~10 min,冰浴5 min,再加入4μL 5×RT buffer,1.0μL d NTP (10 mmol/L),2.0μL Mg Cl2,0.5 μL RNase Inhibitor,0.5μL A MV 反转录酶,反应体积20μL,37℃1 h;70℃10 min。以反转录产物作为模板,利用P1、P2引物进行PCR扩增,扩增产物经1%琼脂糖凝胶电泳后用凝胶成像系统照相。
1.2.6 盐胁迫处理
将转基因植株和野生型的种子直接播种于混合介质中,用Hoagland营养液定期浇灌。每组3个重复,每个重复包含5棵植株,于8 h光照、16 h黑暗的短日照条件下培养,以促进其营养生长。
培养28 d后,分别用0、100、150、200 mmol/L Na Cl处理。Na Cl的浓度逐渐增加,每隔一天处理一次,每次处理增加50 mmol/L,待一起达到处理终浓度后,隔一天再继续用终浓度处理7 d,对照浇灌Hoagland营养液。
观察植株的生长情况,分别取其地上部和根用于干、鲜重及离子含量的测定。
1.2.7 干、鲜重的测量
收取整株植株,用蒸馏水和去离子水将其冲洗干净,用吸水纸吸干其表面水分,并将其小心分成根和地上部分,测量鲜重。之后放入烘箱中,120℃烘烤30 min,再在80℃烘烤48 h至恒重,称量干重。
1.2.8 Na+、K+离子含量的测定
将上述烘干至恒重的干材料碾磨成粉末,取一定量的粉末,用8 mL 65%浓硝酸和3 mL 30%双氧水消解样品,过滤后定容至50 mL,取部分样品溶液用i CAP等离子体发射光谱仪测定K+、Na+含量。
2 结果与分析
2.1 转基因拟南芥的筛选及遗传分析
将转基因拟南芥T0、T1、T2、T3代种子在含30 mg/L潮霉素的MS培养基上筛选,得到转Lg SOS1植株,对其进行了分子鉴定和耐盐性分析。
2.2 转基因植株的PCR鉴定
以野生型拟南芥的DNA作对照,用Lg SOS1特异性引物P1和P2进行PCR扩增分析,结果如图1所示。
由图1可知:现转化植株中都可以扩增出大小约为1800 bp左右的目的条带,与预期的片段大小相吻合,而对照植株没有出现相应的扩增条带,这表明目的基因的确已经整合到拟南芥的基因组中。
2.3 转基因植株的RT-PCR鉴定
提取经PCR检测为阳性的转化植株及对照植株的总RNA,进一步作RT-PCR鉴定,转化植株中Lg SOS1基因的表达情况见图2。
图2显示:转化植株中Lg SOS1基因已经正常转录,野生型拟南芥没有出现相应的扩增条带,说明在转化植株中Lg SOS1基因已在转录水平上得到了表达。
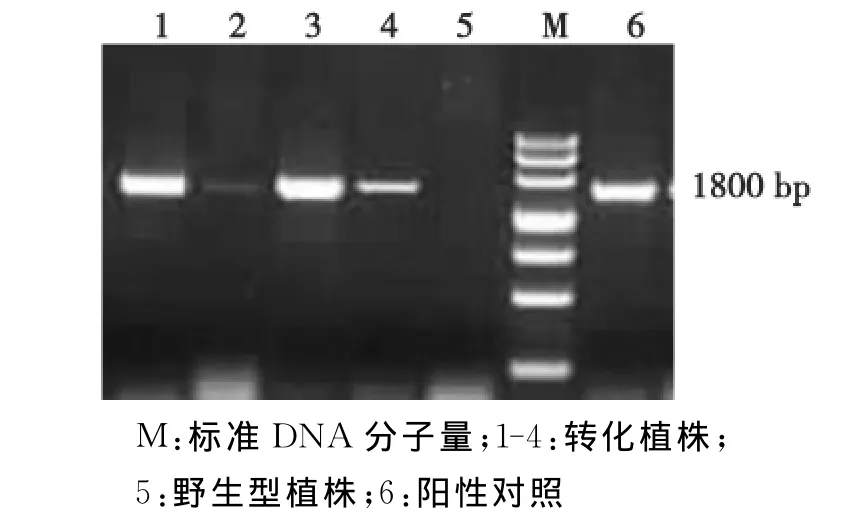
图1 转LgSOS1植株的PCR鉴定Fig.1 PCR identification of LgSOS1 in wild type and transgenic plants
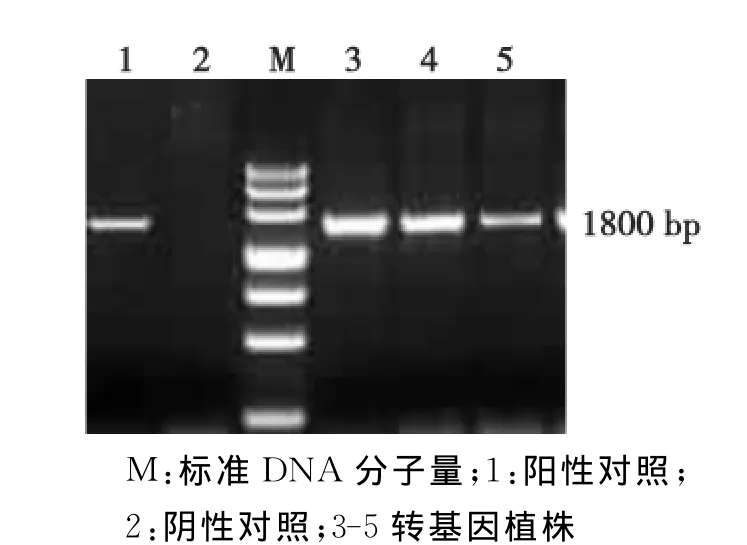
图2 转LgSOS1植株的RT-PCR鉴定Fig.2 RT-PCR identification of LgSOS1 in wild type and transgenic plants
2.4 转基因植株的耐盐性分析
2.4.1 转基因植株在不同盐胁迫处理条件下的生长情况
分别用不同浓度的Na Cl处理野生型和转基因植株,其生长情况如图3所示。
由图3可见:转基因植株在0 mmol/L Na Cl中的生长与野生型植株没有明显差异,说明外源基因的插入和表达没有影响植物正常的生长。在不同浓度NaCl处理下,野生型植株和转基因植株的生长都受到抑制,但转基因植株的长势明显好于野生型。
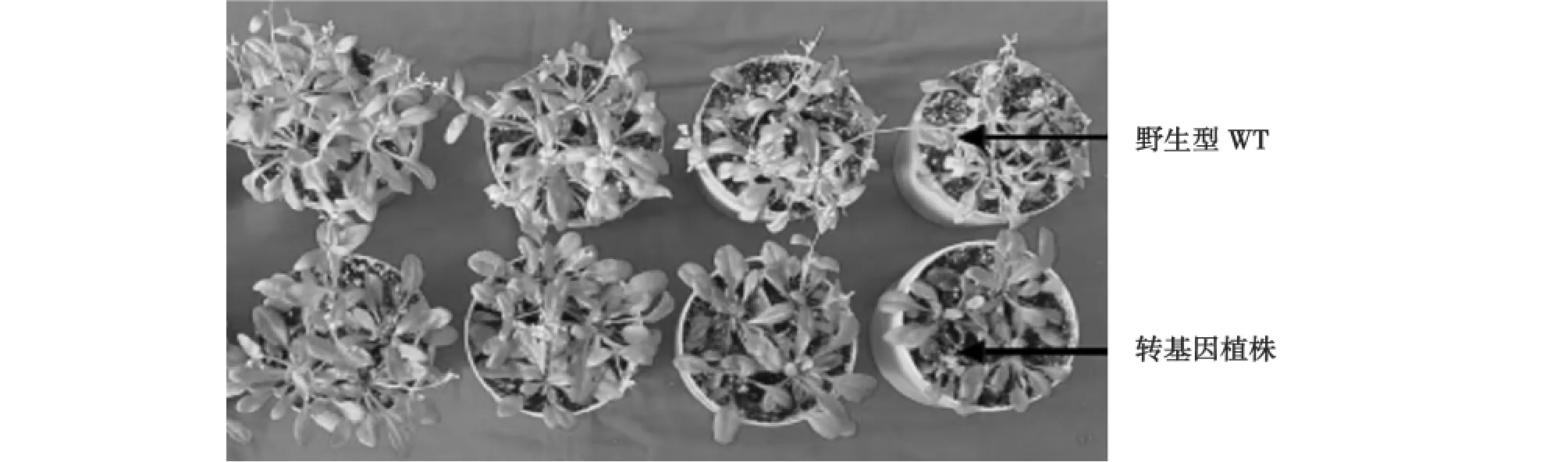
图3 野生型植株和转基因植株在0,100,150,200 mmol/L Na Cl处理后的生长比较Fig.3 Comparing the growth of wild type plants and transgenic plants with 0,100,150,200 mmol/L Na Cl treat ment
2.4.2 盐处理对转基因植株和野生型植株鲜重和干重的影响
结果见图4。
由图4可知:在盐胁迫下,转基因植株地上部分和根的鲜重以及干重与野生型植株一样均下降,当NaCl浓度达150~200 mmol/L时,转基因植株地上部分鲜重显著高于野生型,而根的鲜重与对照差异未达到显著水平;在同样NaCl浓度下,转基因植株地上部分干重与对照差异未达到显著水平,但根的干重却显著高于对照(P<0.05)。
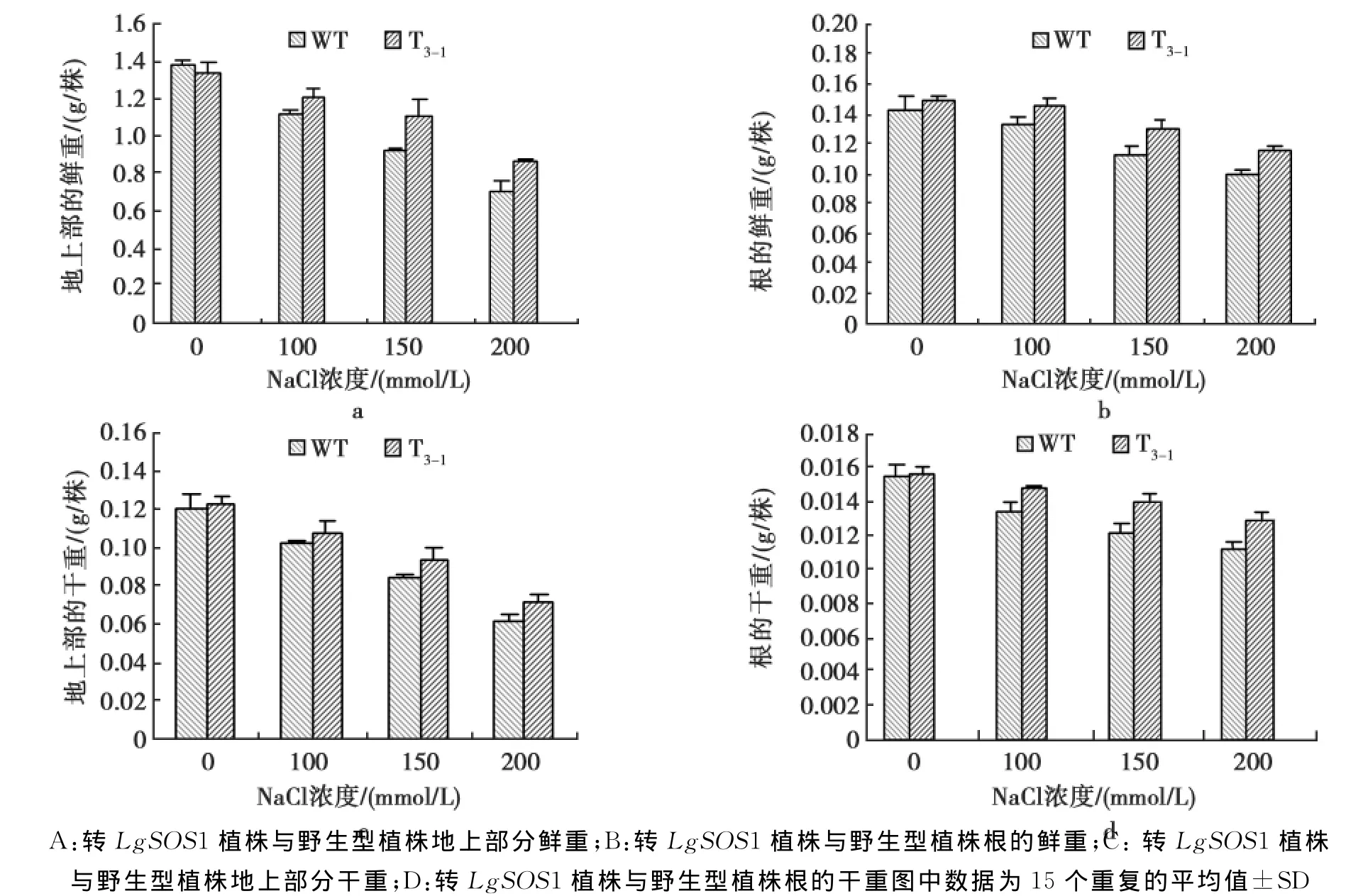
图4 盐处理对转基因植株与野生型植株鲜重和干重的影响Fig.4 Effect of Na Cl treatment on the fresh weight and dry weight of transgenic plants and wild plants
2.4.3 盐处理对转基因植株与野生型植株Na+、K+含量的影响
结果见图5。
图5显示:与0 mmol/L Na Cl处理相比较,在不同浓度NaCl处理条件下,野生型和转基因植株地上部分的Na+含量均有所增加。在100 mmol/L Na Cl条件下,与野生型对照相比,差异不明显;在150~200 mmol/L Na Cl条件下,转基因植株中Na+含量显著低于野生型(P<0.05),而野生型和转基因植株的K+含量均有所减少。在不同浓度NaCl处理条件下,转基因植株地上部分的K+含量与对照的差异达到显著和极显著水平(200 mmol/L)。
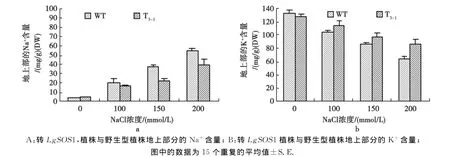
图5 盐处理对转基因植株与野生型植株Na+、K+含量的影响Fig.5 The Na+ (A)、K+ (B)contents of wild type plants and the transgenic plants under different concentration of NaCl treatment
3 讨论
高等植物的排Na+机制主要与质膜Na+/H+逆向转运蛋白有关[15]。SOD2过量表达的拟南芥在盐胁迫下降低细胞内Na+含量,并显著增强转基因植物的耐盐性[16]。Hamada A等从蓝藻中克隆了编码质膜Na+/H+逆向转运蛋白基因Syn Nhap,明确其在Na+运输中起重要作用[17]。王姝杰等将蓝藻质膜Na+/H+逆向转运蛋白基因Nhap转入烟草,F1代转基因烟草的耐盐性得到了显著的提高[18]。
本研究将大叶补血草SOS1基因转入到拟南芥中进行过量表达后,Na Cl胁迫下转基因植株的长势好于野生型,并且转基因植株的鲜重、干重均高于野生型,说明盐胁迫下转基因植株有较强的耐盐表型,保持了良好的长势。另外,Na+和K+含量分析表明,150~200 mmol/L Na Cl条件下转基因植株地上部分Na+含量显著低于野生型(P<0.05),说明在盐胁迫下SOS1将Na+转运出细胞,与植物的耐盐性直接相关。
尽管转基因植株和野生型的K+含量均明显下降,但转基因植株K+含量下降幅度却显著低于野生型。这可能是野生型植株细胞中过多的Na+干扰了细胞对K+的营养吸收,而转基因植株中可能通过催化Na+/H+逆向转运蛋白的跨膜运输将Na+排出细胞外,从而维持细胞内低钠高钾的生理环境,发挥了该基因的耐盐性。在200 mmol/L NaCl处理条件下,1周后有部分野生型植株出现白化及死亡现象,可能是因为细胞中Na+积累过多,引起了次级氧化胁迫,对植物体造成了过多的伤害,从而引起植株白化死亡。
本研究结果表明:过量表达Lg SOS1基因的拟南芥比野生型具有较强的耐盐能力,表明Lg SOS1在盐胁迫下参与了转基因植株Na+的外排。Na+/H+逆向转运蛋白在耐盐中具有重要作用,随着编码Na+/H+逆向转运蛋白基因的发现及对其作用机制了解的加深,人们将进一步认识Na+/H+逆向转运蛋白功能特征及其信号传导的调节途径,有望在作物耐盐的研究方面取得重要突破,在实际生产和应用方面真正做出贡献。
[1]Apse M P,Aharon G S,Snedden W A,et al.Salt tolerance conferred by overexpression of a vacuolar Na+/H+antiporter in Ar abidopsis[J].Science,1999,285:1256-1258.
[2]Zhu J K.Plant salt tolerance[J].Trends Plant Science,2001,6:66-71.
[3]Niu X M,Bressan R A,Hasegawa P M,et al.Ion homeostasis in NaCl stress environment[J].Plant Physiol,1995,109:735-742.
[4]Blumwald E.Sodium transport and salt tolerance in Plants[J].Curr Opin Cell Bio,2000,12:431-434.
[5]Shabala L,Cuin T A,Newman L,et al.Salinity-induced ion flux Patter ns from the exeised roots of Arabidopsis sos mutants[J].Planta,2005,222:1041-1050.
[6]Shi H,Ishitani M ,Kim C,et al.The Arabidopsis Thaliana Salt Tolerance Gene SOS1 Encodes a Putative Na+/H+Antiporter[J].Proc Natl Acad Sci USA,2000,97:6896-6901.
[7]Shi H Z,Quintero F J,Pardo J M,et al.The putative plasma membrane Na+/H+antiporter SOS1 controls long-distance Na+transport in plants[J].The Plant Cell,2002,14:465-477.
[8]Ohta M,Hayashi Y,Nakashi ma A,et al.Introduction of a Na+/H+antiporter gene from Apriplexgmelini confers salt tolerance to rice[J].FEBS Lett,2002,532:279-282.
[9]Shi H,Lee B H,Wu S J,et al.Overexpression of a plasma membrane Na+/H+antiporter gene i mproves salt tolerance in Ar abidopsis thaliana [J].Nat Biotech,2003,21(1):81-85.
[10] Martinez-Atienza J,Jiang X Y,Garciadeblas B,et al.Conservation of the salt overly sensitive pathway in rice[J].Plant Physiol,2007,143:1001-1012.
[11]Xu H X,Jiang X Y,Zhan K H,et al.Fuctional eharacterization of a wheat Plas ma membrane Na+/H+antiporter in yeast[J].Arch Biochem Bio Phys,2008,473:8-15.
[12]程玉祥.星星草质膜型Na+/H+逆向转运蛋白基因的克隆和特性分析[J].植物生理学通讯,2008,44(1):59-60.
[13]程玉祥.过量表达星星草Pt SOS1提高拟南芥的耐盐性[J].植物生理学通讯,2008,44(6):1125-1130.
[14]周玲玲,祝建波,曹连莆.大叶补血草Na+/H+逆向转运蛋白基因(SOS1)的克隆与序列分析[J].园艺学报,2009,36(9):1353-1358.
[15]Apse M P,Blu mwald E.Na+transport in Plants[J].FEBS Lett,2007,581:2247-2254.
[16]Xiuhua Gao,Zhonghai Ren,Yanxiu Zhao,et al.Overexpression of SOD2 Increases Salt Tolerance of Ar abidopsis[J].Plant Physiology,2003,133:1873-1881.
[17]Hamada A,Hibino T,Nkamura T,et al.Na+/H+antiporter fro msynechocystis species Pcc 6803,ho mologous to SOS1,contatns an aspartic residue and long C-terminal tail,Important for the carrier activity[J].Plant Physiology,2001,125:437-446.
[18]王姝杰,王法龙,李世访等.转 Na+/H+antiporter(Nhap)基因烟草植株的获得及耐盐性鉴定[J].农业生物技术学报,2006,14(1):74-78.
Influence on Salt Tolerance of Arabidopsis thaliana by Overexpressing LgSOS1
ZHOU Lingling,ZHU Jianbo,WANG Aiying
(College of Life Science,Shihezi University,Shihezi,832003)
The cDNAs of Lg SOS1(Gen Bank aceession No.EU780458),a plasma membrane Na+/H+antiporter gene Lg SOS1 separated from halophyte Limonium gmelinii (Wildl.)Kuntze,were inserted into plant vector pCA MBIA1301.Arabidopsis thaliana wild-type(WT)plants were trans for med with Agrobaterium tumefaciens containing the resultant vectors under the control of Ca MV 35S promoter,and hygro mycin-resistant plants were obtained.PCR analysis indicated that Lg SOS1 gene was integrated into the genome of Arabidopsis.RT-PCR analysis revealed that transgenic plants over-expressed the Lg SOS1 in the transcript levels.Salt stress assay showed that the transgenic plants grew more vigorously than wild-type plants.It was implied by salt contents measure analysis that,compared with WT Plants,Na+accumulation was remarkably lower and the K+level was obviously higher in transgenic plants under severe salt stress(150~200 mol/L NaCl).These results showed that Lg-SOS1-overexpression improved salt tolerance of Arabidopsis transgenic plants.
Lg SOS1 gene;plasma membrane Na+/H+antiporter;Arabidopsis thaliana;salt tolerance
TB332
A
1007-7383(2011)06-0731-06
2011-08-23
国家转基因专项(2011ZX080052004),石河子大学高层次人才启动项目(RCZX200903)
周玲玲(1966-),女,副教授,从事植物基因工程研究;e-mail:Linglingzh@shzu.edu.cn。

